类风湿关节炎遗传多态性及NSAID药物临床疗效的研究
2011-08-07刘瑞平赵公吟韩云芳徐南伟
刘瑞平,赵公吟,韩云芳,张 辉,徐南伟
(南京医科大学附属常州二院,1.骨科;2.中心实验室,江苏常州,213003)
类风湿关节炎(RA)是一种常见的慢性炎性疾病,病因还未完全明确,但在世界上有数百万人患病。RA常见的临床表现包括从轻微的关节肿胀到严重的进行性的骨及软骨破坏的多关节炎。同其他自身免疫性疾病相似,女性比男性更加易感。RA的发病过程还不是完全明确,除了感染,激素和环境因素等原因,一些证据表明RA与遗传因素有关。研究表明RA发病的一致性在同卵双生子(15%)远高于异卵双生子(3.6%),RA的遗传因素占50%~60%,提示患者的遗传背景在RA发病过程中起重要作用[1]。
环氧合酶(COX)又称为环氧化酶和前列腺素(PG)内过氧化物合成酶。COX的主要功能是将花生四烯酸转变成PG,PG参与体内的许多生理和病理过程。COX家族主要有两个亚型,分别是COX-1和COX-2。环氧合酶在许多生物进程中起重要作用,包括免疫功能和炎症、细胞增殖、血管生成等,与 RA发病过程有关。PG和COX-2在炎症过程中起重要作用,COX-2同时表现出炎症前体细胞因子或抗炎特性,COX-2抑制剂现在被用来治疗RA[2-3]。许多研究发现个体对RA的发生有易感性,与个体遗传差异有关,因此可以进行COX-2基因多态性与RA发生易感性的研究。本研究以MALDI-TOF MS技术,进行以医院为基础的病例-对照研究,探讨COX-2单核苷酸多态性与发生危险因素的相关性,以及NSAID药物的临床疗效,现报道如下。
1 材料与方法
1.1 材料
选择2010年9月~2011年4月在常州第二人民医院、常州第一人民医院和常州市中医院收集的RA患者214例,RA患者均符合1987年美国风湿病学会(ACR)修订的RA分类标准[4]。对照组478例,为同一时期在上述3家医院住院的非免疫性疾病患者,主要为外伤性疾病。所有对象来自江苏省常州市及其周边地区,均为汉族人群。2组年龄、性别差异均无显著性(P>0.05)。其中有60例的RA患者给予NSAID药物治疗,并进行了详细的随访。
1.2 方法
1.2.1 分析基因多态性:在获得书面的知情同意书后,对RA患者及对照均使用特定的调查表进行问卷调查,空腹采集2 mL EDTA抗凝血,1 h内用4 000 r/min离心 10 min,分离白细胞层,采用Qiagen DNA提取试剂盒提取DNA。SNP分型采用美国 Sequenom公司的 MassARRAYTM Analyzer技术平台进行SNP检测。PCR引物和单碱基延伸引物均由Assay Designer 3.1软件包设计。引物合成后,所有DNA样本稀释到30~50 ng/μ L,取 1 μ L,将其与 1.8 μ L 水 、0.5 μ L 10×PCR 缓冲 液 、0.4 μ L MgCl2 、0.1 μ L dNTP 、1 μ L PCR 引 物以及 0.2 μ L HotStar Taq 酶(Qiagen)混合在一起。PCR反应条件:95℃,2 min;95℃,30 s;56℃,30 s;72℃,1 min;共45个循环;最终 72℃5 min,降温至 25℃。PCR扩增后,剩余的dNTP将被去磷酸消化掉,反应体系包括 1.53 μ L 水 、0.17 μ L SAP 缓冲液 、0.3 U 碱性磷酸酶。该反应在37℃进行40 min,然后85℃,5 min使酶失活;降温至25℃。碱性磷酸酶处理后,针对SNP的单碱基延伸引物在下列反应体系中进行 :0.619 μ L 水 、0.2 μ L 10×iPLEX 缓冲液 、0.2 μ L 终止混合物 、0.041 μ L iPLEX 酶,0.94 μ L的延伸引物。单碱基延伸反应在下列条件下进行:94℃,30 s;94℃,5 s;52℃,5 s;80℃,5 s;5个内部循环;72℃,3 min。共40个外部循环;降温至25℃。最后在终止反应物中加入6 mg阳离子交换树脂脱盐,混合后加入25 μ L水悬浮。使用 MassARRAY Nanodispenser将最终的分型产物点样到一块384孔的 spectroCHIP(Sequenom)上,并用基质辅助激光解吸电离飞行时间质谱仪进行分析。最终结果由MassARRAYRT软件系统实时读取,并由 MassARRAY Typer 4.0软件系统完成基因分型分析,见图1。10%的样本接受重复检测,以验证检测的准确度。计算COX-2多态性位点变异基因型与野生型纯合型致RA的相对风险度。
图1 RACOX-2 rs5275多态性位点MALDI-TOF MS基因分型图
1.2.2 用药:60例使用NSAID药物的 RA患者,用药3月后调查药物疗效,检查使用药物前后压痛和肿胀的关节数,实验室测量使用药物前后患者的血沉,并进行DAS28评分。
2 结 果
2.1 一般情况比较
本研究包含有214名 RA患者和380名对照,其中有60例患者使用NSAID药物,RA患者平均年龄(54.63±15.77)岁,对照(54.84±10.45)岁,RA患者中有28.5%患者为男性,对照中有25.3%为男性。年龄与性别构成无显著性差异,分析遗传多态性P值分别为0.859和0.378。显示年龄性别匹配较好,见表1。
2.2 遗传平衡检验
对照人群的COX-2位点基因型经过Hardy-Weinberg遗传平衡检验,P值符合Hardy-Weinberg遗传平衡定律(P=0.131),说明该人群COX-2位点基因型频率处于平衡状态,具有群体代表性。
2.3 COX-2位点基因型分布与RA易感性关系
在单个位点的分析中,作者发现RA病例和对照中COX-2多态性位点频率无明显差异。在COX-2位点中,Logistic回归发现与携带COX-2 T T基因型的个体相比较,携带COX-2 CC等位基因型与RA的发病风险无明显相关(OR=1.17,95%CI=0.53~2.54);Logistic回归发现隐性模型中相对于T T+TC基因型,携带CC基因型与RA的发病风险无明显统计学差异(OR=1.08,95%CI=0.50~2.34)。见表2。
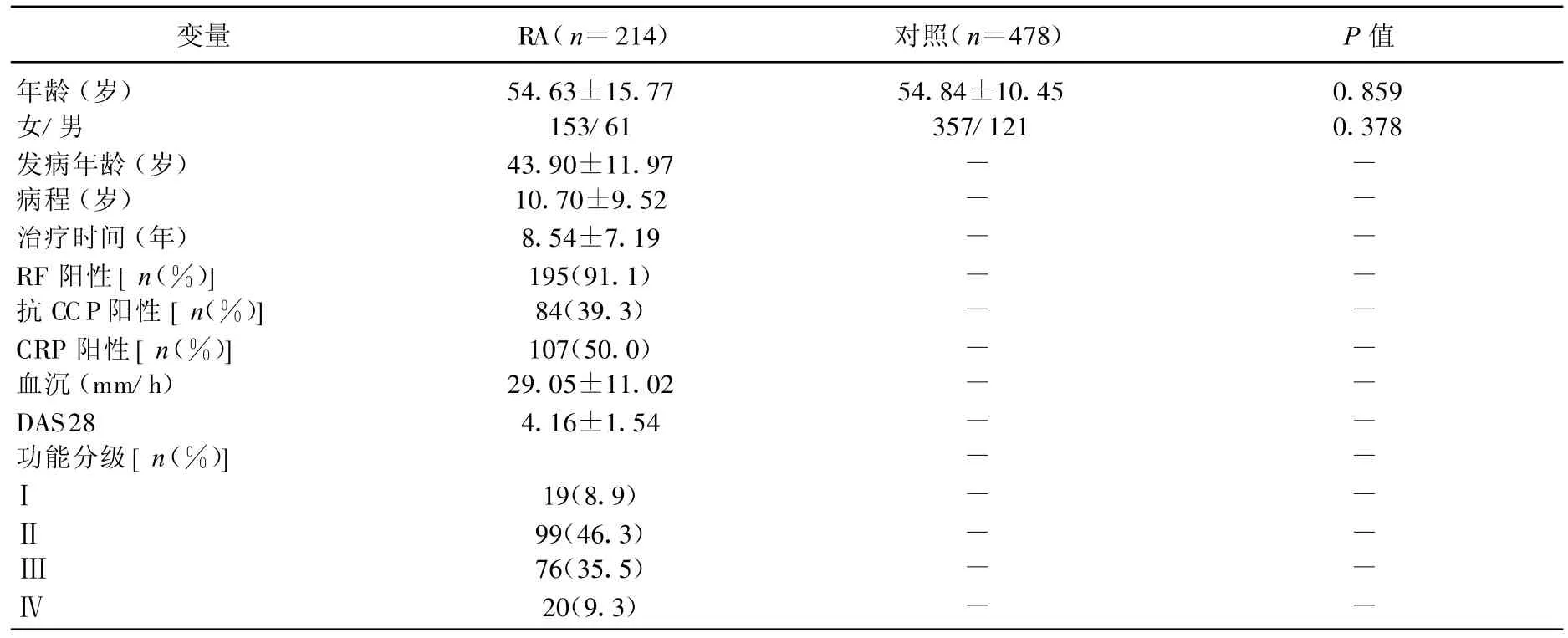
表1 RA病例及对照的基本信息( x±s)
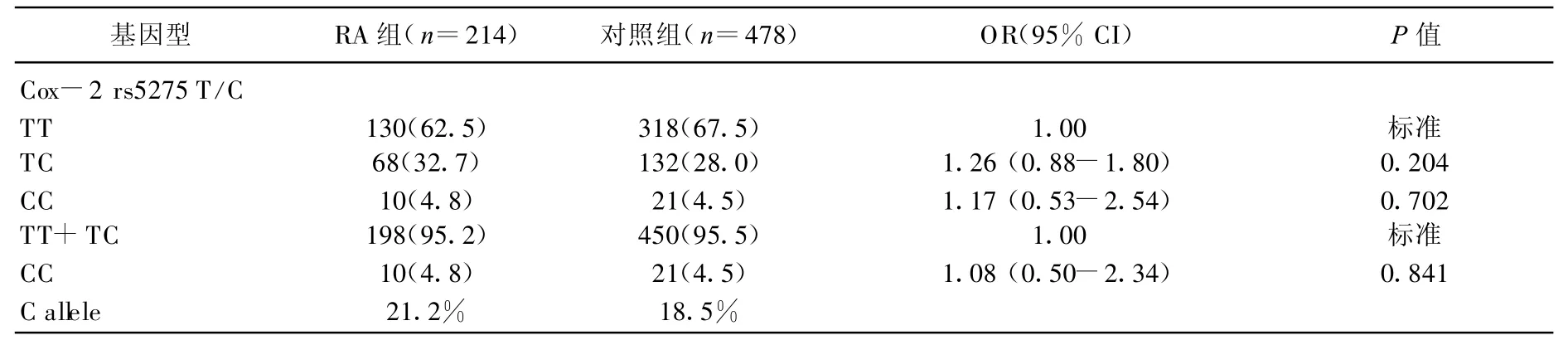
表2 C OX-2 rs5275多态性和RA危险关系的Logistic回归分析[n(%)]
2.4 NSAID药物治疗效果的比较
分析NSAID药物使用前后的疗效,治疗前DAS28评分为(6.06±1.10),治疗后 3个月DAS28评分为(4.67±1.06),DAS28评分明显降低(P<0.01),表明NSAID药物治疗具有显著的临床疗效。
3 讨 论
在本病例对照研究中,研究了中国人群中COX-2 rs5275多态性位点和RA的关系,发现COX-2 rs5275多态性可能与RA发病危险性无关。同时本研究证明NSAID药物治疗RA具有显著的临床疗效。炎症反应是RA的发病的重要的分子机制之一,另一重要机制是刺激因素诱导了核内基因表达的改变,从而诱发滑膜细胞的增殖。COX可以催化使游离的花生四烯酸转化为前列腺素H2(前列腺素的前体)、前列环素和血栓素[5]。前列腺素E2是RA中关键的影响关节的炎性介质,前列腺素E2除介导疼痛和炎症外,前列腺素E2升高可导致关节和骨的侵蚀[6]。前列腺素E2的产生与对代谢性刺激物(例如炎症细胞因子前体、脂多糖等)的反应导致的COX-2(炎性区域前列腺素 E2产生的限速酶)升高有关[7-8]。
COX-2表达也可由转录因子如核因子κ-B(NF-κ B)诱导,随后,COX-2活化可能通过活化过氧化物酶体增殖物活化受体γ(PPAR-γ)及改变膜屏障功能从而抑制NF-κ B[9-10]。之前的研究发现COX-2 rs5275可能与韩国人群中颅内出血易感性无关,但与非小细胞肺癌放疗后毒性有关[11-12]。但本研究未发现COX-2 rs5275多态性与RA易感性有关。
本研究对照基因型符合Hardy-Weinberg遗传平衡(P=0.131),说明对照人群选择具有代表性。NSAID类药物对RA疗效显著,但也要注意它们的不良反应,非选择的NSAID类药物具有较强的胃肠道反应和肾毒性,选择性的COX-2抑制剂虽然胃肠道反应小,其临床疗效亦降低,同时可增加心脑血管疾病的发病风险。
本研究存在以下不足:①本研究以医院为基础的病例对照研究,不可能完全排除选择偏倚,需要进行大样本的以人群为基础的病例对照研究以阐明COX-2 rs5275多态性与 RA危险性关系;②尽管本研究样本数量为214例RA和478例对照,但本研究的样本量仍然不能完全发现频率较低的变异与RA危险性关系;③需要进行COX-2 rs5275多态性功能学的研究,需要在以后的研究中进一步阐明功能学的相关性,以及进行药物遗传学方面的研究,如COX-2选择性抑制类NSAID药物的遗传相关性等。
[1] Peng S,Duggan A.Gastrointestinal adverse effects of nonsteroidal anti-inflammatory drugs[J].Expert Opin Drug Saf,2005,4(2):157.
[2] Okayama M,Hayashi S,Aoi Y,et al.Aggravation by selective COX-1 and COX-2 inhibitors of dextran sulfate sodium(DSS)-induced colon lesions in rats[J].Dig Dis Sci 2007,52(9):2095.
[3] Sheibanie A F,Yen J H,Khayrullina T,et al.The proinflammatory effect of prostaglandin E2 in experimental inflammatory bowel disease is mediated through the IL-23-IL-17 axis[J].J Immunol 2007,178(2):8138.
[4] Arnett F C,Edworthy S M,Bloch D A,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum 1988,31(3):315.
[5] Rouzer C A,Marnett L J.Cyclooxygenases:structural and functional insights[J].J Lipid Res,2009,50(Suppl):S29.
[6] 范雪娇,仇小强,余红平,等.COX-2基因单核苷酸多态性与肝细胞癌关联的研究[J].中华肿瘤防治杂志,2011,18(6):405.
[7] 李玉生.溃疡性结肠炎患者血清PGE2、PAF水平变化及其临床意义[J].实用临床医药杂志,2010,14(11):17.
[8] 姜林娣,王汉洲,赵风娣,等.RNAi抑制类风湿关节炎成纤维细胞环氧合酶-2合成及对炎症因子的影响[J].中华风湿病学杂志,2007,11(5):275.
[9] Scher J U,Pillinger M H.The anti-inflammatory effects of prostaglandins[J].J Investig M ed,2009,57(6):703.
[10] Wallace JL.COX-2:a pivotal enzyme in mucosal protection and resolution of inflammation[J].ScientificWorldJournal,2006,6:577.
[11] Kim D H,Ahn W Y,Kim D K,et al.A Promoter polymorphism(rs17222919,-1316T/G)of ALOX5AP is associated with intracerebral hemorrhage in Korean population[J].Prostaglandins Leukot Essent Fatty Acids,2011,85(3-4):115.
[12] Hildebrandt MA,Komaki R,Liao Z,et al.Genetic variants in inflammation-related genes are associated with radiation-induced toxicity following treatment for non-small cell lung cancer[J].PLoS One,2010,5(8):e12402.
