RP-HPLC法测定北虫草发酵培养物中虫草素的含量
2011-08-07刘静平王永春李勇贾景明宁夏医科大学总医院银川市750004沈阳产品质量监督检验院沈阳市036沈阳药科大学沈阳市006
刘静平,王永春,李勇,贾景明(.宁夏医科大学总医院,银川市750004;.沈阳产品质量监督检验院,沈阳市 036;3.沈阳药科大学,沈阳市 006)
北虫草Cordycepsmilitaris(L.)Link又名蛹虫草,是真菌门子囊菌亚门肉座目麦角菌科虫草属的模式种[1],是我国名贵中药材之一,主要分布于吉林、辽宁、陕西、河北等地[2]。作为我国中药宝库的瑰宝,它具有提高人体免疫力、抗疲劳、抗衰老、抗肿瘤等多种医疗和保健作用。
虫草素(3′-脱氧腺苷,3′-Deoxyadenosine)亦称虫草菌素(Cordycepin),是一种核苷类抗生素。虫草素的分子式为C10H13N5O3,相对分子质量为251,熔点为230~231℃,最大吸收波长为259 nm[3]。最初虫草素是从北虫草培养物中分离得到的[4],具有显著的药理活性[5]。笔者改进了虫草素的测定方法,采用反相高效液相色谱(RP-HPLC)法测定北虫草发酵培养物中虫草素的含量,并与野生北虫草做了对比试验。
1 仪器与材料
1.1 仪器
HPLC仪,含LC-10ATvp泵、SPD-10ATvp紫外检测器(日本岛津公司);AT-330柱温箱(天津奥特赛恩斯仪器有限公司);FA2104N电子天平(上海民桥医疗器械有限公司);KH2200B超声波清洗器(昆山禾创超声仪器有限公司,频率:40 kHz,功率:80W)。
1.2 试药
水为娃哈哈纯净水,甲醇、乙腈为色谱纯;虫草素标准品(美国Sigma公司,含量≥99%)。
1.3 样品
北虫草发酵培养物(韩国东亚大学,批号:DAU-Cm-Kangwon-1);野生北虫草药材由韩国东亚大学提供,由沈阳药科大学贾景明教授鉴定为北虫草C.militaris(L.)Link,标本存放于沈阳药科大学标本馆(标本号:200608210-A)。
2 方法与结果
2.1 色谱条件
色谱柱:DIAMONSIL-C18(250mm×4.6mm,5μm);流动相:乙腈-水-甲醇(5∶90∶5);流速:0.8m L·min-1;检测波长:259 nm;柱温:40℃。在此条件下,虫草素的保留时间为14min。色谱见图1。

图1 高效液相色谱图A.虫草素标准品;B.北虫草发酵培养物;C.野生北虫草药材Fig 1 HPLC chromatogram s A.cordycepin standard;B.fermented C.militaris;C.w ild materials of C.militaris
2.2 标准品溶液的制备
精密称取虫草素标准品3.2mg,加入50%乙醇溶液定容至25m L,混匀,即得(每1m L溶液含虫草素0.128mg)。
2.3 供试品溶液的制备
精密称取北虫草发酵培养物0.2 g,溶于5m L 50%乙醇溶液中,超声提取30min,补足失重,先经滤纸粗滤,再经0.45μm微孔滤膜过滤,即得。用微量进样器精密吸取10μL滤液进样。
2.4 线性关系考察
分别吸取虫草素标准品溶液4、2、1.2、0.8、0.4、0.2m L,置10m L容量瓶中,以50%乙醇溶液定容,混匀,制得浓度分别为51.20、25.60、15.36、10.24、5.12、2.56 μg·m L-1的系列标准溶液,按上述色谱条件进样测定峰面积。以峰面积积分值(Y)对标准品浓度(X)作线性回归,得回归方程为Y=23 979X+16 085(r=0.999 8,n=6)。结果表明,虫草素检测浓度在2.56~51.20 μg·m L-1范围内与峰面积积分值呈良好线性关系。
2.5 精密度试验
取浓度为25.60μg·m L-1的虫草素标准品溶液适量,按上述色谱条件重复进样6次,测定。结果,虫草素的峰面积平均值为629 947,RSD=1.34%(n=6),表明仪器精密度良好。
2.6 重复性试验
精密称取6份北虫草发酵培养物各0.2 g,分别按“2.3”项下方法制备供试品溶液,准确吸取10μL进样,测定峰面积。结果,6份样品中虫草素的峰面积平均值为158 041,平均含量为0.148mg·g-1,RSD=1.76%(n=6),表明方法重复性良好。
2.7 稳定性试验
精密称取0.2 g北虫草发酵培养物,按“2.3”项下方法制备供试品溶液,室温下于0、2、4、6、8、10 h测定。结果,虫草素的峰面积平均值为159 213,RSD=2.7%(n=6),表明北虫草发酵培养物供试品溶液中虫草素在提取后10 h内稳定。
2.8 加样回收率试验
精密称取已知含量的样品6份,每份0.2 g,精密加入适量的虫草素标准品,按“2.3”项下方法制备供试品溶液,按上述色谱条件测定,计算样品含量和加样回收率,结果见表1。
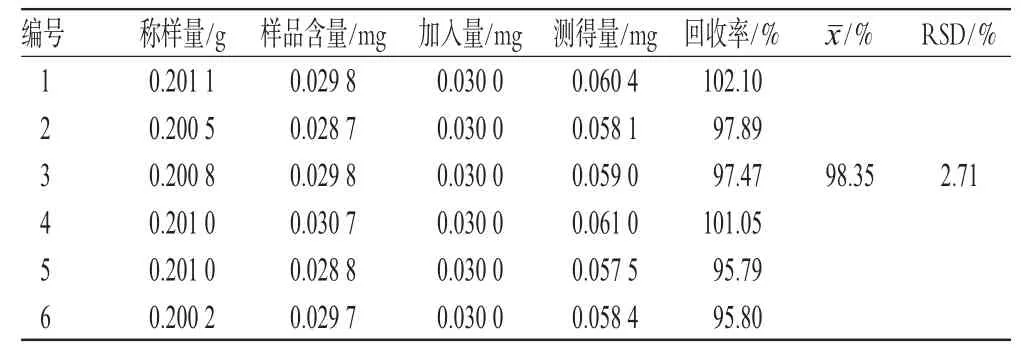
表1 加样回收率试验结果(n=6)Tab 1 Resultsof recovery tests(n=6)
2.9 野生北虫草药材与北虫草发酵培养物中虫草素的含量测定
取野生北虫草药材与北虫草发酵培养物各适量,分别按“2.3”项下方法制备供试品溶液,按上述色谱条件进行含量测定。结果,野生北虫草和北虫草发酵培养物中虫草素含量分别为0.105、0.148mg·g-1。
3 讨论
试验比较了多种流动相,最后选择乙腈-水-甲醇(5∶90∶5)作流动相,分离度尚佳,保留时间也较合适,色谱峰峰形较好,使定量分析的准确性得到提高。
从测定结果来看,北虫草发酵培养物中虫草素的含量高于野生北虫草药材,为今后寻找北虫草的替代品提供了理论依据。
北虫草发酵培养物中含有丰富的蛋白、糖类以及多种微量元素和维生素,药理作用研究显示其具有明显的镇静、耐缺氧、抗炎等作用,而且毒性很低[6],重要活性成分虫草素含量较高,加之是大规模人工培养,产量稳定,所以是很好的中药材资源,具有开发利用前景。
[1]马吴伟,潘苏华.蛹虫草研究进展[J].亚太传统医药,2008,4(11):148.
[2]施 英,吴娱明,廖森泰,等.蛹虫草药理作用研究进展[J].广东蚕业,2006,40(3):43.
[3]抗菌素生物理化特性编写组.抗菌素生物理化特性(第1分册)[M].北京:人民卫生出版社,1977:983.
[4]汪 宇,于荣敏,汪晓宁.利用虫草属药用真菌提取分离核酸类物质的研究进展[J].中国药房,2004,15(1):53.
[5]伍小燕,黄权芳.柞蚕蛹虫草提取物对模型大鼠膜性肾炎的保护作用研究[J].中国药房,2009,20(33):2 579.
[6]陈桂宝,罗梅初,刘实晶,等.蛹虫草的药理作用研究[J].中草药,1997,28(7):414.
