不同采收期青翘和连翘叶中活性成分的含量比较Δ
2011-08-07张淑蓉裴香萍王晶晶山西中医学院太原市030024
张淑蓉,裴香萍,闫 艳,王晶晶(山西中医学院,太原市 030024)
连翘为木犀科植物连翘Forsythia suspensa(Thunb.)Vahl的干燥果实,秋季果实初熟尚带绿色时采收,除去杂质,蒸熟,晒干,习称“青翘”;果实熟透时采收,晒干,除去杂质,习称“老翘”。连翘药用历史久远,但多为野生,资源有限。为便于连翘资源的综合开发利用,近年来研究人员对连翘不同部位的活性成分进行了比较研究[1~3]。在我国山西、陕西等地,将连翘叶作茶饮用已有较长历史。现代药理研究证实,连翘叶具有抗菌、保肝、抗氧化及抗衰老等作用[4~8]。本试验参考相关文献[9,10],采用高效液相色谱(HPLC)法,使用同一色谱系统同时测定不同采收期青翘和连翘叶中连翘酯苷、芦丁和连翘苷的含量,并比较青翘和连翘叶中活性成分的含量变化,以确定青翘和连翘叶的最佳采收期。
1 仪器与试药
HPLC仪,包括Waters2695二元液相色谱泵、Waters2998光电二极管阵列检测器(美国Waters公司);FA/JA1004型万分之一天平(上海精密科学仪器有限公司);KQ5200V型超声波清洗机(昆山市超声仪器有限公司)。
试验用水为双蒸水,甲醇为色谱纯,其他试剂均为分析纯;连翘苷(批号:110821-200610)、芦丁(批号:100080-200707)对照品均购自中国药品生物制品检定所(供含量测定用);连翘酯苷标准品(辽宁省生物医药研究所,纯度>98.0%);青翘和连翘叶于2008年6月-10月采自山西太原,由山西中医学院中药鉴定教研室牛燕珍讲师鉴定分别为连翘F.suspense(Thunb.)Vahl的果实和叶。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Alltima C18(250 mm×4.6 mm,5µm);流动相:甲醇(A)-水(B),梯度洗脱(0~8 min,30%~33%A;8~24 min,33%~40%A;24~39 min,40%~48%A;39~55 min,48%~64%A;55~65 min,64%~30%A;65~75 min,30%A);检测波长:280 nm;流速:0.8 mL·min-1;柱温:室温。在此色谱条件下,对照品和供试品溶液中各色谱峰的分离度良好,其他成分对连翘酯苷、芦丁和连翘苷的含量测定无干扰。色谱见图1。
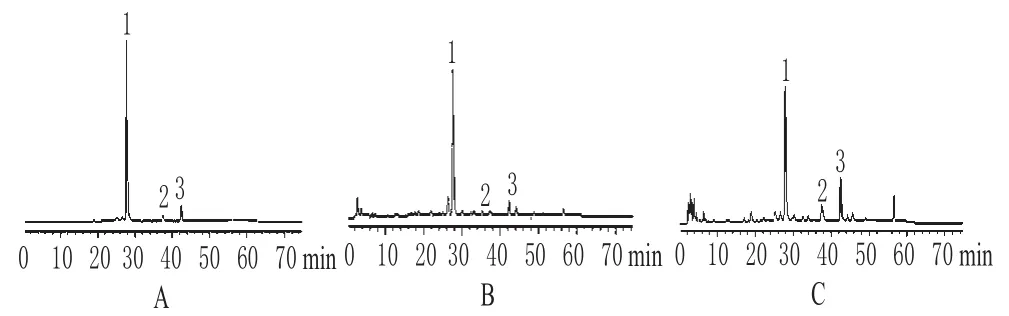
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.2 混合对照品溶液的制备
精密称取连翘酯苷标准品与芦丁、连翘苷对照品各适量,置同一5 mL量瓶中,加甲醇制成浓度分别为1.480、0.326、0.586 mg·mL-1的混合对照品溶液。
2.3 供试品溶液的制备
将不同采收期的青翘蒸制30 min、60℃烘干;连翘叶自然晾干,研细。精密称取0.5 g,置50 mL具塞三角瓶中,精密加入50%甲醇25 mL,称重,超声提取(功率:150 W,频率:40 kHz)30 min,放冷,再称重,用50%甲醇补足失重,滤过,取续滤液作为供试品溶液。
2.4 线性关系考察
精密吸取混合对照品溶液0.1、0.25、0.5、1.0、1.5、2.0 mL,分别置2 mL量瓶中,加甲醇稀释至刻度,摇匀,得系列浓度的对照品溶液。分别精密吸取10 μL注入液相色谱仪,测定峰面积积分值。以进样量(X,μg)为横坐标,峰面积积分值(Y)为纵坐标,制备标准曲线,得连翘酯苷的回归方程为Y=1 005 505.0X-4 593.6(r=0.999 9,n=6),线性范围为0.74~14.80 μg;芦丁的回归方程为Y=879 780.0X+2 959.1(r=0.999 7,n=6),线性范围为0.163~3.260 μg;连翘苷的回归方程为Y=761 687.0X+38 560.6(r=0.999 8,n=6),线性范围为0.293~5.860 μg。
2.5 精密度试验
精密吸取连翘酯苷(0.74 mg·mL-1)、芦丁(0.163 mg·mL-1)、连翘苷(0.293 mg·mL-1)混合对照品溶液 10 µL,重复进样6次,测定峰面积。结果,连翘酯苷、芦丁、连翘苷峰面积的RSD分别为1.13%、1.07%、0.91%(n=6),表明仪器精密度良好。
2.6 稳定性试验
精密吸取同一供试品溶液10 µL,于0、3、6、9、12 h分别进样测定,记录峰面积。结果,连翘酯苷、芦丁、连翘苷峰面积的RSD分别为0.99%、1.44%、1.25%(n=5),表明供试品溶液在12 h内稳定。
2.7 重复性试验
精密称取同一样品(于2008-07-31采收的连翘叶)粉末0.5 g,共6份,分别按“2.3”项下方法制备供试品溶液,照“2.1”项下色谱条件分析测定。结果,连翘酯苷、芦丁和连翘苷的平均含量分别为4.00%、0.91%、1.32%,RSD分别为1.95%、2.45%、2.42%(n=6),表明该方法重复性良好。
2.8 加样回收率试验
精密称取已知含量的同一样品(于2008-07-31采收的连翘叶)粉末0.25 g,共6份,分别精密加入连翘酯苷、芦丁、连翘苷混合对照品溶液(浓度分别为1.92、0.42、0.64 mg·mL-1)5 mL,照“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,计算加样回收率,结果见表1。
2.9 样品含量测定
取不同采收期的样品粉末,分别精密称取0.5 g,按“2.3”项下方法制备供试品溶液,照“2.1”项下色谱条件测定样品中3种成分的含量,结果见表2(表中“-”表示10月中旬已采收不到青翘)。青翘和连翘叶中测定成分随采收日期的变化趋势见图2。
3 讨论
本试验结果显示,连翘酯苷的含量青翘高于同期连翘叶,芦丁和连翘苷的含量则是连翘叶高于同期青翘。连翘叶能否代替青翘使用及两者的药效作用比较有待进一步研究。青翘中连翘酯苷、芦丁和连翘苷3种成分均是7月上旬含量最高,以后逐渐降低,故青翘以7月份采收为宜;连翘叶中连翘酯苷和连翘苷含量在6月最高,以后逐渐降低,9月下旬有所回升,之后又降低;芦丁则是7月含量最高,之后变化趋势同连翘酯苷和连翘苷,因此连翘叶以6~7月采收为宜。6~7月份叶子处于生长旺盛时期,此正符合叶类药材的一般采收规律。为避免较早采收叶子可能对果实造成的不利影响,建议在采收连翘果之后再采收连翘叶;另外,亦可以在9月下旬活性成分回升时采收连翘叶,以充分利用资源。
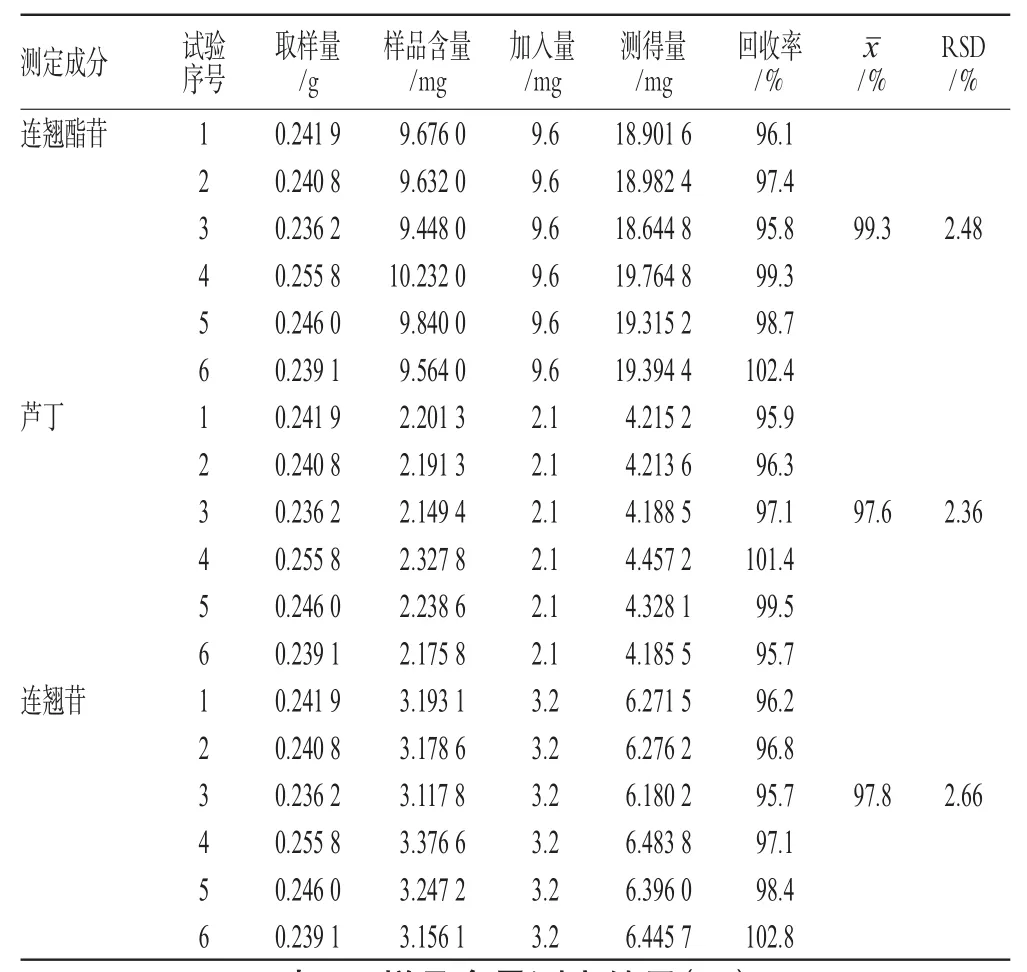
表1 加样回收率试验结果(n=6)Tab 1Results of recovery tests(n=6)
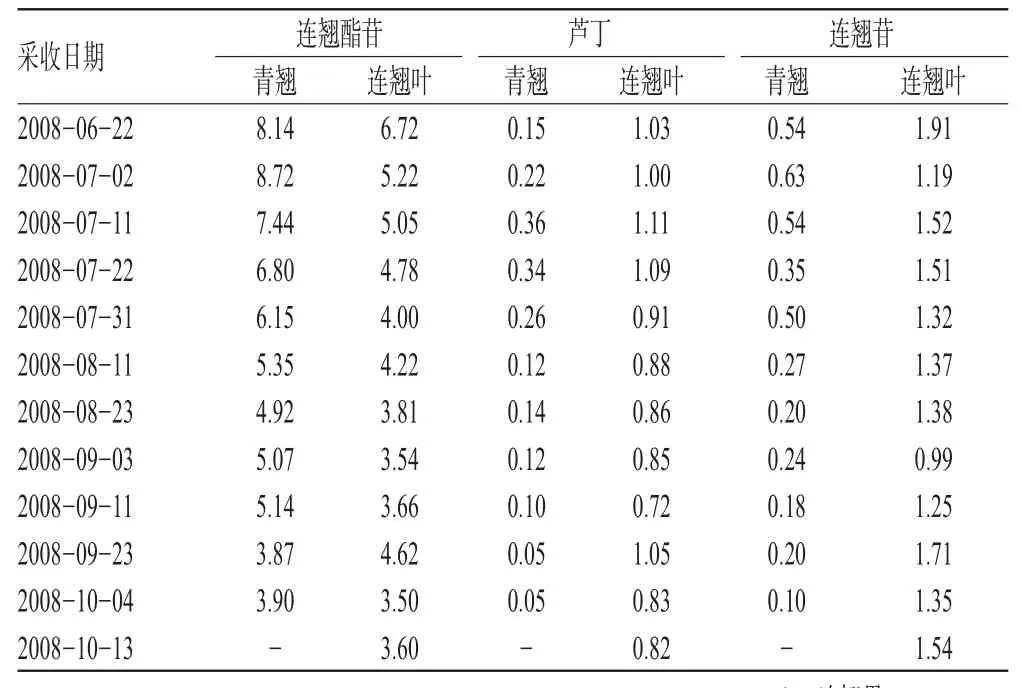
表2 样品含量测定结果(%)Tab 2Results of content determination of samples(%)
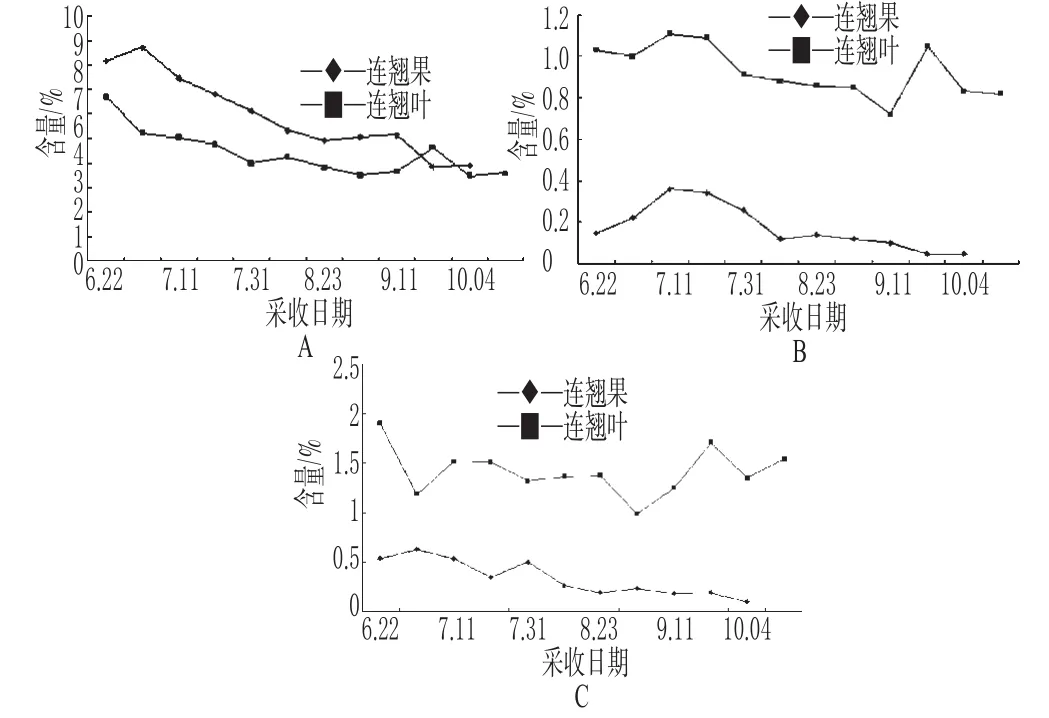
图2 青翘和连翘叶中测定成分随采收日期的变化图Fig 2 Tendency chart of determination composition in fruit and folium of F.suspensa with harvesting time
目前有关连翘的制剂多以连翘苷作为质控指标;而研究表明连翘酯苷是连翘具有抗病毒、抗氧化作用的重要活性组分之一[11],且是连翘活性成分中含量最高的;芦丁具有抗氧化、降低毛细血管脆性与通透性等多种活性[12]。因此,选择上述3种物质作为指标成分,可以较为全面地反映连翘质量。
本试验参考相关文献[9,10],建立了同一色谱系统同时测定连翘中连翘酯苷、芦丁和连翘苷含量的HPLC法,该方法简便、快速、准确,可为确定连翘果和叶的合适采收期提供理论依据,同时为扩大连翘叶资源的开发和临床应用提供有意义的参考。
[1] 周改莲,辛 宁,张守平,等.连翘不同部位及不同炮制方法的活性成分比较[J].中国中医药信息杂志,2008,15(增刊):30.
[2] 曲欢欢,翟西峰,李白雪,等.连翘不同部位中连翘酯苷和连翘苷的含量分析[J].药物分析杂志,2008,28(3):382.
[3] 李发荣,段 飞,杨建雄.中药连翘及连翘叶中连翘苷含量的比较研究[J].西北植物学报,2004,24(4):725.
[4] 薛愧玲,袁王俊.连翘叶的药理研究综述[J].时珍国医国药,2009,20(5):1 149.
[5] 杨建雄,刘 静,李发荣,等.连翘叶茶抗氧化抗衰老作用的实验研究[J].营养学报,2004,26(1):65.
[6] 段 飞,张双民,杨建雄,等.连翘叶提取物抑菌作用的研究[J].西北药学杂志,2005,20(2):66.
[7] 黄亚亚,杨建雄,赵咏梅.连翘叶黄酮对力竭游泳恢复小鼠的抗疲劳作用研究[J].天然产物研究与开发,2009,21(6):1 019.
[8] 孟祥乐,李俊平,李 丹,等.连翘的化学成分及其药理活性研究进展[J].中国药房,2010,21(43):4 117.
[9] 杨建雄,柴渭莉,邱 娟.连翘叶中苷类成分的分离与HPLC鉴定[J].中成药,2007,29(7):1 086.
[10] 张 杲,李发荣,段 飞,等.不同采收期连翘叶中连翘苷、连翘酯苷和芦丁的含量测定[J].天然产物研究与开发,2005,17(6):790.
[11] 张 炜,张汉明,郭美丽.连翘的药理学研究[J].中国现代应用药学杂志,2000,17(1):7.
[12] 韩英华,秦元璋.芦丁研究现状[J].山东中医杂志,2003,22(10):635.
