美托洛尔对缺血糖尿病大鼠心肌的电生理作用
2011-08-06金红峰曾文平沈法荣王志军孙国建陈建明
金红峰,曾文平,沈法荣,王志军,何 浪,孙国建,陈建明,钟 诚
(浙江医院,浙江杭州310013)
糖尿病是冠心病的等危症,是心血管疾病发病和死亡的主要危险因素之一。对糖尿病的的研究主要集中在糖尿病引起的血管病变的问题上,比如冠心病,糖尿病外周血管病变以及糖尿病肾病等。不过,糖尿病的的所有严重并发症中易被忽视的是心血管自主神经病变,且其带给患者的危害不容忽视[1]。心肌梗死后存在交感神经重构现象,表现为交感神经的再生及过度再生,交感神经过度再生是心肌梗死后室性心律失常及心脏性猝死的重要促发因素[2]。交感神经重构与心肌梗死后室性心律失常关系研究较多,而与糖尿病自主神经病变后室性心律失常研究却很少。
室性心律失常作为心脏性猝死主要原因是心律学的研究热点,但限于经济等多种因素,药物治疗仍然是室性心律失常的主要治疗手段。β受体阻滞剂能够降低心肌梗死室性心律失常及心脏性猝死发生,是唯一被证实能够降低心脏性猝死的药物[3],不过,对于β受体阻滞剂对糖尿病的室性心律失常的影响以及其中的机制有待进一步地研究。因此,本研究通过建立糖尿病大鼠模型,测定血浆神经生长因子的表达来评价糖尿病心肌交感神经的重构情况,并通过给予β受体阻断剂来抑制交感神经活性,测定心肌的电生理变化,了解糖尿病以及阻断交感神经的活性的情况下,心肌细胞的电生理改变,从而研究糖尿病后发生室性心律失常的可能机制。
1 材料与方法
1.1 实验动物以及实验试剂 雄性Sprague-Dawley(SD)大鼠 40 只,180g~220 g/只,由浙江大学实验动物中心提供。链脲佐菌素(Streptozotocin,STZ,1 g/瓶),购自 Sigma 公司,USA;美托洛尔(Metoprolol,25 mg/片,阿斯利康公司);神经生长因子(Nerve growth factor,NGF)ELISA试剂盒购自上海舜田生物科技有限公司;实验中其他试剂均为市售分析纯。RM6240多道生理信号采集处理系统,YC-2型程控刺激器,HSS-1(B)恒温浴槽,Langendorff灌流装置,以上仪器均为成都仪器厂生产。改良Krebs-Henseleit溶液(K-H液)成分如下(mmol/L):NaCl 118.0,KCl 4.7,K2PO41.2,MgSO41.2,NaHCO325.0,CaCl21.25,葡萄糖10.0,pH 7.4,以 95%O2+5%CO2饱和。
1.2 实验分组 实验分为:糖尿病组、糖尿病+左交感神经切除组、糖尿病+美托洛尔组,每组10只大鼠,并用正常大鼠作对照组。对照组为腹腔注射STZ等比例体重的生理盐水;糖尿病组为根据以上方法建立的糖尿病模型,模型成功建立后30 d行电生理检测;糖尿病+左交感神经切除组为糖尿病模型建立前,先行麻醉下行左侧交感神经切除术,模型完成后30 d行心脏电生理检测;糖尿病+美托洛尔组为制作糖尿病模型后,美托洛尔以每天5 mg/kg灌胃,共30 d,行电生理检测。
1.3 动物模型制备
1.3.1 制备去交感神经大鼠模型 随机取10只雄性SD大鼠作为去交感神经组,按照0.4 mg/kg剂量用水合氯醛腹腔注射麻醉,将其固定在鼠手术台上,沿颈部前正中线作0.5 cm左右纵行切口,暴露气管,逐层分离左侧颈部气管旁组织,暴露左侧颈总动脉后继续分离直至暴露左侧迷走神经,分离迷走神经结缔组织被膜,可见一透明或半透明的细小的与迷走神经伴行的神经组织即为交感神经,游离交感神经并用显微剪剪断后,按解剖结构逐层关闭切口,大鼠麻醉清醒后送回动物室继续饲养。术后观察:Horner征:大鼠左侧眼裂变小、眼球内陷、瞳孔缩小且对光反射消失可视为交感神经切除成功。
1.3.2 糖尿病大鼠模型制备 SD大鼠禁食12 h,称取 STZ,在暗室下,将 STZ用0.1 mol/L,pH 4.2~4.5的柠檬酸缓冲液以1%浓度溶解新鲜配置,按60 mg/kg空腹体重于腹腔注射,对照组大鼠用等体积缓冲液腹腔注射。再给予5%葡萄糖溶液进水,48 h后换以自来水饮用。并给予高热量饲料(普通饲料+20%蔗糖,由浙江大学实验动物中心制备)饲养12周,即可制备2型糖尿病动物模型。动物模型的观察的一般指标:大鼠出现多饮,多食,多尿。大鼠腹腔注射STZ 8周后,断尾取血,用快速血糖仪测定全血血糖,血糖>16.7 mmol/L可认为糖尿病造模成功。
1.4 整体心脏的电生理研究 取各组大鼠,用木锤击昏后,迅速取出心脏,置于4℃改良K-H液中除去血液;然后迅速转移、固定于Langendorff灌流装置,以 K-H液行常规恒压灌流。
电生理研究:起搏电极一对,垂直放置于右室游离壁,起搏脉冲宽度2ms,频率50Hz,2倍舒张阈强度。记录电极一对,水平放置在左、右室壁中部,心电图由生理记录仪动态记录。致颤电极一对,垂直放置于左心室壁上,致颤脉冲波宽2ms、周期4ms、串长40ms。根据测得的有效不应期数值,通过预置延迟时间使之落在心肌的易颤期。具体测量以下指标:
心室舒张期兴奋阈(DET):用额外刺激法,S1∶S2为 8∶1,采用起搏方波(S1)刺激心脏,经8个 S1后,在舒张后期施加一个额外刺激(S2),S2每次递增0.04 mA,以刚能引起心室兴奋的最小电流强度作为DET。
心室有效不应期(ERP):用额外刺激法,以2倍DET强度的S2,在舒张后期逐步前移(步长2 ms),直至S2不能引起心室兴奋,此时的S1和S2的最长间期即为ERP。
心室颤动阈(VFT):用串刺激法测定,起始电流0.4 mA,每25个心动周期输出一次并自动递增0.2 mA,以能引起室颤的最小电流强度作为VFT。
1.5 测定血清神经生长因子 血清NGF浓度采用酶联免疫吸附法(Enzyme-Linked Immunosorbent Assay,ELISA)测定:取各组大鼠,用木锤击昏后,分离大鼠右侧的腹股沟,暴露右侧股动脉及股静脉,抽取股静脉血,静置30 min后,离心取上层血清,置于-20℃下备用。通过ELISA法测定,采用NGF Emax免疫分析系统,特异地检测NGF,所有的检测在96孔板上进行,采用抗体夹心法检测特异蛋白。使用辣根过氧化物酶标记的二抗及单组分TMB溶液,用酶标仪在492 nm波长处测量每一孔的光密度,NGF含量通过标准曲线来量化。所有步骤均严格按照试剂盒说明书操作进行。
1.6 统计学方法 本实验用PRISM 5.0统计,数据以平均数 ±标准差表示,采用 one-way ANOVA及Independent samples T test法进行统计,以P<0.05认为差异有统计学意义,P<0.01为差异有统计学显著性意义。
2 结果
2.1 缺血前后DET的变化 缺血前糖尿病组的DET(0.170±0.018)mA和美托洛尔组的DET(0.175±0.016)mA与缺血前对照组的DET(0.115±0.017)mA比较明显升高,差异有统计学意义(P<0.05)。缺血后糖尿病组的DET(0.120±0.013)mA和对照组的DET(0.095±0.005)mA比较明显升高,差异有统计学意义(P <0.005);与糖尿病组缺血后的DET(0.120±0.013)mA比较,美托洛尔组缺血后的DET(0.176±0.034)mA明显升高,差异有统计学意义(P <0.05)。见图1。
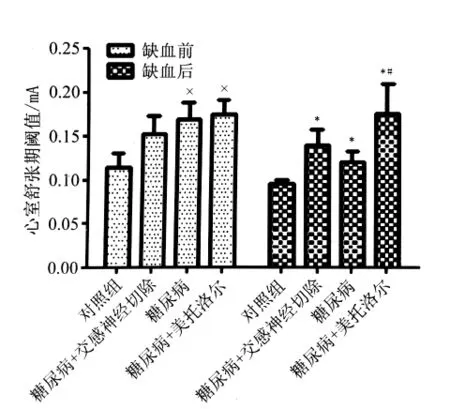
图1 缺血前后心室舒张期阈值Fig.1 Ventrticular diastolic effective thre-shold before and after ischemia

2.2 缺血前后ERP的变化 缺血前各个组之间的ERP结果没有显著性差异。缺血后糖尿病组的ERP(62.75±3.29)ms及糖尿病+美托洛尔组的ERP(65.33±4.73)ms与对照组的ERP(49.00±4.02)ms比较明显升高,差异具有统计学意义(P<0.05)。见图2。
2.3 缺血前后VFT变化 缺血前糖尿病组的VFT(3.00±0.31)mA和糖尿病+美托洛尔组的VFT(2.96±0.30)mA与对照组(2.08±0.21)mA比明显升高,差异有显著性(P<0.05);糖尿病+交感神经切除组的VFT(4.87±0.88)mA与对照组比较显著升高,有显著性差异(P<0.01);糖尿病组及糖尿病+美托洛尔组VFT值与糖尿病+交感神经切除组比较明显降低,差异有显著性(P<0.05)。见图3。

缺血后糖尿病组的VFT(3.63±0.57)mA与对照组的VFT(2.13±0.35)mA比较明显升高,具有统计学意义(P<0.05);糖尿病+交感神经切除组的VFT(4.67±0.71)mA和糖尿病+美托洛尔组(4.44±0.48)mA与对照组间比较,差异具有显著统计学意义(P<0.01);糖尿病+交感神经切除组的VFT及糖尿病+美托洛尔组VFT比糖尿病组升高,差异有显著性(P<0.05)。缺血后糖尿病+美托洛尔组的VFT(4.44±0.48)mA与缺血前的VFT(2.96±0.30)mA比较明显升高,差异具有显著性(P<0.05)。见图3。
2.4 血清NGF浓度测定结果 糖尿病+交感神经切除组的NGF浓度(20.84±1.56)pg/ml与对照组间(19.88±1.14)pg/ml没有显著性差异,糖尿病组NGF浓度(27.83±1.12)pg/ml与对照组比较明显升高,差异有显著性意义(P<0.01),糖尿病 +美托洛尔组 NGF浓度(23.87±0.76)pg/ml与对照组比升高,有显著性差异(P<0.05)。糖尿病组与糖尿病+美托洛尔组的NGF浓度对比,差异有显著性意义(P<0.01)。糖尿病组与糖尿病+交感神经切除组间NGF浓度对比,差异有显著性意义(P<0.01),糖尿病+交感神经切除组与糖尿病+美托洛尔组间的NGF浓度差异没有统计学意义(图4)。

图4 血清NGF浓度测定结果比较Fig.4 Concentration of NGF in serum
3 讨论
室性心动过速及心室颤动是心肌梗死后的猝死的主要原因,心肌缺血后存在交感神经过度再生,重新分布,也即交感神经重构现象[4]。β受体阻滞剂能够改善交感神经重构,预防、降低心肌梗死后恶性心律失常甚至猝死的发生。80%糖尿病患者死于心血管疾病,相当一部分是由于室性心律失常所导致的猝死。提示交感神经在糖尿病室性心律失常发生上可能起了重要的作用。
研究发现,糖尿病大鼠自主神经病变发生早于心脏功能异常[5],早期交感神经适度再生是机体合理的损伤修复反应,有利于维持血流动力学的稳定,保持左心室的结构和功能。神经生长因子能够促进神经细胞存活、生长、分化,具有引起神经元形态学差异、加速神经再生的特性[6]。其释放与表达增加是交感神经重构的主要机制。
交感神经的过度支配、新生交感神经空间支配不均一性共同参与了心律失常的发生。交感神经的过度支配,引起心肌β受体表达上调等,显著改变心肌细胞的电生理特性:自律性、不应期、传导速度;而新生神经空间支配的不均一性加剧心肌细胞电生理特性的空间异质性,影响复极过程,易化心律失常的发生[7-9]。
本研究结果提示,糖尿病组及糖尿病+美托洛尔组大鼠其NGF浓度明显高于对照组,而糖尿病+交感神经切除组大鼠,其NGF浓度与对照组间差异没有显著性,推测可能是由于交感神经支配的离断,神经受损所致。NGF在交感神经重构的过程中可能起到重要的作用。和单纯糖尿病组比较,美托洛尔组可以降低NGF的浓度,具有统计学差异,同时美托洛尔组与交感神经切除组比较,NGF浓度之间没有差别。这在另外一个方面证实交感神经在糖尿病大鼠上有过度的增生,也证实了美托洛尔的交感阻断作用。
本研究提示,对于高血糖的糖尿病组大鼠,其DET在缺血前均较对照组为高,提示长期的高血糖可以提高心室肌细胞的兴奋阈值,降低心肌的兴奋性,美托洛尔可以提高糖尿病大鼠心肌缺血后的DET,提示美托洛尔可以提高缺血后的心肌的兴奋阈值,降低其兴奋性,降低室性心律失常的发生。
本研究还提示,交感神经切除组可以明显提高糖尿病大鼠的 VFT,交感神经切除组的VFT也比美托洛尔组的VFT要高,差异都具有统计学意义。这就提示交感神经在糖尿病大鼠中的室性心律失常上具有一定的作用。同时研究也发现,缺血后美托洛尔组的VFT比糖尿病大鼠的VFT明显升高,提示β受体阻滞剂对预防心源性猝死具有一定的作用。不过心肌缺血前,美托洛尔组的VFT和糖尿病组的VFT比较并没有差异。
美托洛尔可以提高缺血后的大鼠心肌的DET,降低缺血后心肌的兴奋性,缺血后美托洛尔组的VFT比糖尿病大鼠的VFT明显升高,提示美托洛尔可能主要对缺血后的室性心律失常起到重要的预防作用。也提示交感神经的重构在室性心律失常的发生,特别是对缺血后的糖尿病大鼠的室性心律失常发生起到重要的作用。其机制可能与其抑制交感神经的重构有关。今后,有待作进一步研究,以明确交感神经重构的具体改变,了解其在室性心律失常中起到的作用。
[1]VINIK A I,ZIEGLER D.Diabetic cardiovascular autonomic neuropathy [J].Circulation,2007,115(3):387-397.
[2]CHYEN P S,CHEN L S,CAO J M,et al.Sympathetic nerve sprouting,electrical remodeling and the mechanisms of sudden cardiac death[J].Cardiovasc Res,2001,50(2):409-416.
[3]ELLISON K E,HAFLEY G E,HICKEY K,et al.Effect of beta-blocking therapy on outcome in the Multicenter UnSustained Tachycardia Trial(MUSTT)[J].Circulation,2002,106(21):2694-2699.
[4]XI Yang,QU Xiu-fen,YU Yan-wei et al(喜 杨,曲秀芬,于彦伟,等).Thephenomenaof sympathetic nerve remodeling in myocardial infarction [J].Chinese JournalofCardiac Arrhythmias(中华心律失常学杂志),2004,8(3):177-180.(in Chinese)
[5]LIN Y D,HSU K L,WU E T,et al.Autonomic neuropathy precedes cardiovascular dysfunction in rats with diabetes[J].Eur J Clin Invest,2008,38(9):607-614.
[6]CAO J M,CHEN L S,KENKNIGHT B H,et al.Nerve sprouting and sudden cardiac death [J].Circ Res,2000,86(7):816-821.
[7]ZHOU S,PAZ O,CAO J M,et al.Differential betaadrenoceptor expression induced by nerve growth factor infusion into the canine right and left stellate ganglia[J].Heart Rhythm,2005,2(12):1347-1355.
[8]CHANG C M,WU T J,ZHOU S,et al.Nerve sprouting and sympathetic hyperinnervation in a canine model of atrial fibrillation produced by prolonged right atrial pacing [J].Circulation,2001,103(1):22-25.
[9]OGAWA M,ZHOU S,TAN A Y,et al.What have we learned about the contribution of autonomic nervous system to human arrhythmia?[J]Heart Rhythm,2009,6(8 Suppl):S8-11.
