脑胶质瘤细胞SHG44与U87-MG辐射敏感性差异及其机制初步研究
2011-08-04孙志强
孙志强
(常州市第二人民医院放疗科,江苏 常州 213000)
脑胶质瘤属胶质细胞源性的良、恶性中枢神经系统肿瘤,其中恶性胶质母细胞瘤是成人原发性脑肿瘤中最普遍的亚型[1],因为大多数胶质瘤呈浸润性生长且与周围脑组织边界不清,所以治疗十分困难。放射治疗是最有效的辅助治疗,但胶质瘤为中等放射敏感度,如何增加肿瘤组织的辐射敏感性,减轻正常组织损伤,以提高治疗效果,是我们的目的所在。环氧化酶2(Cyclooxygenase,COX-2)在许多恶性肿瘤中呈高表达,与局部浸润、远处转移及预后等关系密切[2]。许多研究发现COX-2抑制剂在体外和动物实验中均有抗肿瘤与放射增敏作用,但其具体作用机制目前尚不清楚[3-5]。本实验通过克隆法、反转录聚合酶链反应(Reverse transcriptase PCR,RT-PCR)法检测60Co-γ射线照射两种胶质瘤细胞SHG44与U87-MG克隆存活率及COX-2 mRNA表达水平的关系,探讨胶质瘤细胞辐射敏感性差异的可能机制,为寻求增强放射敏感性药物提供理论支持。
1 材料与方法
1.1 材料
脑胶质瘤细胞SHG44及细胞U87-MG,由苏州大学肿瘤放射生物研究室提供;RPMI 1640培养基(Gibco);胎牛血清购(四季青);RNeasy Mini Kit,QIAshredder Homogenizers(QIAGEN);Rtase M-MLV/RTase Hˉ,Random primers(Takara);COX-2引物、18S rRNA引物(生工)。
1.2 方法
1.2.1 辐照条件
60Co-γ射线(剂量率1Gy/min,源距2.8m)辐照。
1.2.2 克隆法检测细胞存活率
以对数生长期细胞制备单细胞悬液,接种24h后细胞贴壁,给予不同剂量60Co-γ射线照射,照射后胰酶消化制备单细胞悬液,以500个细胞/皿接种至60mm培养皿,培养11~12d后甲醇固定、Gimsa染色后,显微镜下计数50个细胞以上的细胞集落。每组每个剂量点设三个平行样。计算各种实验条件下的克隆形成率。应用Graphpad prism 5 Demo 软件,以单击多靶模型S= 1 - (1 - e - D/ Do) N,拟合细胞存活曲线,测定、计算Do、Dq和SF2等多个放射生物学参数。独立性实验重复3次。
1.2.3 RT-PCR法测定COX-2 mRNA的表达水平
对数生长期的SHG44细胞和U87-MG接种24h后,胰蛋白酶消化,收集细胞。RNeasy Mini Kit提取细胞总mRNA。总RNA先逆转录反应合成第一链。取1μL逆转录反应产物进行PCR扩增,COX-2上游引物为5’-TGAAACCCACTCCAAACACA-3’,下游引物 3’-AACTGATGC GTGAAGTGCTG-5’,18S rRN下游引物5’-GTAACCCGTTGAACCC CATT-3’,下游引物3’-CCATCCAATCGGTAGTAGCG-5’。反应条件:94℃预变性3min,94℃变性30s,57℃退火30s,72℃延伸30s,扩增25个循环PCR产物经3%琼脂糖凝胶水平电泳分离,并与DNA分子量Marker进行比较,Bandscan5.0图像分析软件行半定量分析。
1.3 统计学处理
2 结 果
2.1 克隆法测定60Co-γ线照射对SHG44和U87-MG细胞存活率的影响
随着照射剂量的增加,细胞渐失去分裂增生的能力,在10 Gy组仅有极少数细胞能形成克隆。图1不同照射剂量下SHG44和U87-MG细胞的存活曲线;两种细胞的存活分数随着照射剂量的增高而下降,属于单击多靶模型。
表1为采用单击多靶模型拟合后获得的多个放射生物学参数:平均致死剂量D0,细胞受损所需准阈剂量Dq,2Gy时细胞存活分数SF2。
由表1可见,U87-MG细胞的D0、Dq、SF2值均较SHG44细胞的值小,其差异具有统计学意义(P<0.05)。
2.2 RT-PCR测定SHG44、U87-MG细胞COX-2 mRNA表达水平,见图2和表2。
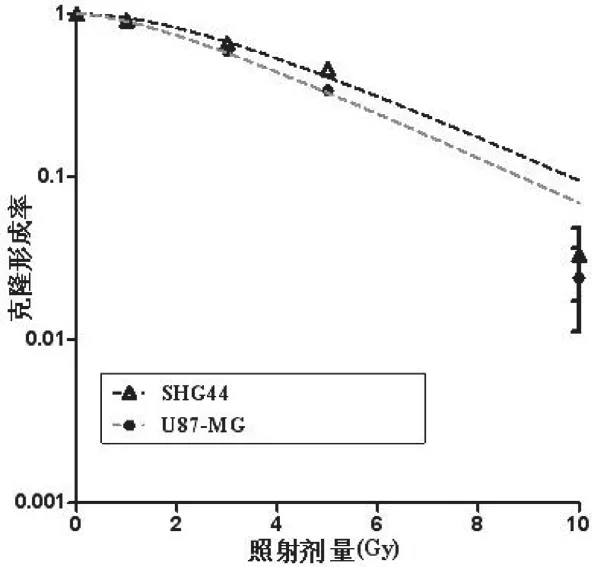
图1 60Co-γ线照射后SHG44和U87-MG细胞克隆形成率
表1 SHG44和U87-MG细胞放射增敏参数(±s,n=3)
与SHG44细胞相比,*P<0.05
细胞组别 D0 Dq SF2 SHG44 3.18±0.21 2.63±0.11 0.83±0.03 U87-MG 3.07±0.17* 1.86±0.09* 0.74±0.02*
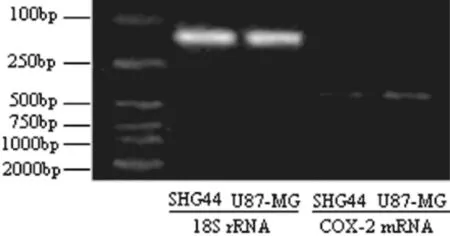
图2 SHG44和U87-MG细胞COX-2 mRNA与18S rRNA表达
图2示,SHG44和U87-MG细胞组COX-2 mRNA与18S rRNA泳道上可见一大小与引物设计理论值相符的特异性扩增条带。以18S rRNA灰度定为1,COX-2 mRNA 相对表达量=COX-2 cDNA/18S rRNA cDNA。

表2 SHG44细胞COX-2 mRNA相对表达水平
表2中,U87-MG细胞COX-2 mRNA相对表达水平较SHG44细胞高,其差异具有显著性 (P<0.01)。
3 讨 论
环氧化酶(cyclooxygenase,COX)是参与花生四烯酸转化为各种内源性前列腺素(PGs)过程中重要的限速酶,参与机体的多种病理生理过程。其中COX-2是一种诱导型酶。近年来研究显示,COX-2在一些肿瘤中存在过度表达现象,提示COX-2可能与肿瘤的发生、发展密切相关[6]。国外相关研究表明放疗中射线是刺激COX-2表达的一种因素,能增强细胞内COX-2的表达水平,并随具有剂量效应[7]。
从细胞存活曲线图发现,两种胶质瘤细胞的存活分数随辐射剂量的增高呈指数性降低,细胞的剂量-存活曲线符合单击多靶模型。放射生物学参数中,D0是存活率下降63%所需剂量,D0越小,放射敏感性越强;Dq代表细胞累积亚致死性损伤的能力,Dq减小,放射敏感性增强;SF2是代表细胞放射敏感性的重要指标,SF2越大,放射抗拒性越强。U87-MG细胞的D0、Dq、SF2值均小于SHG44细胞,其差异具有显著性(P<0.05),表明U87-MG细胞的辐射敏感性大于SHG44细胞。本实验中,检测了两种胶质瘤细胞SHG44与U87-MG 的COX-2 mRNA表达水平,发现U87-MG细胞的COX-2 mRNA相对表达水平高于SHG44细胞,其差异具有显著性(P<0.01)。Pyo H等[8]用COX-2选择性抑制剂NS-398处理人NCI-H460肺癌移植瘤裸鼠时发现,NS-398的辐射增敏作用与细胞表达COX-2的能力相关。NS-398联合辐射可显著抑制高表达COX-2的NCI-H460肺癌移植瘤的生长。Amirghahari[9]等认为COX-2选择性抑制剂通过COX-2蛋白依赖机制增强细胞的辐射敏感性。由此我们推测胶质瘤细胞的辐射敏感性与其COX-2 mRNA表达水平密切相关,这些实验结果为放疗过程中应用靶向调节COX-2 水平的药物提供重要的参考。
[1]Legler JM,Gloeckler Ries LA,Smith MA,et al.Brain and other central nervous system cancers:recent trends in incidence and mortality[J].Natl Cancer Inst,1999,91(16):1382-1390.
[2]Patrignani P,Tacconelli S,Sciulli M G,et al.New insights into COX-2 biology and inhibition[J].Brain Res Brain Res Rev,2005,48(2): 352-359.
[3]Thomas W,Janet M,Mark D,et al.Synergy between Celecoxib and Radiotherapy Results from Inhibition of Cyclooxygenase-2-Derived Prostaglandin E2, a Survival Factor for Tumor and Associated Vasculature[J].Cancer Res,2004,64(1): 279-285.
[4]Nakata E,Mason K A,Hunter N,et al.Potentiation of tumor response to radiation or chemoradiation by selective cyclooxygenase-2 enzyme inhibitors[J].Int J Radiat Oncol Biol Phys,2004,58(2): 369-375.
[5]Uma Raju,Hisanori Ariga,Klaus Dittmann,et al.Inhibition of DNA repair as a mechaniem of enhanced radioresponse of head and neck carcinoma cells by a selective cyclooxygenase-2 inhibitor,celecoxib[J].Int J Radiat Oncol Biol Phys,2005,63(2): 520-528.
[6]Williams CS,MannM,DuBois RN.The role of cyclooxygenases in inf l ammation,cancer,and development[J].Oncogene,1999,18(55):7908-7916.
[7]Tang C,Liu C,Zhou X,et al.Enhanced inhibitive effects of combination of rofecoxib and octreotide on the growth of human gastric cancer[J].Int J Cancer,2004,112(3):470-474.
[8]Pyo H,Choy H,Amorino GP,et al.A Selective Cyclooxygenase-2 Inhibitor,NS-398,Enhances the Effect of Radiation in Vitro and in Vivo Preferentially on the Cells That Express Cyclooxygenase-2[J].Clin Cancer Res,2001,7(10):2998-3005.
[9]Amirghahari N,Harrison L,Smith M,et al.NS398 radiosensitizes an HNSCC cell line by possibly inhibiting radiation-induced expression of COX-2[J].Int J Radiat Oncol Biol Phys,2003,57(5):1405–1412.
