MDM2-p53通路在肺腺癌中的表达及其调控机制
2011-08-02戴文鑫雷怀定吴智勇冯光球
戴文鑫 雷怀定 吴智勇 郑 茵 陈 娟 冯光球
(海南省人民医院留医部省医疗保健中心四区,海南 海口 570311)
p53介导的细胞信号转导途径与细胞内其他信号转导通路间存在着错综复杂的相互关系,不能独立的衡量p53的生物学功能〔1〕,而应将各个与之相关的基因综合起来研究其体系,信号转导途径中任何一个环节的障碍都将影响其功能,导致细胞周期失控、基因不稳定、甚至肿瘤发生。双微粒体2(murine double inute 2,MDM2)是一种进化上保守的癌基因,MDM2是目前研究比较广泛的癌基因之一,在多种肿瘤中可以检出,在功能上与p53基因密切相关。研究肺癌不同类型组织中MDM2蛋白增高表达率腺癌最高。2003年3月至2005年10月,本研究针对肺腺癌患者,通过癌组织中MDM2、p53表达的检测,进行MDM2-p53通路的表达及其意义的探讨。
1 资料与方法
1.1 标本 41例肺腺癌标本均取自湖北十堰太和医院呼吸内科2003~2005年支气管镜下活检组织。41例病例中,男24例,女17例,年龄23~71岁,均为首次确诊病例,确诊前未行化疗、放疗和其他生物免疫治疗;TNM分期,Ⅰ期5例,Ⅱ期11例,Ⅲ期12例,Ⅳ期13例。所有标本均经10%甲醛溶液浸泡固定,常规石蜡包埋保存。
1.2 试剂 一抗分别为1∶100稀释的鼠抗人PCNA单克隆抗体、鼠抗人MDM2单克隆抗体、鼠抗人p53单克隆抗体(均为Santa Cruz Biotechnology,Inc产品)。用PBS代替一抗做阴性对照;10%封闭用正常山羊血清、生物素化二抗工作液、抗辣根过氧化物酶标记的链霉素卵蛋白素及DAB显色试剂盒均购自Dako公司。原位细胞凋亡检测试剂盒(POD)为美国罗氏公司原装试剂盒,购自天津津脉基因测绘技术有限公司。
1.3 方法 按免疫组化SP法进行。已知阳性片做阳性对照,PBS代替一抗做阴性对照。细胞凋亡检测采用TUNEL法。
1.4 结果判定 PCNA的阳性着色部位在胞核,PCNA染色以细胞核出现棕黄染色颗粒为阳性细胞。光镜下取10个细胞密集的高倍镜视野(400×),计数1 000个肿瘤细胞中阳性细胞的百分率即增殖指数(LI)。凋亡细胞表现为细胞核中有棕黄色颗粒,同时伴有细胞缩小变圆、核致密、新月体和凋亡小体出现等改变。光镜下随机观察10个高倍镜,计数1 000~2 000个肿瘤细胞,计算凋亡细胞占全部肿瘤细胞的比例即为凋亡标记指数(ALI),以百分率表达。
1.5 统计学分析 应用SPSS13.0统计软件进行处理。计量资料计数用表示,计量资料比较用χ2检验。相关性分析采用直线相关回归。
2 结果
2.1 MDM2在肺腺癌不同临床分期中的表达 MDM2在肺腺癌表达阳性率为31.71%(13/41)。其中,Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期肺腺癌阳性表达率分别为 46.15%、30.00%、28.57%、25.00%,各组间比较差异显著(P<0.05)。
2.2 p53在肺癌不同临床分期的表达 p53在肺腺癌中表达阳性率为53.65%(22/41)。其中,Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期肺腺癌阳性表达率分别为20.00%、45.45%、54.55%、71.42%,各组间比较差异显著(P<0.05)。
2.3 p53和MDM2的关系 在对41例患者MDM2和p53的染色结果对比后发现,两种染色均为阳性者7例,均为阴性者13例。结果见表1。进一步研究将p53染色阳性的切片分成高表达组和低表达组进行分析,结果发现p53高表达组肺腺癌细胞的MDM2为9.58% ±2.16%,低表达组肺腺癌细胞的MDM2为22.81% ±5.78%,两组差异显著(P<0.05)。p53和MDM2的表达之间存在相关性(P<0.05)。
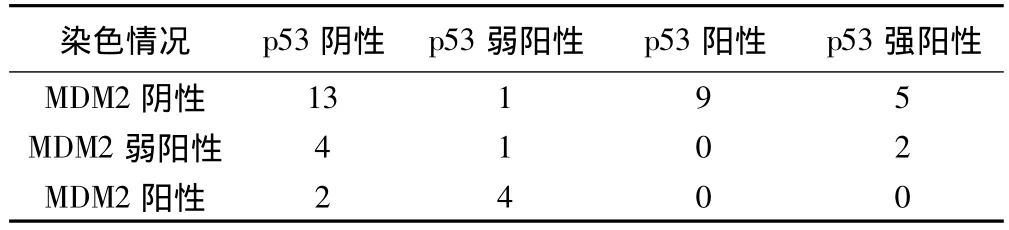
表1 各标本p53基因表达与MDM2基因表达例数(n)
2.4 p53、MDM2表达与肿瘤原发灶大小之间的关系 原发灶≥3.0 cm者,p53表达为33.43% ±7.28%,<3.0 cm者p53为6.61% ±1.34%,二者间统计学有显著差异(P<0.01)。原发灶≥3.0 cm者,MDM2为 3.77% ±1.13%,<3.0 cm者MDM2为24.53% ±4.13%,二者差异显著(P<0.05)。
2.5 p53、MDM2表达量高低与肺腺癌细胞增殖、凋亡之间的关系 p53高表达组肺腺癌细胞的PCNA LI为33.13%±4.65%,低表达组肺腺癌细胞的PCNA LI为16.48% ±5.21%,两组存在统计学差异(P<0.05);p53高表达组肺腺癌细胞的ALI为 1.34% ±0.12%,低表达组肺腺癌细胞的 ALI为1.36% ±0.09%,两组比较无统计学差异(P>0.05)。MDM2高表达组肺腺癌细胞的PCNALI为23.32% ±0.54%,低表达组肺腺癌细胞的PCNALI为22.99% ±0.07%,两组比较无统计学差异(P>0.05);MDM2高表达组肺腺癌细胞的ALI为1.27%±0.08%,低表达组肺腺癌细胞的 ALI为1.31% ±0.15%,两组比较无统计学差异(P>0.05)。
3 讨论
肺癌的发生是一个多基因参与的多步骤的复杂过程,从肿瘤细胞学来看,肺癌发生的本质在于细胞增殖与凋亡的调节失控,抑癌基因功能的丧失和癌基因的表达是肿瘤发生的主要原因。抑癌基因p53由于含有一段序列专一性转录结合序列,作为转录因子,可调节大量靶基因的表达,在调节细胞生长、分化、衰老、应激等生命过程中起着重要的调控作用,在正常细胞中表达量极低,但是当细胞受到强有力的刺激后表达量急剧增加并被激活,从而影响细胞周期阻滞、凋亡、分化、静息、损伤、及其他功能〔2,3〕。
p53介导的细胞信号转导途径与细胞内其他信号转导通路间存在着错综复杂的相互关系,因此Vogelstein等〔1〕认为,不能独立的衡量p53的生物学功能,而应将各个与之相关的基因综合起来研究其体系,这些体系构成的网络就是p53的生物学功能网络。信号转导途径中任何一个环节的障碍都将影响其功能,导致细胞周期失控、基因不稳定、甚至肿瘤发生。MDM2是一种进化上保守的癌基因,位于染色体12 q13214,全长2.372 kb,编码491个氨基酸组成的蛋白,人和鼠的各种组织中有广泛表达,参与细胞的基本生理过程。MDM2的扩增与肿瘤生长、转移有密切关系。细胞内野生型p53蛋白浓度取决于其降解的速度而不是其生成的速度。其中调节p53表达和功能的负反馈环路是p53-MDM2通路。MDM2是 p53转录靶基因,p53诱导MDM2的表达,MDM2蛋白与p53结合后覆盖其N端酸性活化区,形成MDM2-p53复合物,阻断p53转录活性,使p53泛素化,可作为p53的E3泛素连接体;MDM2也对p53的转录活性有直接抑制作用,MDM2高水平的基因产物可使p53失活,促进p53降解,尤其对野生型p53结合力强,导致基因的不稳定和细胞增生,表现出癌基因蛋白的作用,参与肿瘤形成〔4,5〕。p53在细胞内低浓度又可减少 MDM2 基因转录,将p53-MDM2负反馈环路关闭,使p53回到维持正常功能状态的水平。在应激情况下,对p53-MDM2的翻译后调节、亚细胞再分布、抑制MDM2活性、直接抑制MDM2转录,使得p53快速积聚,防止细胞异常生长和恶性转化〔6〕。MDM2是细胞内调节p53浓度及活性的重要蛋白质,两者构成似电流环路中的负反馈,彼此相互进行精细的调节〔7〕。有研究显示p53诱导MDM2基因转录,MDM2蛋白和p53结合促其失活及降解;突变型p53检出率升高,MDM2检出率下降〔8〕,表明p53/MDM2存在负反馈机制;也有研究表明,两者的变化具有同向性,可能与突变型p53对 MDM2的稳定性强,继续刺激 MDM2产生有关〔9,10〕。我们的研究结果表明,MDM2、p53在肺腺癌各临床分期的表达均有统计学差异,二者的表达之间呈负相关,支持p53/MDM2存在负反馈调节。p53与MDM2之间存在着错综复杂的相互作用与负反馈机制,使得p53的网络体系更加协调和精确。我们的研究表明p53和MDM2的表达和腺癌的临床分期、原发灶大小相关。p53和肿瘤的增殖活性有关而MDM2与之无关,二者均与凋亡指数无关,说明MDM2没有参与肿瘤的高增殖,而p53在肺腺癌的高增殖中起着重要作用。另外还发现二者并非均为正协调作用,又存在着负协调作用,如大腺癌中p53的表达低而MDM2的表达高,这说明二者各自还存在独立作用机制,正是p53和MDM2相互作用的复杂性导致了肺腺癌在不同发展阶段的复杂表现。
我们的研究表明如果能抑制p53或/和MDM2的表达,就可以阻断MDM2-p53通路,从而抑制肺癌的发生和发展。对肺癌进行MDM2、p53检测分析将有利于进一步探讨肺癌发生的作用机制,为肺癌的预防、诊断、治疗提供理论依据。
1 Vogelstein B,Lane D,Levine AJ.Surfing the P53 net work〔J〕.Nature,2000;408:307-10.
2 Kato S,Han SY,Liu W,et al.Understanding the function-structure and function-mutation relationships of p53 tumor suppressor protein by highresolution missense mutation analysis〔J〕.PNAS,2003;100:8424-9.
3 Achison M,Hupp TR.Hypoxia attenuates the p53 response to cellular damage〔J〕.Oncogene,2003;22:3431-40.
4 Buschmann T,Fuchs SY,Lee Cg,et al.SUMO-1 modification of MDM2 prevents its self-ubiquitination and increases Mdm2 ability to ubiquitinate p53〔J〕.Cell,2000;101:753-62.
5 Chne P.Inhibiting the p53-mdm2 interaction:an important target for cancer therapy〔J〕.Nat Rev Cancer,2003;3(2):102-9.
6 Ryan KM,Phillips AC,Vousden KH.Regulation and function of the p53 tumor suppressor protein〔J〕.Curr Opin Cell Biol,2001;13(3):332-7.
7 Lahav G,Rosenfeld N,Sigal A,et al.Dynamics of the p53-MDM2 feedback loop in individual cells〔J〕.Nat Genet,2004;36(2):147-50.
8 Martha L,Simmon S,Kathleen R,et al.Analysis of complex relationships between age,p53,epidermal growth factor receptor,and survival in glioblastoma patients〔J〕.Cancer Res,2001;61:1122-8.
9 孙艳花,钟雪云,陈运贤,等.星形细胞瘤中MDM2、p53的表达及调控机制探讨〔J〕.肿瘤防治研究,2004;31(8):477-9.
10 LeBron C,Chen L,Gilkes DM,et al.Regulation of MDMX nuclear import and degradation by Chk2 and 14-3-3〔J〕.EMBO J,2006;2225(6):1196-206.
