TRAF6在人PBMC来源的树突状细胞成熟中的作用*
2011-08-02曾育杰褚忠华
刘 璐,李 琳,闵 军,王 捷,伍 衡,曾育杰,陈 双,褚忠华△
(中山大学孙逸仙纪念医院1胃肠外科,2妇产科,3肝胆外科,广东 广州 510120)
肿瘤坏死因子受体相关因子(tumor necrosis factor-receptor associated factor,TRAF)是肿瘤坏死因子超家族和Toll样/白细胞介素-1受体(interleukin-1 receptor,IL-1R)超家族重要的接头分子,在天然免疫和获得性免疫中发挥了重要的作用[1]。作为细胞质中重要接头分子,TRAF6是TRAF家族中唯一能与IL-1R相关激酶、CD40等直接结合的信号分子。上述细胞因子通过TRAF6介导,调节下游信号通路,进而调节细胞的增殖及凋亡[2]。最近研究发现,TRAF6是介导树突状细胞(dendritic cells,DCs)成熟信号转导,促进DCs发育、激活与成熟的关键因子[3]。本实验通过观察TRAF6在不同成熟程度DCs的表达,进一步研究TRAF6在DCs诱导T细胞免疫中的作用。
材料和方法
1 材料
1.1 主要试剂 RPMI-1640干粉、L-glutamine、青霉素-链霉素(P-S)双抗(Gibco);胎牛血清(fetal calf serum,FCS)(杭州四季青);Ficoll淋巴细胞分离液(相对密度1.077 g/L)(Lymphoprep);重组人粒细胞-巨噬细胞集落刺激因子(recombinant human granulocyte macrophage colony-stimulating factor,rhGM-CSF)、重组人白细胞介素4(interleukin-4,IL-4)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、重组人白细胞介素 -6(IL-6)、重组人白细胞介素-1β(IL-1β)(PeproTech);藻红蛋白(phycoerythrin,PE)标记小鼠抗人CD83与HLADR、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记小鼠抗人CD86、CD80荧光单克隆抗体(Pharmingen);前列腺素 E2(prostaglandin-E2,PGE2)(Cayman);脂多糖(lipopolysaccharide,LPS)(Sigma);活细胞荧光染料羧基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluoroscein succinimidylester,CFSE)(Molecular Probes);抗人 TRAF6抗体(Abcam);辣根过氧化物酶标记的鼠抗鸡Ⅱ抗(Santa Cruz);人IL-12 p40 ELISA检测试剂盒 (Diclone);Trizol Reagent(Gibco);DL 2000 DNA marker(TaKa-Ra);real-time PCR仪(Roche);UVP-GDS800紫外成像分析系统(UVI)。
1.2 人外周血样品 取自我校身体健康的大学生志愿捐献者,共5份,每份100 mL,均在献血后2 h内进行外周血单个核细胞(peripheral blood mononuclear cells,PBMC)分离。
2 方法
2.1 DCs的培养与诱导成熟 用Ficoll密度梯度离心法分离PBMC,PBS洗涤2次,用RPMI-1640完全培养基(含10%灭活胎牛血清,2 mmol/L L-谷氨酰胺,1×105U/L P-S双抗)将PBMC密度调到5×109/L,加入25 cm2培养瓶,37 ℃、5%CO2培养2 h,洗去非贴壁细胞保存备用。贴壁细胞用含1×106U/L rhGM-CSF和5×105U/L人重组IL-4的RPMI-1640完全培养基培养,第3 d加入新培养基及rhGM-CSF和IL-4。第6 d时收获未成熟DCs,按1×109/L浓度接种24孔板,每孔体积1 mL,继续用rhGM-CSF和IL-4培养,并分组诱导DCs成熟。A组:对照组,仅用rhGM-CSF和IL-4培养;B组:TNF-α诱导组,加入1×106U/L人TNF-α;C组:LPS诱导组,加入LPS 1 mg/L;D组:鸡尾酒法(Cocktail)诱导组,加入细胞因子组合(1×106U/L TNF - α,10 μg/L IL - 6,10 μg/L IL - 1β,1 mg/L PGE2)诱导成熟。各组均在诱导24 h后收获DCs,流式细胞仪进行细胞表型分析,并提取各组RNA。同时收集培养上清,-80℃保存,用于检测IL-12 p40含量。
2.2 DCs表面标志的流式细胞仪分析 用直接免疫荧光标记法标记DCs,FACS Calibur流式细胞仪(B-D)上检测成熟表型 CD80、CD83、CD86、HLA -DR,CellQuest软件分析。每个样品都用荧光标记同型IgG作为相应的阴性对照。
2.3 Western blotting检测TRAF6蛋白的表达 分别收集第7 d各组DCs(1×106/L),考马斯亮蓝检测蛋白浓度后,以10%SDS-PAGE电泳分离样品。电泳完毕后转膜至PVDF膜,然后使用含5%脱脂奶的TBST进行封闭。加入鸡抗人TRAF6多克隆抗体后4℃孵育过夜,辣根过氧化物酶标记的鼠抗鸡Ⅱ抗常温孵育1 h。加底物TMB显色。
2.4 实时荧光定量 PCR(real-time PCR)检测TRAF6 mRNA表达 以GAPDH作为内参照,TRAF6上游引物5’-AGGAATGTAGCAGCGATGGAA-3’,下 游 引 物 5’ - AGCCCAAGAAAGTACAACAAAGAG-3’,扩增产物217 bp(由上海博亚合成)。DNase I消化基因组 DNA后,逆转录合成cDNA,进行real-time PCR反应。反应条件:95℃变性10 min,95 ℃ 15 s,60 ℃ 5 s,72 ℃ 15 s共40 个循环,76℃ 5 s检测荧光,75℃到95℃做融解曲线。琼脂糖凝胶电泳检测PCR扩增情况,结果以TRAF6 mRNA在不同诱导成熟组与对照组表达量的差异倍数表示。
2.5 ELISA法检测DCs的IL-12分泌 采用双抗体夹心法检测IL-12 p40的含量,操作步骤按产品说明书进行,显色后即刻用Wellscan MK3酶标仪检测450 nm波长的吸光度(absorbance,A)值,根据标准曲线确定IL-12的含量,最小可测人IL-12 p40为20 ng/L。
2.6 混合淋巴细胞反应(mixed lymphocyte reaction,MLR)
①刺激细胞的获取和处理 DCs培养的第7 d分别收集各组DCs,加入丝裂霉素C混和(终浓度为25 mg/L),37℃避光水浴30 min后,PBS离心洗涤3次,重悬细胞。
②应答细胞的获取和处理 收集2 h非贴壁的同种异体淋巴细胞,以PBS洗涤2次后加入CFSE 2.5 μmol/L染液使细胞浓度为1×1010/L。置于37℃水浴15 min,每5 min摇动1次。用RPMI-1640完全培养基中止染色,离心后重悬细胞。
③混合淋巴细胞培养 将上述刺激细胞和应答细胞按1∶10混合,以200 μL/well种至96孔 U形底细胞培养板,并设只有反应细胞的孔为对照。于37℃、5%CO2条件下培养。混合培养96 h后,收集细胞并洗涤后,送流式分析。在前散射(forward light scatter,FSC)和对侧散射(side light scatter,SSC)二维散点图中划出淋巴细胞区R,分别对每个组别这群细胞的 FL1强度进行检测,获得的数据用CellQuest软件和ModFit软件分析。
3 统计学处理
采用SPSS 15.0统计软件进行数据分析。数据以均数±标准差()表示,计数资料组间比较采用单因素方差分析。
结 果
1 各组DCs表面标志的变化
通过对第7 d后各组DCs流式检测,B、C、D组反映成熟指标的细胞表型CD80、CD83、HLA-DR均明显提高,与对照组(A组)比较差异显著(P<0.05),其中CD83升高最为显著(P<0.01)。成熟表型表达最好的是鸡尾酒法组,各成熟指标均高于B、C组,其中CD83指数高达84.87%,说明鸡尾酒法诱导的DCs成熟度最佳,见图1。
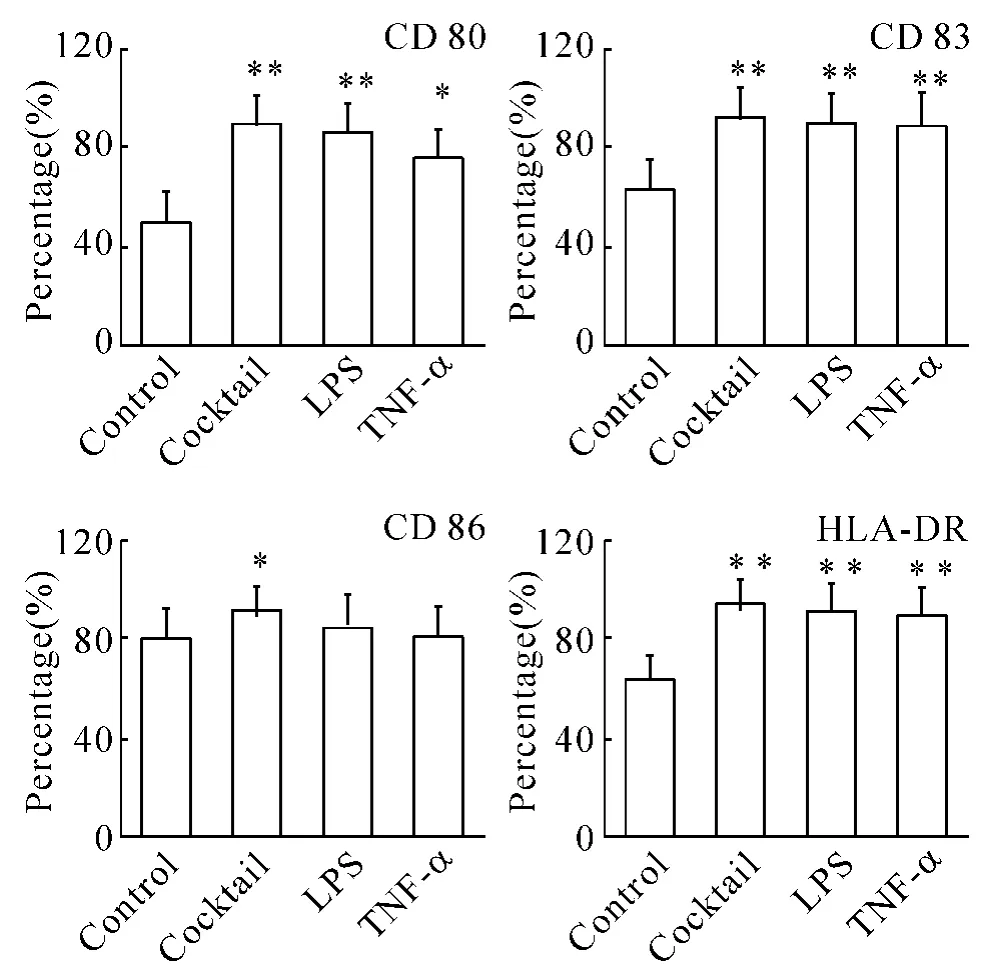
Figure1.The phenotype comparison of DCs among different groups..n=5.*P<0.05,**P<0.01 vs control group.图1 各组DCs的细胞表型比较
2 Western blotting检测结果
检测培养6 d后加不同因子诱导24 h后各诱导组DC TRAF6蛋白的表达水平,B、C、D组较对照组TRAF6蛋白的表达升高,其中鸡尾酒法组TRAF6蛋白的表达量最高,见图2A。B、C、D组TRAF6蛋白的表达为(0.87±0.06,0.78±0.09,1.61±0.22),与对照组(0.44±0.08)比较差异显著(P<0.05)。并且B组TRAF6蛋白的表达与C、D组比较差异显著(P <0.05),见图2B。
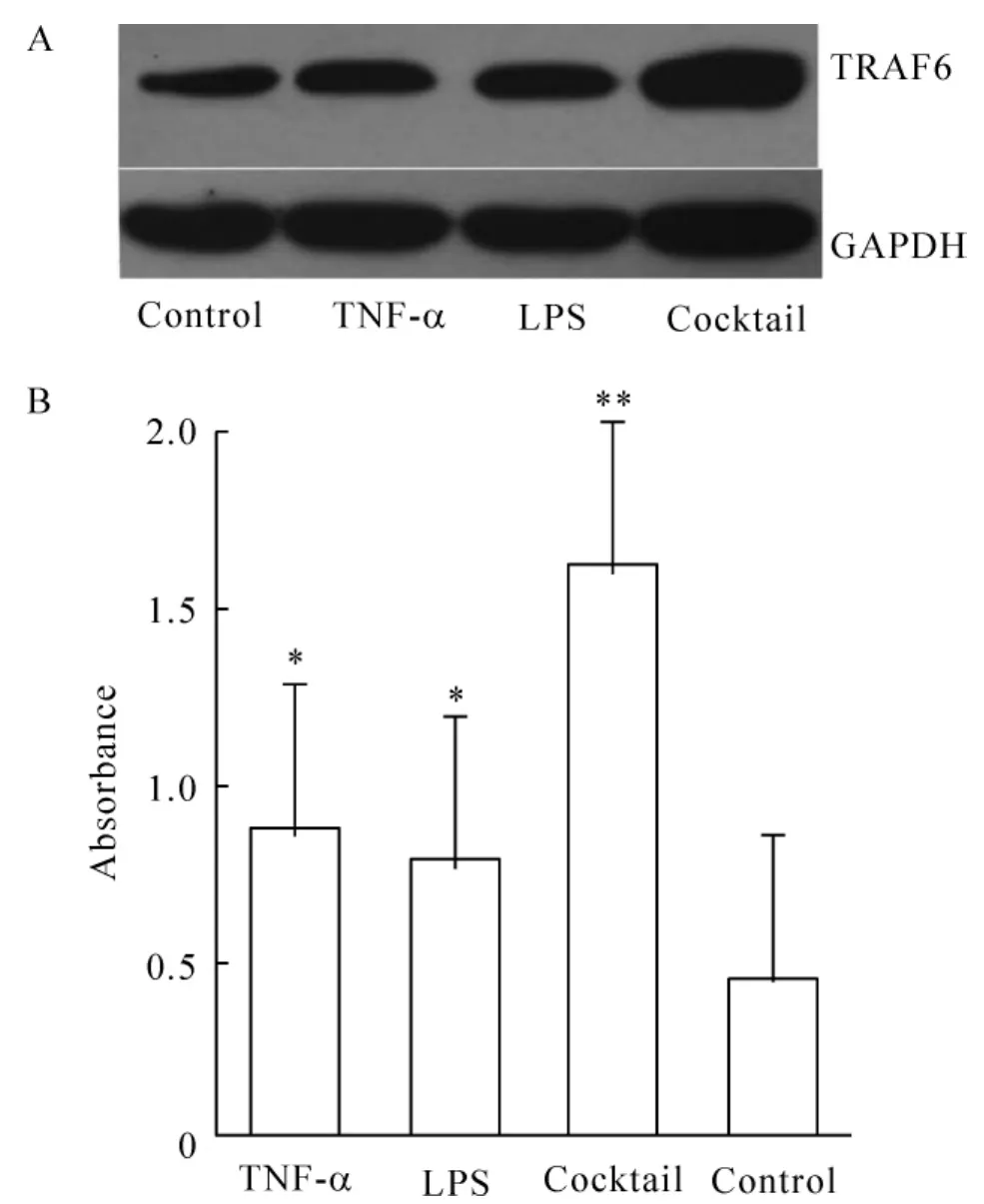
Figure2.The expression of TRAF6 protein in different groups with Western blotting assay..n=5.*P<0.05,**P <0.01 vs control group.图2 Western blotting检测各组DCs TRAF6蛋白表达
3 Real-time PCR检测各组DCs TRAF6 mRNA表达水平
图3为real-time PCR定量曲线。可见当PCR反应进入对数增长期时,在同一个PCR循环期内鸡尾酒组扩增的TRAF6 mRNA实时荧光强度显著高于其它各组,说明鸡尾酒组TRAF6 mRNA扩增起始浓度高于其它各组。进一步分析看到,D组TRAF6 mRNA表达量的差异倍数(2.99±0.39)与 B组(1.01±0.34)、C组(1.37±0.20)比较差异显著(P<0.01)。
4 各组DCs IL-12分泌量变化
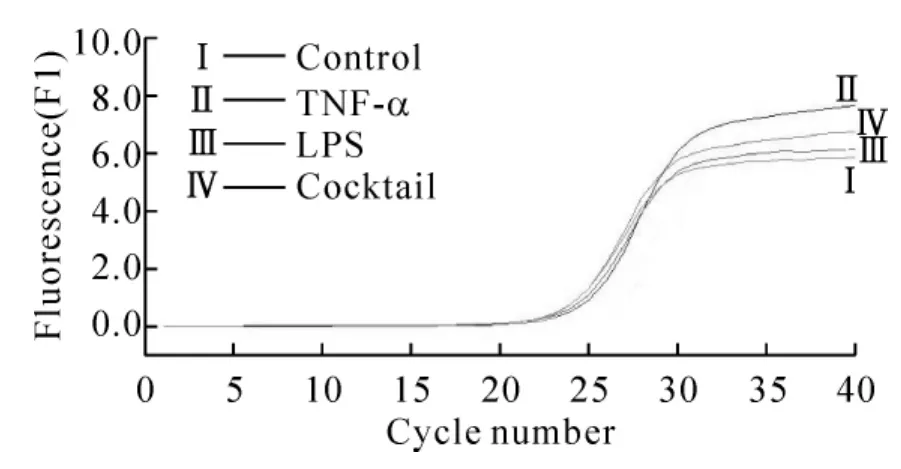
Figure3.The real-time PCR amplification curves of TRAF6 mRNA in different groups.图3 各组DCs TRAF6 mRNA的扩增曲线图
采用双抗体夹心ELISA法检测各组DCs 24 h IL-12 p40分泌量,以1×106个DCs在1 mL培养液中的IL-12p40浓度表示。B、C、D组IL-12p40分泌量[(311.95±32.60)μg/L、(409.13±20.99)μg/L、(656.18±38.52)μg/L]与对照组[(142.72±21.65)μg/L]比较差异显著(P <0.05),见图4。其中鸡尾酒诱导下DCs IL-12 p40分泌量显著高于B、C组(P<0.05)。
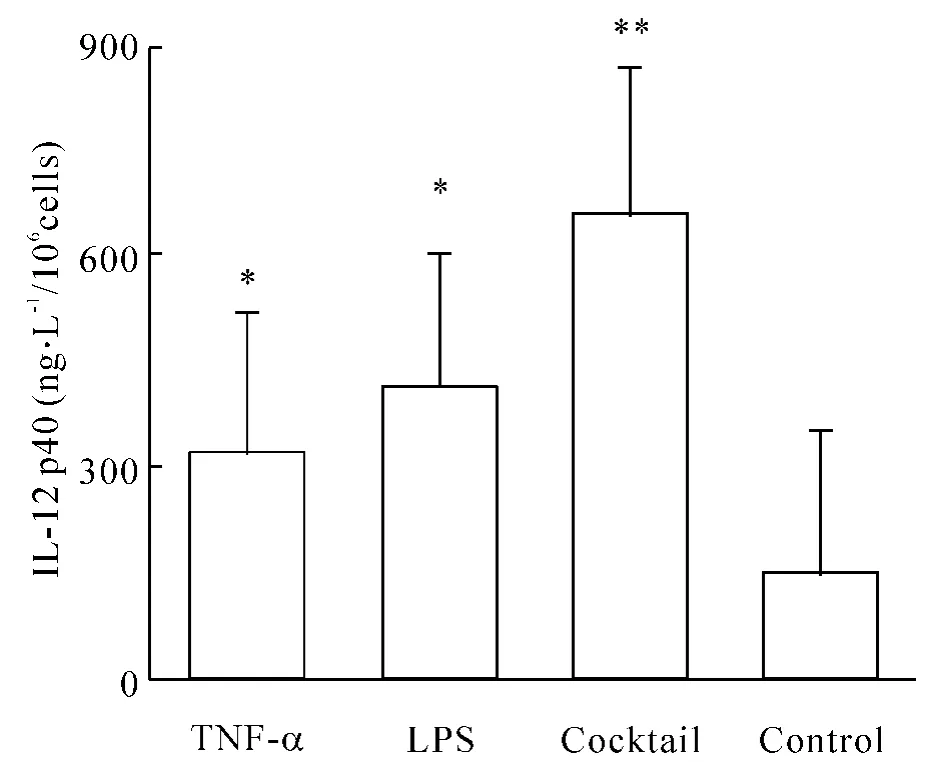
Figure4.The IL-12 production in different groups..n=5.*P <0.05,**P <0.01 vs control group.图4 各组DCs IL-12的分泌量
5 各组DCs的MLR变化
由于成熟DCs高表达共刺激分子,有较强的刺激T淋巴细胞活化增殖的能力。我们使用CFSE荧光标记淋巴细胞,当淋巴细胞分裂时,CFSE标记的荧光可平均分配至两个子代细胞中。因此在一个增殖的细胞群中,各连续子代细胞的荧光强度呈对半递减。通过CFSE法可以检测DCs对CFSE标记的淋巴细胞的刺激增殖能力,并以增殖淋巴细胞的子代占母代的比率表示。B、C、D组诱导的DCs的淋巴细胞刺激能力与对照组比较差异显著(P<0.05),见图5。而鸡尾酒诱导下DCs对淋巴细胞刺激能力显著高于B、C组(P<0.05),结果也与其DCs成熟程度与共刺激分子高表达相符合。
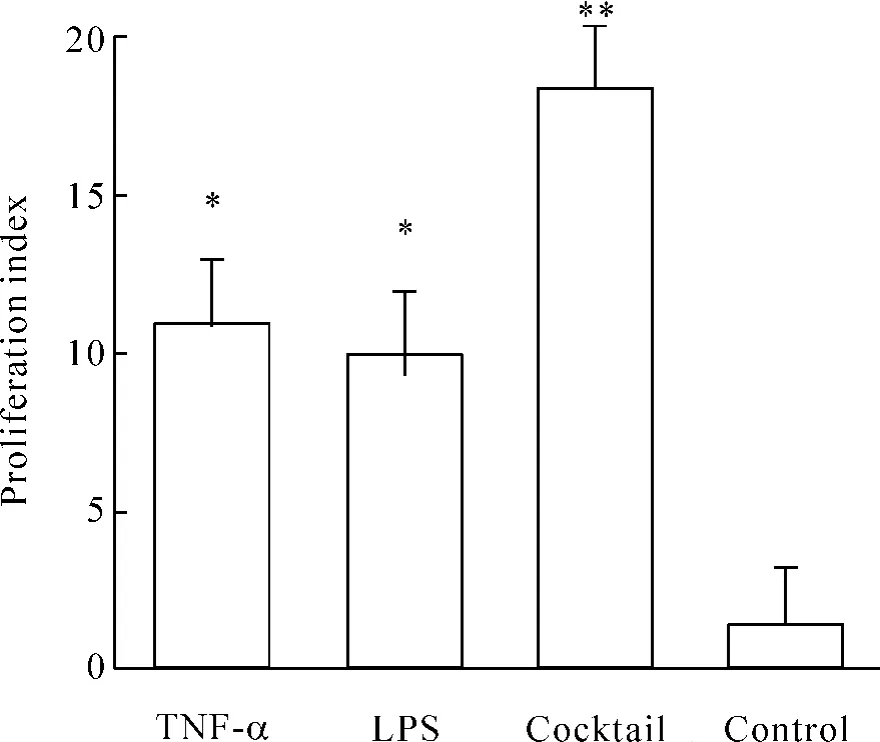
Figure5.Mixed leukocyte reaction..n=5.*P<0.05,**P<0.01 vs control group.图5 混合淋巴细胞反应
讨 论
研究发现,TRAF6是TRAF家族中唯一同时参与TNFR和IL-1R/TLR两个受体超家族信号转导的成员,介导不同受体转导的激活NF-κB的信号(包括IL-1、TLRs和CD40),成为多种信号传递与相互作用的枢纽[4]。TRAF6具有独特的受体结合特异性,对于受体的识别与其它成员有明显的结构差异。IL-1R/TLRs一旦与配体结合,即通过它们的共同接头蛋白MyD88或类MyD88接头蛋白Mal,经TRAF6介导NF-κB的激活与移位,启动信号转导途径[5];而TNFR超家族成员如CD40和RANK则直接通过TRAF6激活NF-κB。此外,TRAF6在IL-25R介导的NF-κB激活与表达中起重要作用[6]。NF-κB的激活参与DCs启动成熟过程,包括增加共刺激分子CD80、CD86表达和促进炎症因子的释放。
DCs作为功能最强的专职抗原递呈细胞,在调节机体免疫反应中起核心作用。成熟DCs高表达MHC抗原肽和共刺激分子,具有刺激淋巴细胞增殖和激发免疫反应的能力。我们结果显示在不同因子诱导的成熟DCs中,鸡尾酒法诱导的DCs各项成熟表型指标最佳,特别是成熟 DCs的特征性标志CD83,其指数达到84.87。蛋白质印记检测各成熟诱导组DCs TRAF6蛋白表达均升高。为进一步准确定量不同成熟度DCs的TRAF6 mRNA的表达,我们采用real-time PCR了解各组TRAF6 mRNA的表达差异,结果显示随着DCs成熟度的不同,TRAF6 mRNA表达有明显的变化。TRAF6 mRNA表达越强则DCs的成熟度越高。说明TRAF6可能通过促进激活NF-κB上调DCs表面MHC抗原肽和共刺激分子进而诱导DCs成熟。Megas等[4]发现TRAF6基因缺失可影响细胞内NF-κB的激活。而Kobayashi等[3]研究发现TRAF6基因缺失,DCs不能上调MHC抗原肽和CD86分子表达,进一步证明TRAF6在上调DCs表面分子方面发挥了重要的作用。
DCs通过摄取、加工处理和递呈抗原,诱导T细胞分化。MLR结果显示TRAF6表达最高的鸡尾酒法诱导DCs刺激T细胞增殖能力最强。而TRAF6基因缺陷的DCs诱导T细胞增殖能力减弱[3],因为T细胞的完全激活需要多种信号的刺激,MHC抗原肽(第一信号)和共刺激分子CD80(第二信号)对在诱导T细胞分化过程中发挥了重要的作用[7,8]。因此DCs诱导T细胞分化能力与其表面分子的上调有密切关系。
成熟DCs通过分泌IL-12,可刺激淋巴细胞增殖。我们的结果显示TRAF6表达越高,IL-12的分泌量越大。LPS等刺激因子与细胞表面TLR结合,通过蛋白MyD88激活白细胞介素-1受体相关激酶(interleukin -1 receptor- associated kinase,IRAK),TRAF6在此过程中发挥了重要的作用。而MyD88蛋白则是诱导DCs分泌IL-12的重要因素[3],并且IL-12是诱导Th细胞向Th1细胞分化的关键因素[9,10],可促进 T 细胞增殖、分化。
综上所述,TRAF6的表达与DCs的成熟程度有密切的关系,TRAF6是调节DCs成熟、分化和激活的关键因素。特异性干预TRAF6的表达,可望有效抑制DCs的成熟。
[1]Chen F,Du Y,Zhang Z,et al.Syntenin negatively regulates TRAF6-mediated IL-1 R/TLR4 signaling[J].Cell Signal,2008,20(4):666 -674.
[2]Sasai M,Tatematsu M,Oshiumi H,et al.Direct binding of TRAF2 and TRAF6 to TICAM-1/TRIF adaptor participates in activation of the Toll-like receptor 3/4 pathway[J].Mol Immunol,2010,47(6):1283 -1291.
[3]Kobayashi T,Walsh PT,Walsh MC,et al.TRAF6 is a critical factor for dendritic cell maturation and development[J].Immunity,2003,19(3):353 -363.
[4]Megas C,Hatzivassiliou EG,Yin Q,et al.Mutational analysis of TRAF6 reveals a conserved functional role of the RING dimerization interface and a potentially necessary but insufficient role of RING-dependent TRAF6 polyubiquitination towards NF - κB activation[J].Cell Signal,2011,23(5):772-777.
[5]Yamashita M,Fatyol K,Jin C,et al.TRAF6 mediates Smad-independent activation of JNK and p38 by TGF-β[J].Mol Cell,2008,31(6):918–924.
[6]Maezawa Y,Nakajima H,Suzuki K,et al.Involvement of TNF receptor-associated factor 6 in IL-25 receptor signaling[J].J Immunol,2006,176(2):1013 -1018.
[7]Barratt-Boyes SM,Thomson AW.Dendritic cells:tools and targets for transplant tolerance[J].Am J Transplant,2005,5(12):2807-2813.
[8]黄立锋,姚咏明,盛志勇.树突状细胞与调节性T细胞相互作用研究进展[J].中国病理生理杂志,2008,24(3):610-616.
[9]Trinchieri G.Interleukin-12 and the regulation of innate resistance and adaptive immunity[J].Nat Rev Immunol,2003,3(2):133 –146.
[10]刘元生,范洪涛,郭秀枝,等.白介素12对T淋巴细胞作用与表面分子表达的关系[J].中国病理生理杂志,2002,18(7):858-859.
