IL-18基因修饰对肺癌细胞来源exosome诱导杀伤肿瘤细胞作用的影响*
2011-08-02张在云李晓梅王涓冬孙建华姜玉华潘祥林
张在云,李晓梅,王涓冬,孙建华,姜玉华△,潘祥林
(山东大学第二医院1肿瘤防治中心,2血液内科,山东 济南 250033)
肺癌的发病率和死亡率高,目前居恶性肿瘤死因的首位。生物免疫治疗是肺癌治疗的重要手段,exosome疫苗在多种肿瘤中显示了抗肿瘤作用,受到普遍关注,但eoxosme疫苗的疗效有待于进一步提高。白细胞介素18(interleukin 18,IL-18)具有强大的免疫刺激功能,IL-18基因修饰能增强肿瘤疫苗的疗效[1],但IL-18基因修饰否能增强肺癌细胞来源exosome诱导的抗肿瘤作用尚不清楚。肿瘤细胞来源的exosome含有肿瘤抗原,能够刺激树突状细胞(dendritic cells,DC)诱导活化T细胞而产生抗肿瘤作用[2],是exosome疫苗重要来源。为此,本文旨在研究IL-18基因修饰的NCI-H460肺癌细胞来源exosome诱导活化T细胞对肺癌细胞的杀伤作用,为获得高效的exosome疫苗作初步探讨。
材料和方法
1 主要材料及仪器
RPMI-1640培养液 (Gibco);蔗糖、重水(Sigma);超滤离心管(Millipore);鼠抗人热休克蛋白70(heat shock protein 70,HSP70)、人白细胞抗原(human leukocyte antigtn,HLA)及 IL-18 抗体(Santa Cruz);辣根酶标记兔抗鼠 IgG(Santa Cruz);ECL(Santa Cruz);LDH试剂盒(南京建成生物工程公司);IL-18和pcDNA3.1+载体修饰的NCI-H460细胞由本实验室保存。CO2培养箱(Format);超速冷冻离心机(55P-72型,日立),TEM-100X透射电镜(日立);电泳仪及凝胶成像仪(Bio-Rad);紫外分光光度仪(Hewlett-Packard)。
2 Exosome的提取及电镜观察
将IL-18基因修饰的NCI-H460细胞(IL-18/H460)、pcDNA3.1+载体修饰细胞(DNA3.1/H460)及未修饰NCI-H460细胞(NCI-H460)用RPMI-1640培养液培养,收集上清液,用差速离心法提取exosome。细胞培养上清液1000×g,离心10 min;取上清,10000×g离心10 min;取上清液,将30%蔗糖/重水垫、上清液及PBS依次放入离心管中,100000×g,离心1 h;取混有exosome的蔗糖/重水垫,用PBS悬浮,加入到100 kD超滤离心管中,重复3次,浓缩液即为exosome,用0.22 μm的滤膜过滤除菌,放入-80℃冰箱中保存备用。
取exosome 20 μL,滴于载样铜网上,室温静置1 min,用滤纸吸干液体,滴加20 g/L磷钨酸负染1 min,用滤纸吸干负染液,用白炽灯烤干,透射电镜下观察形态。
3 Exosome蛋白分析
将exosome经超声冲击破膜,用Western blotting方法检测exosome中HSP70、HLA及IL-18的表达。取20 μg用SDS-PAGE凝胶电泳,将蛋白电转移至硝酸纤维素膜,室温封闭1h,加入鼠抗人 HSP70、HLA、IL-18抗体,再加入辣根过氧化物酶标记的兔抗鼠IgG抗体,进行ECL反应显影,在Bio-Rad凝胶成像仪中观察分析结果。
4 Exosome诱导活化的T细胞对肺癌细胞的杀伤作用
分离人外周血T细胞,在T细胞中加入10 μg exosome培养72 h,为exosome直接刺激活化的T细胞。用人外周血单个核细胞诱导培养DC[3],将成熟DC加入exosome 10 μg培养24 h,再将DC与T细胞按1∶10混合培养72 h,为exosome冲击DC活化的T细胞。以活化T细胞为效应细胞(E),NCI-H460细胞为靶细胞(T),设反应孔、最大释放孔及自然释放孔,反应孔含效应细胞和靶细胞,自然释放孔只加靶细胞,最大释放孔加Triton X-1002 μL,按乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒说明书用LDH 法测定效靶比分别为 25∶1、10∶1、5∶1 时活化 T细胞对NCI-H460细胞的杀伤作用,计算杀伤率。

5 统计学处理
结 果
1 Exosome的电镜观察及蛋白分析
3组细胞上清液经差速离心法提取exosome,透射电镜下观察到exosome呈囊泡状,圆球形,大小不一,直径在30-150 nm之间,3组exosome的形态、大小无显著差异。用Western blotting方法检测exosome中HSP70、HLA及IL-18的表达,结果3组细胞exosome均有HSP70及HLA蛋白表达。IL-18/H460组exosome有IL-18蛋白的表达,而其余2组未见IL-18蛋白表达,见图1。
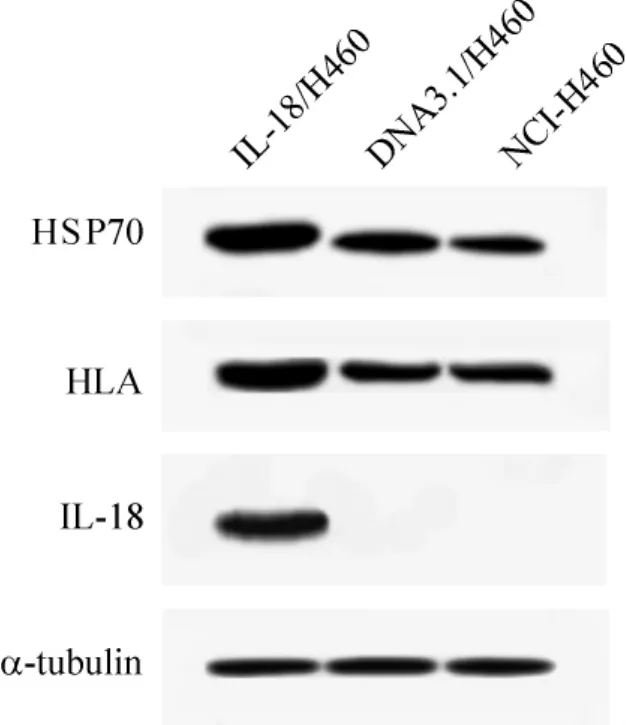
Figure1.HSP70,HLA and IL-18 proteins in exosomes of the 3 groups(IL-18/H460,DNA3.1/H460,and NCIH460)were detected by Western blotting.HSP70 and HLA proteins were detected in exosomes of all the 3 groups,and IL-18 protein was observed only in IL-18/H460 group.图1 Exosome中HSP70、HLA及IL-18蛋白表达
2 Exosome刺激的T细胞对NCI-H460细胞的杀伤作用
用3组细胞exosome直接刺激T细胞,用LDH法检测T细胞对NCI-H460细胞的杀伤作用。结果在效靶比25∶1、10∶1、5∶1 时,IL-18/H460 组杀伤率为(38.45±5.42)%、(25.17±3.94)%和(11.75±3.22)%,效靶比25∶1和10∶1时高于DNA3.1/H460组(P<0.05)及NCI-H460组(P<0.05),后2组之间杀伤率无显著差异。IL-18/H460组杀伤率随效应细胞比例增加而提高,效靶比25∶1时杀伤率高于10∶1(P <0.05)及5∶1时(P <0.05),见图2。
3 Exosome冲击DC活化的T细胞对NCI-H460细胞的杀伤作用
将3组细胞exosome冲击DC,再用DC活化T细胞,检测其对NCI-H460细胞的杀伤作用。在效靶比25∶1、10∶1、5∶1 时 IL-18/H460 组杀伤率为(89.05±4.06)%、(64.97±6.02)%和(40.16±4.98)%,均高于DNA3.1/H460组(P<0.05)及NCI-H460组(P<0.05),后2组之间无显著差异。IL-18/H460组效靶比25∶1时杀伤作用最强,10∶1时次之,5∶1 时作用最弱,见图3。

Figure2.The lethal effects of exosome-activated T cells on NCI-H460 lung cancer cells(LDH method).The killing rates of IL-18/H460 group at E∶T ratio of 25∶1,10∶1 and 5∶1 were higher than those in DNA3.1/H460 and NCI-H460 groups..n=6.△P <0.05 vs IL-18/H460.E∶T =effector cell∶target cell.图2 Exosome刺激的T细胞对NCI-H460细胞的杀伤作用
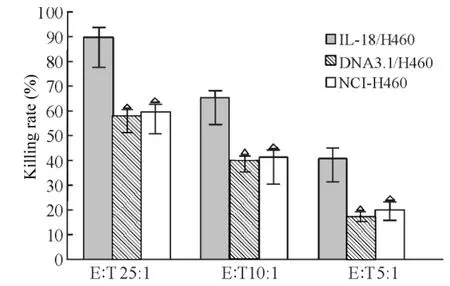
Figure3.The lethal effects of exosome-pulsed DC-activated T cells on NCI-H460 lung cancer cells(LDH method).The killing rates of IL-18/H460 group at E∶T ratio of 25∶1,10∶1 and 5∶1 were higher than those in DNA3.1/H460 and NCI-H460 groups..n=6.△P <0.05 vs IL-18/H460.图3 Exosome冲击DC活化的T细胞对NCI-H460细胞的杀伤作用
4 Exosome冲击DC活化的T细胞与exosome直接刺激的T细胞杀伤肿瘤细胞作用比较
将exosome冲击DC活化的T细胞杀伤作用与exosome直接刺激T细胞的杀伤作用相比较,前者在效靶比25∶1、10∶1、5∶1 时其 IL-18/H460 组杀伤率均高于后者(P<0.05),表明用IL-18基因修饰的NCI-H460细胞来源的exosome诱导抗肿瘤作用时,exosome冲击DC活化的T细胞杀伤作用强于exosome直接刺激活化的T细胞,见图4。

Figure4.Comparison of the anti-tumor efficacy between exosome-pulsed DC-activated T cells and exosomestimulated T cells in IL-18/H460 group.The killing rates of exosome-pulsed DC-activated T cells at E∶T ratio of 25∶1,10∶1 and 5∶1 were higher than those of exosome-stimulated T cells..n=6.△P<0.05 vsexosome-DC.图4 Exosome冲击DC活化的T细胞与exosome直接刺激的T细胞杀伤肿瘤细胞作用比较
讨 论
Exosome最初用来描述网织红细胞分泌的一种膜小泡,后来发现B淋巴细胞、树突状细胞、肥大细胞、肠上皮细胞和肿瘤细胞等多种细胞可分泌exosome[4,5],它来源于细胞的多泡体,是由多泡体的泡膜与质膜融合后释放到胞外空间的小泡,由脂质双分子层膜包被,直径为30-100 nm,呈蝶形或球形。Exosome含有丰富的蛋白质,不同细胞来源的exosome所含的蛋白质不同,其生物学功能也有差异。肿瘤细胞来源的exosome含有MHC-Ⅰ类分子、热休克蛋白、肿瘤特异性抗原及肿瘤共同抗原,可以作为一种抗原载体,将肿瘤抗原转移到抗原提呈细胞,并具有交叉提呈作用[6]。杀伤性T细胞是抗肿瘤免疫治疗的关键细胞,T细胞的活化需要有肿瘤抗原,抗原呈递、共刺激分子等,exosome含肿瘤抗原和抗原呈递所需物质,本身可以呈递抗原,活化T细胞,因而是exosome肿瘤疫苗的重要来源。应用肿瘤细胞来源的exosome构建肿瘤疫苗,可以通过exosome冲击DC而诱导活化T细胞,也可由exosome直接刺激活化T细胞,发挥抗肿瘤作用[7,8]。本研究比较了NCI-H460细胞来源的exosome经冲击DC后活化T细胞与直接刺激活化T细胞对肺癌细胞的杀伤作用,结果exosome直接刺激活化的T细胞显示了对肺癌细胞的杀伤作用,但杀伤效力较exosome冲击DC后活化的T细胞明显减弱,表明了DC在exosome肿瘤疫苗中的关键地位。
目前的exosome疫苗虽然显示了一定的抗肿瘤作用,但其效力有待于增强。IL-18是功能强大的细胞因子,可诱导TNF-α、GM-CSF和 IFN-γ等细胞因子的产生,调节T细胞、B细胞、NK细胞、巨噬细胞和DC的活性,在抗肿瘤和机体的免疫调节等方面具有重要作用[9],研究显示IL-18基因修饰能够增强DC的活性和免疫刺激能力[10]。我们研究了IL-18基因修饰的NCI-H460细胞来源exosome诱导的T细胞对肺癌细胞的杀伤作用,以pcDNA3.1+修饰的NCI-H460细胞与未修饰的NCI-H460细胞为对照,结果IL-18基因修饰组作用明显强于对照组,而后二者之间作用无显著差异,因而排除了基因转染过程的干扰因素。这表明IL-18基因修饰可以增强肺癌细胞来源exosome诱导的抗肿瘤作用,为IL-18与exosome疫苗联合用于肺癌治疗提供了理论依据,但其作用机制尚待进一步阐明。
[1]Cao DY,Yang JY,Dou KF,et al.Alpha-fetoprotein and interleukin-18 gene-modified dendritic cells effectively stimulate specific type-1 CD4-and CD8-mediated T-cell response from hepatocellular carcinoma patients in vitro[J].Hum Immunol,2007,68(5):334-341.
[2]张家模,吴小候,张 尧,等.膀胱移行细胞癌来源的exosome诱导体外细胞毒性T细胞杀伤效应[J].中华肿瘤杂志,2009,31(10):738-741.
[3]傅永强,张在云,李旭升,等.白细胞介素-18干预诱导的树突状细胞表型和活性研究[J].中国病理生理杂志,2008,24(7):1414-1417.
[4]Viaud S,Théry C,Ploix S,et al.Dendritic cell-derived exosomes for cancer immunotherapy:what's next?[J].Cancer Res,2010,70(4):1281-1285.
[5]Saunderson SC,Schuberth PC,Dunn AC,et al.Induction of exosome release in primary B cells stimulated via CD40 and the IL-4 receptor[J].J Immunol,2008,180(12):8146-8152.
[6]Clayton A,Mitchell JP,Court J,et al.Human tumorderived exosomes down-modulate NKG2D expression[J].J Immunol,2008,180(11):7249-7258.
[7]Hao S,Bai O,Li F,et al.Mature dendritic cells pulsed with exosomes stimulate efficient cytotoxic T-lymphocyte responses and antitumour immunity[J].Immunology,2007,120(1):90-102.
[8]Tan A,De La Peña H,Seifalian AM.The application of exosomes as a nanoscale cancer vaccine[J].Int J Nanomedicine,2010,5:889-900.
[9]Nakanishi K,Tsutsui H,Yoshimoto T.Importance of IL-18-induced super Th1 cells for the development of allergic inflammation[J].Allergol Int,2010,59(2):137-141.
[10]张在云,吴金民.白细胞介素18基因转染的肺癌细胞对树突状细胞免疫特性的影响[J].中国病理生理杂志,2007,23(4):794-798.
