CHFR在子宫内膜癌细胞中的表达和甲基化调控*
2011-08-02王小韵杨越波李小毛许成芳
王小韵,杨越波,李小毛,许成芳,方 莉,张 旭
(中山大学附属第三医院妇科,广东 广州 510630)
Scolnick等[1]于2000年发现一种能够检测处于分裂期正常细胞的分裂情况及控制分裂进行的蛋白,因其 N-端有叉头相关(forkhead-associated,FHA)区和环指(ring finger,RF)区,故命名为CHFR(checkpoint with forkhead-associated and ring finger)。研究证实,CHFR蛋白是一个有丝分裂前期检查点,它的表达增强细胞对应激的生存能力[2]。子宫内膜癌发病率逐年升高,已超过宫颈癌,目前成为最常见的盆腔恶性肿瘤[3]。CHFR在消化道肿瘤中的报道屡见不鲜[4],但在子宫内膜癌中的作用目前仅有日本学者Yanokura等[5]的研究显示该基因在子宫内膜癌中表达降低。本研究检测子宫内膜癌细胞株中CHFR的表达情况,探讨其基因甲基化调控机制,以及细胞的克隆形成能力,旨在揭示CHFR表达与启动子甲基化的联系及对子宫内膜癌细胞克隆形成能力的影响,从而探索CHFR在子宫内膜癌发生发展中的作用和临床价值。
材料和方法
1 材料
1.1 细胞株 人子宫内膜癌细胞株ISH、RL-952及正常人成纤维细胞(normal fibroblast,NF)由中山大学附属第三医院中心实验室提供。
1.2 试剂 细胞培养基DMEM和RNA提取物Trizol购于Invitrogen,Reverse Transcription System 试剂盒购于 TaKaRa,5-氮杂胞苷(5-azacytidine,5-aza)购于Sigma,DNA提取试剂盒购于Qiagen,亚硫酸氢钠修饰试剂盒购于Chemicon,蛋白提取和定量试剂盒购于凯基公司,兔抗人CHFR蛋白多克隆抗体购于Abcam,GAPDH兔抗单克隆抗体购于Santa Cruz,辣根酶标记的羊抗兔抗体购于Pierce,CpG甲基化酶(SssI methylase)购自NEB。引物均由上海生物工程公司合成。
2 方法
2.1 细胞培养 3种细胞株均用含10%胎牛血清的DMEM高糖培养基,在5%CO2、37℃、饱和湿度的培养箱中培养。
2.2 半定量RT-PCR检测CHFR mRNA的表达采用Trizol分别提取3种细胞总RNA,在紫外分光光度仪上测定吸光度值鉴定RNA纯度,A260/A280比值1.8左右。用Reverse Transcription System试剂盒进行逆转录,以cDNA为模板扩增CHFR基因。CHFR上游引物 5'-GGCGAGAGCGTTCCTCCAGTTG-3',下游引物5'-GCATGTCAGCGTCTCCTCCATCTTG-3',扩增产物长度为317 bp。内参照GAPDH上游引物5'- GAAGGTGAAGGTCGGAGTCAA -3',下游引物5'-GTGCTCAGTGTAGCCCAGGAT -3',扩增产物长度为832 bp。PCR反应在9700型PCR扩 增 仪上 进 行,取 10 μL反应产物,1.5%琼脂糖凝胶电泳,拍照并用IS1000图像分析软件分析,以CHFR条带密度与GAPDH条带密度值的比值表示CHFR mRNA的相对表达水平。
2.3 甲基化特异性PCR检测CHFR的甲基化状态用DNA提取试剂盒提取3种细胞中的DNA,紫外分光光度仪检测DNA A260/A280为1.8-2.0。取1 μg DNA按亚硫酸氢钠修饰试剂盒说明书进行修饰。CHFR的甲基化、非甲基化引物序列及反应条件参照文献[6]。甲基化特异性PCR扩增中的甲基化上游引物 5'- GTTATTTTCGTGATTCGTAGGCGAC -3',下游引物 5'- CGAAACCGAAAATAACCCGCG - 3',扩增产物长度为100 bp;非甲基化上游引物5'-GATTGTAGTTATTTTTGTGATTTGTAGGTGAT -3',下游引物5'-AACTAAAACAAAACCAAAAATAACCCACA-3',扩增产物长度为115 bp。甲基化酶SssⅠ修饰的正常人外周血 DNA为甲基化阳性对照,以无菌ddH2O代替DNA模板作阴性对照,在9700型PCR扩增仪上进行反应,取10 μL反应产物,2%琼脂糖凝胶电泳,紫外灯下观察并拍照。
2.4 免疫印迹法(Western blotting)检测CHFR蛋白表达 提取1×106个细胞的蛋白,紫外光分光光度计定量,聚丙烯酰胺凝胶电泳,转印至硝酸纤维素膜上,常规进行免疫印迹实验操作,CHFR兔抗1∶500和GAPDH兔抗1∶200稀释及羊抗兔Ⅱ抗抗体孵育,增强发光(ECL)显色。对膜上的免疫复合物条带进行分析,CHFR蛋白的相对表达水平为CHFR蛋白条带密度/GAPDH条带密度。
2.5 去甲基化作用 RL-952细胞 用5 μmol/L 5-aza处理甲基化高表达的子宫内膜癌细胞,作用48 h后,更换相同药物浓度的培养基,再作用72h后分别检测去甲基化处理的细胞中CHFR mRNA和蛋白表达情况并进行甲基化状态分析,具体方法同前。
2.6 平板集落形成实验检测5-aza处理后RL-952细胞的克隆形成能力 取对数生长期的高甲基化细胞,逐级稀释后按每个皿500个细胞梯度密度接种到3.5 cm细胞培养皿中,实验组加入5 μmol/L 5-aza,对照组加同体积的PBS,置于37℃、5%CO2培养箱连续培养2周后中止培养。细胞经甲醇固定15 min,Giemsa染色30 min,显微镜下计数细胞克隆数并换算成克隆形成率。克隆形成率(%)=克隆数/接种细胞数×100%;克隆形成判定标准为 ≥50个细胞,实验设3个平行样品,重复3次,结果取平均值。
3 统计学处理
用SPSS 11.0统计软件进行数据分析。计量资料用均数±标准差()表示,组内数据比较采用配对资料t检验,组间比较采用单因素方差分析。
结 果
1 子宫内膜癌细胞中CHFR mRNA的表达
RT-PCR方法检测结果显示CHFR mRNA的相对表达水平:NF为0.76±0.12,ISH细胞为0.68±0.14,而RL-952细胞为0.26±0.07,明显低于NF和ISH细胞(P<0.01),见图1。
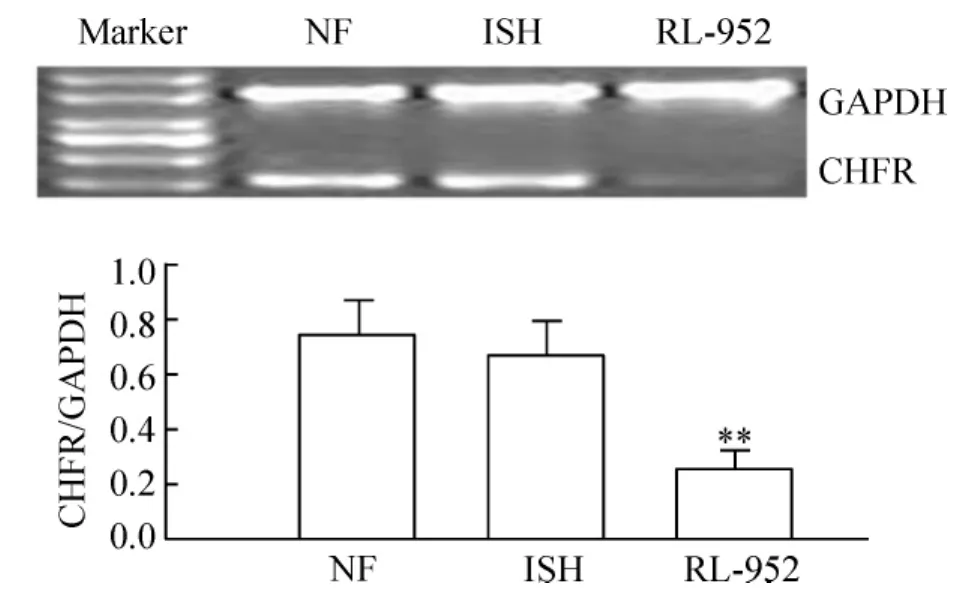
Figure1.Expression level of CHFR mRNA in normal cells and endometrial cancer cells..n=3.**P<0.01 vs NF group.图1 正常细胞和子宫内膜癌细胞中CHFR mRNA的表达水平
2 子宫内膜癌细胞中CHFR的甲基化状态
甲基化特异性PCR检测结果显示,NF、ISH细胞中CHFR没有明显甲基化,而RL-952细胞中CHFR却异常甲基化,见图2。
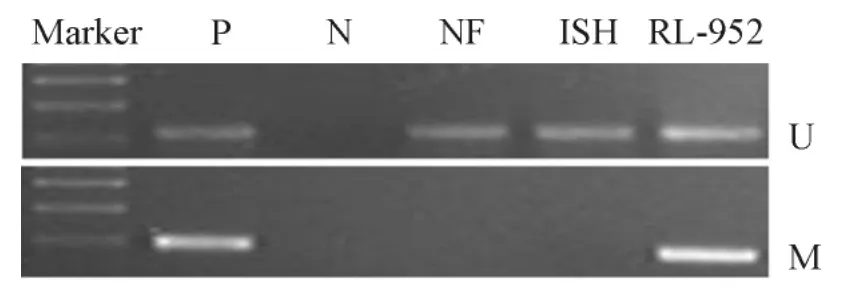
Figure2.Methylation-specific PCR results of CHFR in normal cells and endometrial cancer cells.P:positive control;N:negative control;U:unmethylation;M:methylation.n=3.图2 正常细胞和子宫内膜癌细胞中CHFR基因的甲基化特异性PCR结果
3 去甲基化处理前后CHFR甲基化状态的变化
RL-952细胞中CHFR高甲基化,用5-aza处理后,甲基化条带消失,见图3。

Figure3.CHFR demethylation after treatment with 5-aza in RL-952 cells.M:methylation;U:unmethylation.n=3.图3 5-aza对RL-952细胞CHFR基因去甲基化作用
4 去甲基化处理前后CHFR表达改变
RL-952细胞用5-aza去甲基化处理后,CHFR mRNA的相对表达水平由原来的0.25±0.09增加至0.72±0.21,差异显著(P<0.05)。CHFR蛋白的相对表达水平由原来的0.58±0.13增加至1.38±0.05,差异显著(P <0.01),见图4。
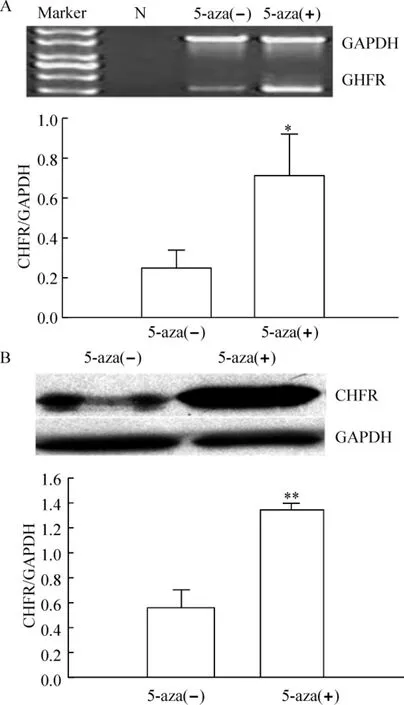
Figure4.Effect of 5-aza treatment on the mRNA(A)and protein(B)expression of CHFR in RL - 952 cells.N:negative control..n=3.*P<0.05,**P<0.01 vs 5-aza(-).图4 5-aza去甲基化作用对RL-952细胞CHFR mRNA和蛋白表达的影响
5 比较去甲基化处理前后RL-952细胞克隆形成能力
未经5-aza处理的对照组RL-952细胞具有较强的克隆形成能力,细胞克隆数较多,体积较大,克隆形成率为(47.23±5.67)%,5-aza处理后的实验组RL-952细胞形成克隆的体积减小,克隆形成率降低为(20.45±2.38)%,差异显著(P<0.01),见图5。

Figure5.Colony-forming efficiency of RL-952 cells treated with 5-aza..n=3.**P<0.01 vs 5-aza(-).图5 5-aza去甲基化作用对RL-952细胞克隆形成的影响
讨 论
CHFR是近年来研究最热的有丝分裂检查点基因之一。当细胞存在有丝分裂应激时,CHFR通路激活延迟染色体凝集和中心体分离,阻滞细胞进入分裂中期从而增强细胞对应激的生存能力。如果CHFR表达降低或缺失,细胞周期即使在发生错误时仍会不停顿地进行下去,引起染色体分离紊乱,导致细胞增殖失控,促进肿瘤的发生[2]。
近年来的研究显示,CHFR在许多正常组织中广泛表达,但在许多肿瘤组织(如胃癌、结肠癌、乳腺癌、食管癌、肺癌、急性白血病等)中有很高的缺失率或明显低表达[7-9]。CHFR在成纤维细胞中正常表达,但在2株子宫内膜癌细胞中,表达均降低,而且在RL-952细胞中表达显著降低。Honda等[10]通过甲基化特异性PCR及RT-PCR把胃癌中CHFR启动子区甲基化状态同其mRNA表达联系起来,结果发现CHFR启动子区甲基化在原发性胃癌(25/71,35%)和细胞株(2/10,10%)中常见,然而在(24/30,80%)的非甲基化肿瘤细胞株中表达。本实验中CHFR弱表达的RL-952细胞中存在CHFR高甲基化,而CHFR高表达的ISH细胞和NF细胞均未见甲基化。这些现象提示肿瘤中CHFR启动子区高甲基化可能是导致基因表达降低或者沉默的主要原因。
启动子甲基化是指在DNA甲基化转移酶(DNA methyltransferases,DNMT)的催化下,以 S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)为甲基供体,将甲基基团转移到胞嘧啶核苷酸嘧啶环第5位碳原子上,生成5-甲基胞嘧啶,并与其3'端的鸟嘌呤形成甲基化的 CpG(methyl- CpG,mCpG)[11]。启动子甲基化是抑癌基因失活常见的机制之一。抑癌基因由于启动子区域CpG岛异常高甲基化从而抑制了mRNA的转录作用,导致该基因的表达降低甚至沉默[12],由此引发的下游事件导致了正常细胞的生长分化调控失常,这与多种肿瘤的形成密切相关[13]。由于启动子甲基化是一个可逆的基因修饰过程,故可针对此靶点使其去甲基化或高甲基化,使抑癌基因恢复表达或沉默,从而达到抑制肿瘤的目的。5-aza是目前常用的去甲基化药物之一。本实验应用5-aza处理高甲基化的RL-952细胞后,CHFR甲基化条带消失,其mRNA和蛋白表达明显增加,再次证实了CHFR甲基化是其表达下降的重要机制。去甲基化治疗可纠正基因的甲基化状态,具有重要的临床应用价值。5-aza已成功应用于临床的一些实例,如治疗骨髓增生异常综合征。
CHFR敲除小鼠模型研究显示[14]:缺乏 CHFR的小鼠有自发癌的倾向,并且用二甲基苯并蒽处理后,该种小鼠的皮肤癌发生率增加。由此说明,该基因抑制肿瘤生长的过程中起着重要作用。本实验中,5-aza去甲基化处理后,随着CHFR基因的表达增加,RL-952细胞的克隆形成率降低。由此说明CHFR基因能抑制RL-952细胞的克隆形成率,提示了CHFR基因可能抑制子宫内膜癌的发生和发展。
肿瘤的早期诊断对于改善预后至关重要,肿瘤相关基因启动子异常甲基化是细胞癌变过程中的一个早期、频发事件,可以作为肿瘤发生的敏感生物标志物。有丝分裂前期检查点CHFR在子宫内膜癌发生过程中由于启动子甲基化导致CHFR表达降低,对细胞周期的正常调控功能失活,从而促进癌症的发生。CHFR可作为子宫内膜癌早期诊断、判断肿瘤治疗和预后的新分子标志物,其具体作用机制尚有待于进一步探讨。
[1]Scolnick DM,Halazonetis TD.Chfr defines a mitotic stress checkpoint that delays entry into metaphase [J].Nature,2000,406(6794):430-435.
[2]Privette LM,Petty EM.CHFR:A novel mitotic check-point protein and regulator of tumorigenesis[J].Transl Oncol,2008,1(2):57 -64.
[3]Whitcomb BP.Gynecologic malignancies[J].Surg Clin North Am,2008,88(2):301-317.
[4]Hiraki M,Kitajima Y,Sato S,et al.Aberrant gene methylation in the lymph nodes provides a possible marker for diagnosing micrometastasis in gastric cancer[J].Ann Surg Oncol,2010,17(4):1177 -1186.
[5]Yanokura M,Banno K,Kawaguchi M,et al.Relationship of aberrant DNA hypermethylation of CHFR with sensitivity to taxanes in endometrial cancer[J].Oncol Rep,2007,17(1):41-48.
[6]Brandesv JC,Engeland MV,Wouters KA,et al.CHFR promoter hypermethylation in colon cancer correlates with the microsatellite instability phenotype[J].Carcinogenesis,2005,26(6):1152 -1156.
[7]Privette LM,Gonzalez ME,Ding L,et al.Altered expression of the early mitotic checkpoint protein,CHFR,in breast cancers:implications for tumor suppression[J].Cancer Res,2007,67(13):6064-6074.
[8]Soutto M,Peng D,Razvi M,et al.Epigenetic and geneticsilencing of CHFR in esophageal adenocarcinomas[J].Cancer,2010,116(17):4033- 4042.
[9]Kang HC,Kim IJ,Jang SG,et al.Coding region polymorphisms in the CHFR mitotic stress checkpoint gene are associated with colorectal cancer risk[J].Cancer Lett,2008,260(1-2):170-179.
[10]Honda T,Tamura G,Waki T,et al.Promoter hypermethylation of the Chfr gene in neoplastic and non-neoplastic gastric epithelia [J].Br J Cancer,2004,90(10):2013-2016.
[11]陶 冶,王 勇.DNA甲基化及其新进展[J].国际妇产科学杂志,2010,37(5):340-343.
[12]Jurkowska RZ,Jeltsch A.Silencing of gene expression by targeted DNA methylation:concepts and approaches[J].Methods Mol Biol,2010,649:149 -161.
[13]范蕊芳,方志刚,刘相富,等.急性白血病患者骨髓细胞中TIMP3、RUNX3蛋白表达情况检测及其临床意义[J].中国病理生理杂志,2010,26(2):293 -296.
[14]Fu Z,Regan K,Zhang L,et al.Deficiencies in Chfr and Mlh1 synergistically enhance tumor susceptibility in mice[J].J Clin Invest,2009,119(9):2714-2724.
