吗啡诱导的CPP复燃大鼠前额叶皮层和海马区EAAT3蛋白表达的变化*
2011-08-02付燕妮何惠燕纪风涛刘付宁曹铭辉
刘 玲,付燕妮,何惠燕,纪风涛,刘付宁,曹铭辉△
(中山大学孙逸仙纪念医院1麻醉科,2消毒供应中心,广东 广州 510120)
戒毒工作已成为一个紧迫的社会问题。在我国“防吸”工作开展普遍,“防复吸”工作却做得相对较少[1]。复吸是指吸毒者在脱毒治疗成功或停止用药一段时间后,由于某些因素的激发,重现觅药欲望而恢复用药的行为,是药物成瘾的主要特征。我国复吸率普遍在90%以上,有的地区甚至高达95%以上。因此加强对阿片类药物复吸机制的研究有重要的社会意义。大量研究证实,中脑腹侧被盖区(ventral tegmental area,VTA)到伏核(nucleus accumbens,NAc)的多巴胺(dopamine,DA)能投射是多种成瘾物质引起奖赏效应的共同通路[2]。但越来越多的研究表示谷氨酸(glutamate,Glu)及 γ-氨基丁酸(γaminobutyric acid,GABA)递质系统可能通过影响VTA-NAc的DA奖赏通路而强化阿片类药物奖赏效应[3-5]。海马及大脑皮层神经元主要的氨基酸转运蛋白,即兴奋性氨基酸转运蛋白3(excitatory amino acid transporter 3,EAAT3),在调控 Glu摄取速度及合成GABA方面发挥重要作用[6-8]。但吗啡复吸过程中前额叶皮层及海马区的EAAT3蛋白表达水平及其调控的 Glu/GABA信号如何变化,目前还不清楚。
条件性位置偏爱(conditioned place preference,CPP)模型是研究药物滥用的常用动物模型。临床上已知诱发药物滥用者戒断后复吸的因素包括小剂量药物暴露、应激、环境线索等。这些因素都可以在动物CPP模型上使消退后的CPP复燃,所以认为CPP建立消退后复燃可以反映阿片类药物成瘾复吸的生物学过程[9]。因此本研究通过建立CPP消退、复燃模型研究吗啡复吸过程中前额叶皮层及海马区EAAT3的蛋白表达变化规律,探讨EAAT3在阿片类药物复吸中可能的调控作用,为进一步防治复吸提供新的作用靶点及方向。
材料和方法
1 动物及主要试剂
40只健康成年SD大鼠,体重200-250 g,由广东省医学实验动物中心提供,实验动物质量合格证编号为SCXK(粤)2008-0002。在中山大学动物中心适应3 d,12 h/12 h光照黑暗交替,自由进食。随机分为5组:对照组(control)、CPP建立(establishment,Es)、消退(extinction,Ex)、复燃 2 h(reinstatement 2 h,Re2)、复燃4 h(reinstatement 4 h,Re4)组,8只/组。主要药物试剂:盐酸吗啡注射液(沈阳第一制药公司,批号为000355);多克隆兔抗EAAT3(1∶1000,Alpha Diagnostic International);HRP标记山羊抗兔 IgGⅡ抗(1∶2000,Amersham)。
2 实验装置
CPP箱,体积为60 cm×30 cm×30 cm,箱内中间有高为35 cm的可抽动隔板,将实验箱分成两个相同体积的长方形箱,一侧箱为黑色,底面粗糙;另一侧箱为白色,底面光滑。在整个实验过程中保持箱内的光线、色调、气味等环境条件的一致。
3 CPP模型的建立、消退及重现
3.1 在CPP建立前期 首先让动物适应3 d:打开过渡箱中通向两侧行为箱的阀门,大鼠在CPP实验装置中自由活动15 min,每天1次,共3 d。第3 d大鼠在两个行为箱中停留的时间作为基础值,其中大鼠非自然偏好的行为箱被为伴药箱,另一行为箱为非伴药箱。
3.2 CPP建立期 关闭过渡箱的阀门,大鼠接受吗啡(10 mg/kg)腹腔注射后放入伴药箱50 min,或者接受相同体积的生理盐水注射后放入非伴药箱50 min,2次注射时间间隔为6 h,每天1次。对照组用生理盐水代替吗啡,其他处理相同。连续训练10 d,训练完成后第2 d进行CPP测试。Control组和Es组大鼠在CPP测试完成后2 h取材。其他3组继续CPP消退及复燃阶段训练。
3.3 CPP消退期 Ex、Re2、Re4组大鼠给予等体积生理盐水,注射后分别交替放入伴药箱和非伴药箱训练50 min,连续训练10 d。在训练完成后第2 d再次打开过渡箱的阀门,记录大鼠15 min内在两个行为箱中停留的时间。Ex组大鼠在CPP测试完成后2 h取材。Re2、Re4组大鼠继续复燃期的训练。
3.4 CPP复燃期 Re2、Re4组大鼠腹腔注射小剂量吗啡(2.5 mg/kg),15min后进行CPP测试。Re2组在测试完成后2 h取材,Re4组在行为学测试完成后4 h取材。
4 Western blotting检测前脑皮层及海马区EAAT3蛋白表达变化
各组大鼠行为学测试完成后,于相应时点断头,取脑,放入冰冷的生理盐水中,去除脑膜和血管,用眼科剪快速分离双侧前额叶皮层,海马组织取材时一侧海马分离总蛋白,一侧海马根据Paxinos等[10]大鼠大脑解剖图谱在横冷切片机上分离CA1区。取出的组织液氮冷冻后超低温冰箱储存待测。以1∶10(即1 μg组织加入10 μL裂解液)的比例加入细胞裂解液和蛋白酶抑制剂,超声下裂解细胞后,在冰上裂解30 min,4℃12000 r/min离心30 min,取上清。BCA法测定样品的蛋白含量,用10%SDS-聚丙酰胺凝胶分离蛋白,30 μg/well样品蛋白100 V电泳。然后将蛋白从聚丙酰胺凝胶转移到NC膜,转膜电压为100 V,时间90 min。5%脱脂奶粉溶液于室温下振荡封闭1 h,多克隆兔抗EAAT3(1∶1000)及单克隆鼠抗β-actin(1∶5000)4度孵育过夜,TBST缓冲液冲洗3次,加标记辣根过氧化物酶标Ⅱ抗,室温孵育1 h,TBST缓冲液冲洗3次,ECL曝光,高敏感X光片显色。用Program Image J(Version 1.35)进行相对灰度值分析。具体方法参考文献[11]。
5 统计学处理
采用SPSS 16.0统计学软件进行统计处理。服从正态分布的计量资料以均数土标准差()表示,组间比较采用多组样本的单因素方差分析,进一步两两比较用LSD法。
结 果
1 吗啡诱导的大鼠CPP模型的建立、消退及复燃
与control组相比,经10 d训练后的Es组大鼠在伴药箱停留时间明显延长(P<0.05),表明CPP模型建立成功。Ex组大鼠继续进行10 d的生理盐水训练后,在伴药箱停留的时间与control组比较无显著差异(P>0.05)。消退训练结束后,以小剂量吗啡(2.5 mg/kg)和伴药箱作为引燃刺激,Re2组大鼠在伴药箱停留时间较control组再次延长(P<0.05),提示CPP复燃模型建立。这种复燃状态在小剂量吗啡诱导4 h后的Re4组仍存在(P<0.05),见图1。
2 吗啡诱导的CPP建立、消退、复燃大鼠前额叶皮质EAAT3的蛋白表达变化
CPP建立时Es组前额叶皮质EAAT3较control组表达减少(P<0.05);CPP消退时Ex组EAAT3蛋白表达回升;Re2组EAAT3表达与control组相比无明显改变(P>0.05);CPP重现4h后Re4组EAAT3蛋白表达又减少(P<0.05),见图2。
3 吗啡诱导的CPP建立、消退、复燃大鼠海马区EAAT3的蛋白表达变化
Es、Ex、Re2、Re4 组大鼠海马的 EAAT3 蛋白表达与control组相比差异无显著(P>0.05),见图3。而Es、Ex组海马CA1区EAAT3蛋白含量比control组明显增加(P<0.05),Re2、Re4组 EAAT3蛋白含量比CPP消退时降低,与control组相比差异无显著(P >0.05),见图4。

Figure1.The time spent on the drug-paired side in rats of CPP establishment,extinction and reinstatement induced by morphine.Es:CPP establishment group;Ex:CPP extinction group;Re2:CPP reinstatement 2 h group;Re4:CPP reinstatement 4 h group..n=8.*P<0.05 vs control group.图1 吗啡诱导的CPP建立、消退、重现大鼠在伴药箱的停留时间
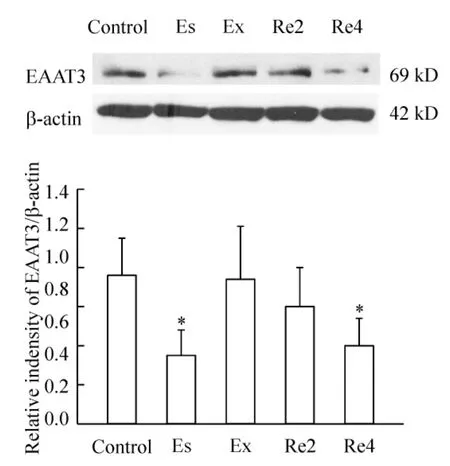
Figure2.Expression of EAAT3 in prefrontal cortex of rats in CPP establishment,extinction and reinstatement groups.Es:CPP establishment group;Ex:CPP extinction group;Re2:CPP reinstatement 2 h group;Re4:CPP reinstatement 4 h group..n=8.*P<0.05 vs control group.图2 各组大鼠前额叶皮层EAAT3蛋白表达变化
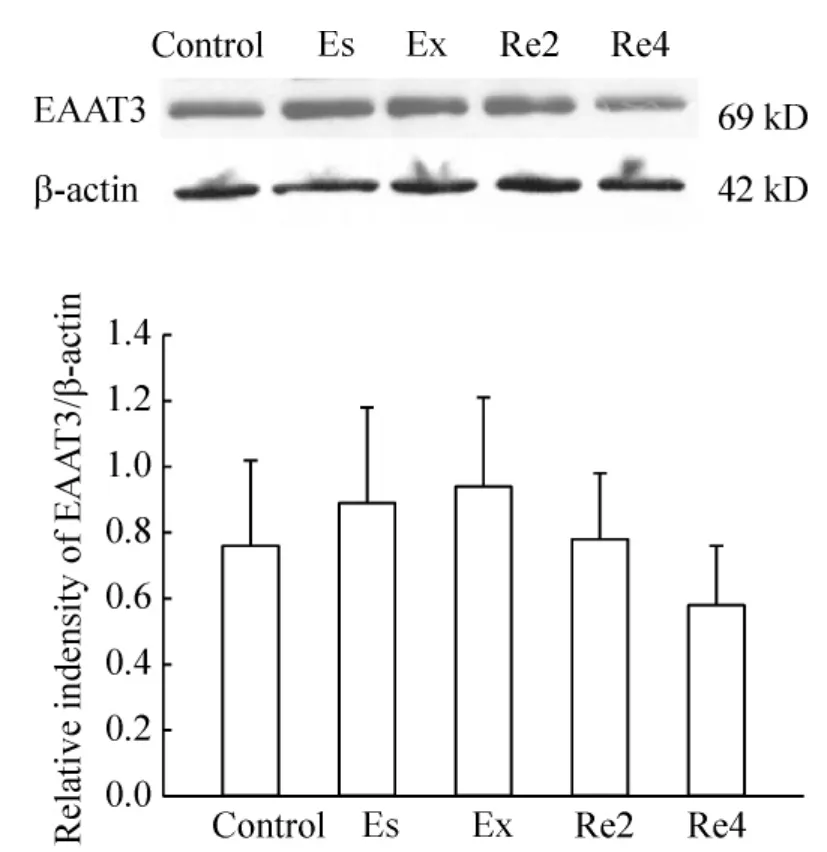
Figure3.The expression changes of EAAT3 in hippocampus of rats in CPP establishment,extinction and reinstatement groups.Es:CPP establishment group;Ex:CPP extinction group;Re2:CPP reinstatement 2h group;Re4:CPP reinstatement 4 h group..n=8.图3 各组大鼠海马区EAAT3蛋白表达变化

Figure4.The expression changes of EAAT3 in hippocampal CA1 area of rats in CPP establishment,extinction and reinstatement groups.Es:CPP establishment group;Ex:CPP extinction group;Re2:CPP reinstatement 2 h group;Re4:CPP reinstatement 4 h group..n=8.*P < 0.05 vs control group.图4 各组大鼠海马CA1区EAAT3蛋白表达变化
讨 论
CPP实验是评价阿片类药物奖赏效应和精神依赖的常用方法,所用吗啡剂量一般在1-10 mg/kg之间,因所用剂量很低,动物一般不会产生明显的生理依赖和戒断症状[12]。CPP建立-消退-复燃模型则常用于动物药物滥用复吸行为的评价[9,12]。我们的研究结果发现吗啡诱导的CPP建立大鼠前额叶皮层EAAT3蛋白表达水平下降;停止给药继续训练10 d后CPP消退,前额叶皮层EAAT3蛋白表达回升;用小剂量吗啡(2.5 mg/kg)诱导CPP复燃4h后,前额叶皮层EAAT3表达水平再次下降,重现CPP时变化趋势。而海马CA1区EAAT3蛋白在CPP建立及消退时表达增加。
Glu是中枢神经系统内主要的兴奋性递质,在阿片类药物的耐受、依赖形成与戒断症状产生过程中起重要的调节作用。GABA是中枢内典型的抑制性神经递质,由GABA能神经元释放后可通过突触后抑制减少下级神经元的兴奋,也可作用于自身受体,产生突触前抑制。根据Glu/GABA比值的变化可以判断脑内神经系统的兴奋或抑制状态。海洛因诱发的复吸模型中发现伏核核心部Glu的含量增加[13],抑制前额叶皮层功能、阻断其向伏核的Glu投射可明显抑制可卡因诱发的觅药行为重现[3]。环境线索诱发的吗啡复吸行为引起腹侧海马下托区细胞外GABA浓度下降[4]。而使用GABA受体激动剂baclofen激动GABAB受体明显减轻吗啡诱导的条件性位置偏爱行为[5]。提示前额叶皮层和海马区Glu/GABA比值升高可能通过影响VTA-NAc的DA奖赏通路而强化阿片类药物复吸行为。
突触间隙的谷氨酸主要由神经元和胶质细胞膜上的兴奋性氨基酸转运体(excitatory amino acid transporters,EAATs)重摄取至胞内[14],EAATs对谷氨酸的转运能力明显影响吗啡依赖症状的形成[15,16]。EAAT3是神经元上主要的氨基酸转运体,在海马及大脑皮层高表达,是海马及大脑皮层主要的谷氨酸转运体之一[12]。研究发现,海马神经元EAAT3由胞质向胞膜的转移可增强神经元摄取Glu的能力,并参与突触长时程增强早期的形成,这种作用不能被胶质细胞主要的氨基酸转运体EAAT2抑制剂所抑制[6,7]。此外,EAAT3 在抑制性 GABA 能神经元中大量分布,突触间隙中的Glu被EAAT3重新摄取进入GABA能神经元时,经谷氨酸脱羧酶催化转化为抑制性的神经递质GABA,从而调节GABA的合成。Sepkuty等[8]的研究显示:反义链下调EAAT3基因表达的小鼠海马神经元中GABA的浓度降低了50%,中间神经元的抑制能力下降,兴奋性神经元的突触传递增强。提示大脑皮层及海马EAAT3在维持Glu/GABA平衡方面发挥重要作用。因此,CPP建立、复燃时前额叶皮层EAAT3蛋白表达水平下降,可能因其调节Glu和GABA的能力减弱,从而导致Glu/GABA比值升高,通过强化阿片类药物的奖赏效应参与吗啡复吸的形成。
而海马根据细胞形态及纤维排列的不同分为CA1、CA3、DG区等多个区域。不同区域功能也不尽相同,生理生化指标变化也常有不同。研究发现,海马CA1区显微注射NMDA受体阻滞剂阻断Glu信号的作用能有效抑制小剂量吗啡诱导的复吸行为[17],提示CA1区可能在吗啡复吸中发挥重要作用。本实验海马总蛋白表达水平虽未见明显改变,但海马CA1区EAAT3在CPP建立及消退时表达增高,可能是对吗啡诱导CPP建立及消退时Glu信号增强的代偿性改变。对海马其他脑区在吗啡复吸中的作用,还需进一步研究。
本研究的结果显示,小剂量吗啡诱导CPP消退复燃大鼠前额叶皮层EAAT3蛋白表达水平降低,推测EAAT3蛋白表达降低可能导致Glu/GABA平衡失调而参与吗啡复吸行为的形成。
[1]张 昱.构建吸毒人员的社区康复社会工作体系-对上海市禁毒工作经验的思考[J].青少年犯罪问题,2008,(1):60 -65.
[2]Wang J,Zhao Z,Liang Q,et al.The nucleus accumbens core has a more important role in resisting reactivation of extinguished conditioned place preference in morphineaddicted rats[J].J Int Med Res,2008,36(4):673 -681.
[3]McFarland K,Lapish CC,Kalivas PW,et al.Prefrontal glutamate release into the core of the nucleus accumbens mediates cocaine-induced reinstatement of drug-seeking behavior[J].J Neurosci,2003,23(8):3531 - 3537.
[4]Kang L,Dai ZZ,Li HH,et al.Environmental cues associated with morphine modulate release of glutamate and γ-aminobutyric acid in ventral subiculum[J].Neurosci Bull,2006,22(5):255 -260.
[5]Kaplan GB,Leite-Morris KA,Joshi M,et al.Baclofen inhibits opiate-induced conditioned place preference and associated induction of Fos in cortical and limbic regions[J].Brain Res,2003,987(1):122 -125.
[6]Pita-Almenar JD,Collado MS,Colbert CM,et al.Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation(LTP)and late LTP[J].J Neurosci,2006,26(41):10461 -10471.
[7]Levenson J,Weeber E,Selcher JC,et al.Long-term potentiation and contextual fear conditioning increase neuronal glutamate uptake[J].Nat Neurosci,2002,5(2):155-161.
[8]Sepkuty JP,Cohen AS,Eccles C,et al.A neuronal glutamate transporter contributes to neurotransmitter GABA synthesis and epilepsy[J].J Neurosci,2002,22(15):6372-6379.
[9]Tzschentke TM.Measuring reward with the conditioned place preference(CPP)paradigm:update of the last decade[J].Addict Biol,2007,12(3 -4):227 - 462.
[10]Paxinos G,Watson C.The rat brain in stereotaxic coordinates[M].1st ed.London:Elsevier Press,1997,99.
[11]曹铭辉,纪风涛,何惠燕,等.急慢性吗啡处理对大鼠大脑皮层tan蛋白和神经微丝磷酸化水平的影响[J].中国病理生理杂志,2010,26(9):1718-1721.
[12]Wang B,Luo F,Zhang WT,et al.Stress or drug priming induces reinstatement of extinguished conditioned place preference[J].Neuroreport,2000,11(12):2781 -2784.
[13]LaLumiere RT,Kalivas PW.Glutamate release in the nucleus accumbens core is necessary for heroin seeking[J].J Neurosci,2008,28(12):3170 - 3177.
[14]Danbolt NC.Glutamate uptake[J].Prog Neurol,2001,65(1):1-105.
[15]Nakagawa T,Fujio M,Ozawa T,et a1.Effect of Ms-153,a glutamate transporter activator,on the conditioned rewarding effects of morphine,methamphetamine mad cocaine in mice[J].Behav Brain Res,2005,156(2):233-239.
[16]Sekiya Y,Nakagawa T,Ozawa T,et al.Facilitation of morphine withdrawal symptoms and morphine-induced conditioned place preference by a glutamate transporter inhibitor DL- threo- β - benzyloxyaspartate in rats[J].Eur J Pharmacol,2004,485(1-3):201-210.
[17]Ma YY,Chu NN,Guo CY,et al.NR2B - containing NMDA receptor is required for morphine-but not stress- induced reinstatement[J].Exp Neurol,2007,203(2):309 - 319.
