轴索损伤在大鼠实验性变态反应性脑脊髓炎不同时期的动态变化及意义*
2011-07-31袁宏宇刘瑞春檀国军吴红然
董 梅,袁宏宇,刘瑞春,郭 力,檀国军,吴红然
(河北医科大学第二医院神经内科,神经病学河北省重点实验室,河北 石家庄 050000)
多发性硬化(multiple sclerosis,MS)是中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病,病因和发病机制尚不明确。其特征性病理特点为不同程度的髓鞘脱失、炎症细胞浸润、星形胶质细胞增生和继发的轴索损伤。近年研究认为在MS患者及其实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis,EAE)动物模型发病早期即有轴索损伤,与炎性破坏有关[1],并发现异常磷酸化tau蛋白与慢性缓解复发EAE和继发进展MS中神经元和轴索缺失相关,导致组织变性,使疾病向慢性阶段进展[2]。我们拟建立EAE大鼠动物模型,用免疫组化方法测定发病早期轴索损伤的标记物β-淀粉样前体蛋白(β-amyloid precursor protein,β-APP)及变性标志物磷酸化tau蛋白的沉积和动态变化,应用改良Bielschowsky轴索染色动态评估轴索缺失,探讨EAE发病中炎症、轴索损伤的动态变化及其与神经功能障碍之间的关系。
材料和方法
1 动物模型的建立及分组
从河北医科大学实验动物中心选购约6~8周龄Wistar大鼠60只[SCXK(冀)2003212003],雌性,体重 180-200 g。用新鲜豚鼠的全脊髓制成匀浆加上完全福氏佐剂(complete Freund's adjuvant,CFA),佐剂中所含卡介苗量为 6 g/L,乳化后按0.5 mL/只分别于大鼠四足垫内及背部皮下注射,免疫动物[3]。实验动物分3组,正常组、急性组和瘫痪组,每组6~8只。
2 神经功能评分
所有实验动物自免疫当日起观察大鼠的精神状态、反应是否灵敏,进食水情况,大小便情况、尾部与肢体力量情况等。参照Kono等提出的标准,将发病程度分为5级:Ⅰ级动物尾部无力;Ⅱ级尾部无力+肢体无力;Ⅲ级肢体轻度麻痹;Ⅳ级肢体严重麻痹,被动翻身后不能复原;Ⅴ级濒死状态。选取发病程度Ⅱ级及其以上,按实验设计取材。
3 标本采集
60只大鼠中正常组取8只,将剩余52只大鼠进行免疫,制备EAE模型,EAE大鼠在免疫后12 d相继出现症状,依据临床表现和发病过程取急性发病3 d大鼠作为急性期组,呈缓解-复发病程、发病2~3次并遗留有肢体瘫痪大鼠作为瘫痪组,取脊髓固定于4%多聚甲醛中,制成蜡块后切片5 μm,观察组织病理及免疫组化改变。
4 组织病理
取各组组织分别进行HE染色,观察炎症和轴索损伤的情况。
5 免疫组化染色
将所取组织分别进行tau蛋白和β-APP免疫组化染色,观察两者在正常组、急性期组和反复发病致残的瘫痪组组织中的分布及表达情况。兔抗大鼠磷酸化tau(pSer202)购于武汉博士的生物工程有限公司,以1∶200比例稀释;兔抗大鼠β-APP抗体以1∶100稀释。Ⅱ抗为生物素标记羊抗兔IgG,Ⅲ抗为辣根酶标记链霉卵白素工作液,按照SP法进行免疫组化染色。PBS为空白对照,结果为阴性。胞浆棕褐色为阳性染色。
6 统计学处理
采用SPSS 13.0统计软件进行统计学分析,数据以均数±标准差()表示,β-APP和tau蛋白阳性细胞数的多组间比较采用单因素方差分析(One-way ANOVA),组间两两比较采用SNK-q检验。取α=0.05作为差异有统计学意义的检验标准。
结 果
1 临床表现及神经功能评分
免疫的52只大鼠中共有40只大鼠发病,发病率为76.8%。大鼠免疫后出现精神萎靡、食欲减退、皮毛不光滑、体重下降,于免疫后第12 d开始发病,出现尾部张力减低、尾部无力,继之迅速出现后肢、四肢无力、麻痹,大小便失禁,少数表现为仅双前肢的无力或瘫痪,无因病情危重而死亡。取发病3 d的急性期组大鼠8只,均在瘫痪高峰期取材,临床神经功能评分为4.13±0.84,剩余32只大鼠中有14只表现为复发-缓解型,发病2~3次,恢复期完全缓解3只,其余11只遗留有不同程度肢体瘫痪,取6只进行实验,神经功能评分为2.50±0.55,均在60 d内取材。临床症状评分急性组和瘫痪组与正常组比较差异显著(P<0.01),瘫痪组与急性组比较差异显著(P<0.01),见表1。
表1 各组神经功能评分比较Table 1.Comparison of neurological scores in each group()

表1 各组神经功能评分比较Table 1.Comparison of neurological scores in each group()
**P <0.01 vs normal group;##P <0.01 vs acute group.
Normal 8 0 Acute 8 4.13 ±0.84**Paralyzed 6 2.50 ±0.55**##
2 组织病理变化
正常组神经组织染色未见异常,急性组大鼠脊髓可见大量炎症细胞浸润,呈大片状,尤以白质及灰白质交界处明显,灰质内也有较多炎症细胞浸润,白质结构疏松;瘫痪组大鼠可见多个“血管袖套”结构,小血管周围有明显炎症细胞浸润,脊髓灰、白质及其交界处多处可见,白质结构松散,呈空泡样改变,见图1。
3 免疫组化结果
3.1 β-APP免疫组化结果 正常组脊髓白质内可见部分神经胶质细胞和少数散在分布的轴索中β-APP呈阳性表达,轴索中β-APP阳性细胞数目是36.80±3.11;急性组在大片状炎细胞分布区内可见部分神经胶质细胞和明显增多的轴索β-APP呈阳性表达,轴索中阳性细胞数目是141.00±7.87,非炎症区域阳性表达明显减轻;瘫痪组也可见部分神经胶质细胞及较多轴索β-APP呈阳性表达,轴索中阳性细胞数目是114.20±12.91,组织内未见炎症细胞浸润。急性组及瘫痪组β-APP阳性细胞数均高于对照组,差异均显著(P<0.01);急性组和瘫痪组阳性细胞数比较差异显著(P<0.01),见图 2、表 2。
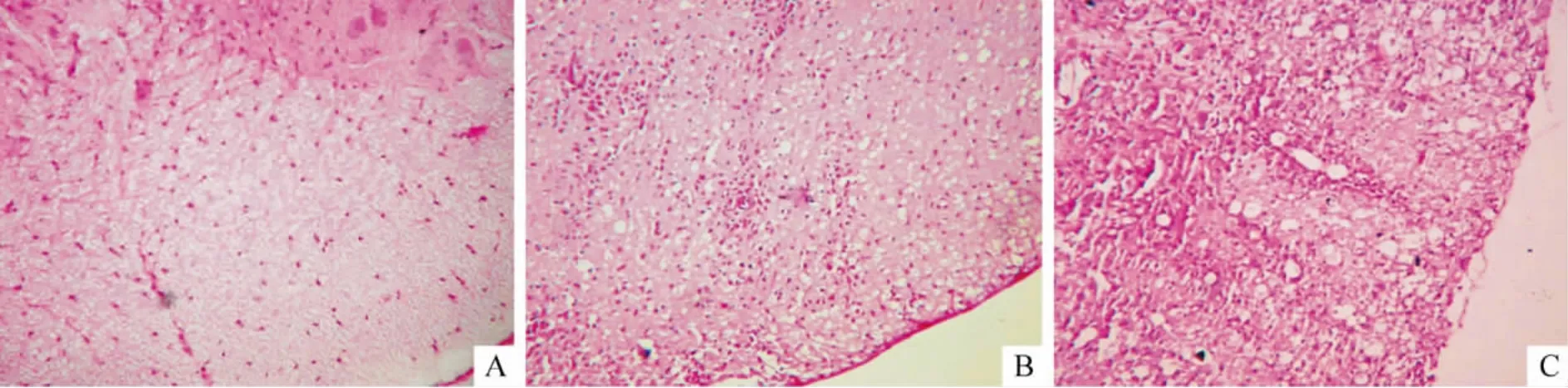
Figure 1.Histopathological changes of rat spinal cord tissues in different groups(HE staining,×200).A:normal group;B:acute group;C:paralyzed group.图1 各组大鼠脊髓组织的病理变化

Figure 2.The expression of β -APP in different groups(immunohistochemical staining,× 400).A:normal group;B:acute group;C:paralyzed group.图2 β-APP在各组大鼠脊髓组织中的表达
表2 各组β-APP和tau蛋白表达比较Table 2.The expression of β-APP and Tau proteins in different groups(.n=5)

表2 各组β-APP和tau蛋白表达比较Table 2.The expression of β-APP and Tau proteins in different groups(.n=5)
**P <0.01 vs normal group;##P <0.01 vs acute group.
Group β-APP Tau Normal 36.80±3.11 7.00±1.58 Acute 141.00 ±7.87** 32.40 ±5.41**Paralyzed 114.20 ±12.91**## 80.20 ±5.89**##
3.2 Tau免疫组化结果 正常组胶质细胞内偶有少量tau蛋白表达,少数轴索呈阳性表达,阳性轴索数为7.00±1.58;急性组在大片状炎症细胞分布区内可见少量轴索内有tau蛋白沉积,呈阳性表达,阳性轴索数为32.40±5.41;瘫痪组可见轴索内大量tau蛋白沉积,阳性轴索数为80.20±5.89,并连接成片状,白质结构破坏,呈空泡样改变,组织内未见炎症细胞浸润,见图2。急性组及瘫痪组tau阳性细胞数均高于对照组,差异均显著(P<0.01);急性组和瘫痪组阳性细胞数比较差异显著(P<0.01),见图3、表2。

Figure 3.The expression of tau protein in different groups(immunohistochemical staining,×200).A:normal group;B:acute group;C:paralyzed group.图3 Tau蛋白在各组大鼠脊髓组织中的表达
讨 论
MS的基本病理改变是炎症、髓鞘脱失、星形胶质细胞增生和轴索损伤,尽管在100多年前就已经发现轴索损伤是MS的病理表现,但它只作为疾病后期伴随髓鞘脱失而发生的继发性改变,直到最近它在疾病发生和发展中的作用才受到重视。有研究表明在疾病的初始及整个病程中都伴有轴索损伤,并与疾病的临床表现密切相关,EAE是MS公认的动物模型,我们通过动态研究不同发病时期EAE大鼠轴索损伤,探讨轴索损伤在EAE发病初始及病情进展过程中的作用和意义。
β-APP是通过轴突快速转运机制运输的一种神经元正常成分,通常表达水平低,可在部分神经元和星形胶质细胞中表达,有促进神经细胞生长分化、增加神经突触的可塑性、参与信号转导、促进细胞黏附及神经保护作用。当脑或脊髓组织发生急性病变时,包括炎症、缺血、外伤等情况,由于β-APP的轴突运输被阻断而出现β-APP的聚集。我们的研究表明在EAE发病急性期,大鼠瘫痪最严重时有大量炎症细胞浸润,弥散分布在组织中,炎症细胞分布区内可见明显增多的β-APP阳性表达,表明炎症可损伤轴索导致β-APP运输阻断而发生聚集;在缓解期瘫痪组大鼠组织内也可见部分β-APP表达,表明在非炎症期也持续存在轴索破坏,轴索损伤呈现不依赖炎症破坏的动态过程。Shriver等[4]研究表明在疾病早期致敏T细胞即炎症攻击可导致轴索可逆性神经功能障碍。在EAE中血管周围巨噬细胞表达iNOS与轴索损伤的短暂神经功能障碍有关,反映了局部可逆的APP的累积[5]。Garay等[6]发现在 EAE 发病后轴索密度下降、呈多空样结构、轴索APP阳性表达。Herrero-Herranz等[7]研究了轴索损伤的形式,病灶中轴索密度在疾病早期已有明显降低,并贯穿整个疾病过程。在灰质、晚发病灶周围及表现正常的脑白质均有明显的轴索缺失。远离病灶的进展性轴索缺失主要与神经丝磷酸化改变、Na通道重新分布和脱髓鞘有关。这种轴索缺失与急性炎症浸润分离,和临床残疾明显相关,提出治疗上在急性期以抗炎、后期以对抗变性机制为主。我们的结果也支持轴索损伤与炎症分离的结果。
Tau蛋白是神经细胞主要的微管相关蛋白,可稳定神经元的细胞支架,然而,高度磷酸化的tau蛋白则扰乱神经元微管、干扰神经元内细胞器的转运,最终导致突触功能的紊乱,神经元功能的削弱与衰退[8]。我们的研究表明正常大鼠脊髓组织内几乎没有tau蛋白沉积,EAE急性组大鼠可见在大片状炎细胞分布区内有少量tau蛋白沉积,表明在急性期炎症可以促使少数损伤严重的轴索发生变性,使代表神经变性的异常磷酸化tau蛋白阳性表达;瘫痪组大鼠可见大量异常tau蛋白沉积,白质结构破坏,但不伴炎症细胞浸润,表明tau蛋白导致的神经变性是随疾病进展逐渐出现的,与神经功能障碍的发生是一致的。Schneider等[9]研究发现在急性EAE脑干中有异常磷酸化的无定形的tau蛋白沉积在脱髓鞘区的神经元胞体和轴索内,提示炎症可以触发tau蛋白异常磷酸化,而轴索损伤与异常tau蛋白有关。Centonze等[10]研究表明炎症引起可溶性炎性因子和兴奋性谷氨酸释放,改变了兴奋性突触传递,在疾病非炎症阶段发生刺激引发继发性神经变性。Soulika等[11]研究提示EAE发病早期的炎症浸润及后期免疫介导的神经变性过程均可导致轴索缺失,发生神经功能障碍。EAE小鼠在出现持续的活动障碍前已有15%~30%脊髓轴索缺失,这种轴索损害可以静止许多年,只有当轴索缺失达到一定阈值后,中枢神经系统失代偿后,发生不可逆的神经功能缺失。我们的结果支持上述学者的研究结果,在疾病早期炎症导致的轴索损伤为可逆性,瘫痪可以恢复,后期轴索发生明显变性,导致大鼠瘫痪,并呈不可逆神经功能障碍。Basso等[12]新近发现fullerene与NMDA受体拮抗剂的复合物ABS-75可以对抗氧化、减轻轴索缺失和髓鞘脱失,具有治疗进展型MS和其它变性疾病的神经保护作用,为MS的治疗提供了新的靶点。
总之,我们的研究表明,在EAE发病过程中轴索损伤呈动态变化,与疾病的严重程度相关,与临床神经功能障碍有关,轴索缺失程度即是否发生明显轴索变性决定了神经功能是否呈永久性损害,在EAE的发病中有重要的作用机制。神经变性主要存在于慢性EAE病程中,发生神经变性的组织病理学特性包括轴索结构破坏、神经元胞体凋亡[13]。所以轴索损伤可以发生在疾病初始,与病灶的炎症、脱髓鞘及临床表现有关,也可以呈隐匿损伤,在临床上数年无表现,直到损伤达到一定程度,造成中枢神经系统中失代偿反应,发展为不可逆的神经功能缺损。
[1]Lim ET,Sellebjerg F,Jensen CV,et al.Acute axonal damage predicts clinical outcome in patients with multiple sclerosis[J].Mult Scler,2005,11(5):532-536.
[2]Anderson JM,Hampton DW,Patani R,et al.Abnormally phosphorylated tau is associated with neuronal and axonal loss in experimental autoimmune encephalomyelitis and multiple sclerosis[J].Brain,2008,131(Pt 7):1736-1748.
[3]Dong M,Liu RC,Guo L,et al.Pathological findings in rats with experimental allergic encephalomyelitis[J].APMIS,2008,116(11):972-984.
[4]Shriver LP,Dittel BN.T-cell-mediated disruption of the neuronal microtubule network:correlation with early reversible axonal dysfunction in acute experimental autoimmune encephalomyelitis[J].Am J Pathol,2006,169(3):999-1011.
[5]Aboul-Enein F,Weiser P,Höftberger R,et al.Transient axonal injury in the absence of demyelination:a correlate of clinical disease in acute experimental autoimmune encephalomyelitis[J].Acta Neuropathol,2006,111(6):539-547.
[6]Garay L,Deniselle MC,Meyer M,et al.Protective effects of progesterone administration on axonal pathology in mice with experimental autoimmune encephalomyelitis[J].Brain Res,2009,1283:177-185.
[7]Herrero-Herranz E,Pardo LA,Gold R,et al.Pattern of axonal injury in murine myelin oligodendrocyte glycoprotein induced experimental autoimmune encephalomyelitis:implications for multiple sclerosis[J].Neurobiol Dis,2008,30(2):162-173.
[8]曹铭辉,纪风涛,何惠燕,等.急、慢性吗啡处理对大鼠大脑皮层tau蛋白和神经微丝磷酸化水平的影响[J].中国病理生理杂志,2010,26(9):1718-1721.
[9]Schneider A,Araujo GW,Trajkovic K,et al.Hyperphosphorylation and aggregation of tau in experimental autoimmune encephalomyelitis[J].J Biol Chem,2004,279(53):55833-55839.
[10]Centonze D,Muzio L,Rossi S,et al.The link between inflammation,synaptic transmission and neurodegeneration in multiple sclerosis[J].Cell Death Differ,2010,17(7):1083-1091.
[11]Soulika AM,Lee E,McCauley E,et al.Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis[J].J Neurosci,2009,29(47):14965-14979.
[12]Basso AS,Frenkel D,Quintana FJ,et al.Reversal of axonal loss and disability in a mouse model of progressive multiple sclerosis[J].J Clin Invest,2008,118(4):1532-1543.
[13]Diem R,Sättler MB,Bähr M.Neurodegeneration andprotection in autoimmune CNS inflammation[J].J Neuroimmunol,2007,184(1-2):27-36.
