LPS诱导胰腺癌细胞Panc-1表达B7-H1*
2011-07-31黄东胜金洪传刘军伟沈国梁
马 君,黄东胜,金洪传,刘军伟,沈国梁,汪 帆
(浙江大学医学院附属邵逸夫医院1普外科,2浙江省生物治疗重点实验室,3生物医学研究中心,浙江 杭州 310016)
胰腺癌是一种极度恶性的消化道肿瘤,具有高度的侵袭性,对放化疗均不敏感,发病率接近于死亡率。目前,根治性手术切除是治疗胰腺癌最有效的手段,但由于早期症状隐匿不易诊断而易丧失手术机会,且肿瘤在早期就易侵犯周围组织并向远处转移,因此预后很差,术后5年生存率仅为8% ~10%[1]。因此,积极探索胰腺癌的治疗方法具有重要的临床意义。近年来肿瘤细胞表面表达的B7-H1分子和 Toll样受体(Toll-like receptors,TLRs)与肿瘤免疫逃逸的关系倍受关注。B7-H1是Dong等[2]从人类基因库搜索B7同源分子时在胎盘cDNA文库中确认的,它编码一个290个氨基酸的I型跨膜蛋白,属于免疫球蛋白超家族成员,表达于静息的T细胞、B细胞、树突状细胞和巨噬细胞上,同时也表达于绝大多数的肿瘤组织中。B7-H1可通过诱导T细胞的凋亡抑制机体对肿瘤的免疫反应,从而参与肿瘤的免疫逃逸过程[3-4]。TLRs是新发现的先天性免疫的病原识别受体,其中TLR4是第一个被发现的哺乳动物TLR,主要配体为革兰阴性杆菌的脂多糖(lipopolysaccharide,LPS),TLR4的活化可激活一系列的信号转导通路,如丝裂原激活的蛋白激酶(mitogen-activated protein kinases,MAPKs)家族,很多研究表明TLR4被活化后可使肿瘤细胞逃避人体的免疫监视[5]。在本实验中我们发现LPS刺激可以上调胰腺癌细胞株Panc-1中B7-H1的表达,进一步的实验证实p38丝裂原活化蛋白激酶(p38 mitogenactivated protein kinase,p38)和细胞外信号调节蛋白激酶(extracellular signal-regulated kinases,ERK)的活化在LPS诱导B7-H1的表达中发挥重要作用。因此,本实验通过探讨B7-H1表达的分子机制,为胰腺癌的治疗提供理论基础。
材料和方法
1 材料
人胰腺癌细胞株Panc-1购自中国科学院细胞库;DMEM培养基、胎牛血清购自Gibco;LPS(E.coli O111∶B4)、SB203580(p38 的抑制剂)、PD98059(ERK的抑制剂)和SP600125[c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)的抑制剂]均购于Sigma;p-ERK、ERK、p-JNK、JNK、p-p38的单克隆抗体和p38的多克隆抗体均购自Cell Signaling;PE标记的抗人TLR4单克隆抗体以及它的同型对照抗体购自eBioscience;鼠抗人B7-H1单克隆抗体购自R&D;Trizol试剂购自Invitrogen;M-MLV逆转录酶购于Promega;SYBR Green I购自TaKaRa;RIPA蛋白裂解液购自上海碧云天公司;B7-H1和GAPDH引物序列由上海Invitrogen合成。
2 方法
2.1 细胞培养 人胰腺癌细胞株 Panc-1用含10%胎牛血清、1%青霉素和链霉素的DMEM培养基,在 37℃、5%CO2的培养箱中常规培养。用0.25%胰酶(含EDTA)消化传代。细胞在培养12h后再加入LPS或是各种抑制剂。
2.2 流式细胞术检测TLR4在人胰腺癌细胞株Panc-1上的表达 将Panc-1细胞以4.0×105/well的密度接种于6孔板中,培养48 h后消化收集细胞。1×磷酸盐缓冲液(phosphate buffered saline,PBS)重悬,调节细胞浓度为1×1010/L,加入5 μL PE标记的CD284抗体(鼠IgG2a抗体作为同型对照),4℃避光孵化30 min。加入2 mL 1×PBS,400 r/min 4℃离心5 min,洗2遍。500 μL 1×PBS重悬细胞后用FACS Calibur流式细胞仪检测,结果用BD CellQuest软件分析。
2.3 实时定量PCR检测Panc-1细胞B7-H1 mRNA的表达 将Panc-1细胞以4.0×105/well的密度接种于6孔板中,共铺3组,培养12 h后分别做如下处理:第1组加入LPS使其终浓度分别为0、0.5、1.0、2.0 mg/L后继续培养4 h;第2组加入终浓度为1.0 mg/L的LPS后分别继续培养0、2、4和8 h;第3组1孔不做任何处理,另1孔加入1.0 mg/L LPS,其余孔分别用20μmol/L SB203580、20 μmol/L PD98059和10 μmol/L SP600125预处理2 h,加入1 mg/L LPS继续培养4 h。消化收集细胞,Trizol法提取总RNA,并用NanoDrop2000C分光光度计测定浓度。取0.5μg总RNA,按照Promega逆转录试剂盒提供的操作步骤制备cDNA。根据TaKaRa荧光定量PCR试剂盒提供的操作步骤,以GAPDH作为内参照,进行real-time PCR反应,所用的引物序列如下:B7-H1上游引物序列5'-GGTGCCGACTACAAGCGAAT-3',下游引物序列 5'-GGTGACTGGATCCACAACCAA-3';GAPDH上游引物序列5'-ACGGATTTGGTCGTATTGGG-3',下游引物序列5'-CCTGGAAGATGGTGATGGGATT-3'。结果用 ABI Prism 7500 real-time PCR System进行分析。每组实验均重复4遍。
2.4 Western blotting检测 Panc-1细胞中 p-p38、p-ERK、p-JNK和 B7-H1的表达 Panc-1细胞以4.0×105/well的密度接种于6孔板中,共接种5组,培养12 h后各组做如下处理:第1组加入LPS使其终浓度分别为 0、0.5、1.0、2.0 mg/L 培养 24 h;第2组以1.0 mg/L LPS分别培养0、12、24和36 h;第3组加入 1.0 mg/L LPS,分别培养 0、15、30、60 和90 min;第4、5组1孔不做任何处理,另1孔加入1.0 mg/L LPS,其余孔分别用 20 μmol/L SB203580、20 μmol/L PD203580和10 μmol/L SP600125预处理2 h,其中第4组加入1.0 mg/L LPS分别继续培养15、30、60 min,而第5组加入1.0 mg/L LPS培养24 h。消化收集细胞,RIPA裂解液提取总蛋白,Bradford法测定蛋白浓度,10%的分离胶分离蛋白后将蛋白转移到硝酸纤维膜上,用特异性的抗体去检测第1、2、5组中B7-H1的表达以及第3、4组中 p-p38、p-ERK和p-JNK的变化,以 GAPDH和总的p38,ERK、JNK作为标准参照。结果用LAS-4000-Mini化学发光成像系统进行分析。
3 统计学处理
结 果
1 LPS诱导Pcnc-1细胞中B7-H1的表达上调
通过LPS刺激Panc-1细胞发现,LPS可以诱导胰腺癌细胞株Panc-1中B7-H1的表达。如图1所示,B7-H1 mRNA表达水平在LPS刺激后明显上调,且呈现一定的浓度依赖性,随着LPS浓度的增加,B7-H1的表达水平也逐渐升高,与对照组相比差异显著(P<0.05),且当LPS浓度为1.0 mg/L时,其表达出现最高峰,见图1A。为了验证 B7-H1 mRNA表达的时间依赖性,我们用1.0 mg/L LPS处理Panc-1细胞不同的时间,结果发现B7-H1 mRNA也呈现明显的时间梯度,随着时间的延长,B7-H1 mRNA的表达水平也逐渐升高,且在4h的时侯其表达水平最高,见图1B。与此同时我们用Western blotting也证实了B7-H1在蛋白水平上的表达也具有相应的浓度和时间依赖性,其在LPS浓度为1.0 mg/L,刺激时间为24 h的时侯表达水平最高,见图1C、D。以上结果表明在胰腺癌细胞中LPS能显著上调B7-H1的表达,并具有一定的浓度和时间依赖性。
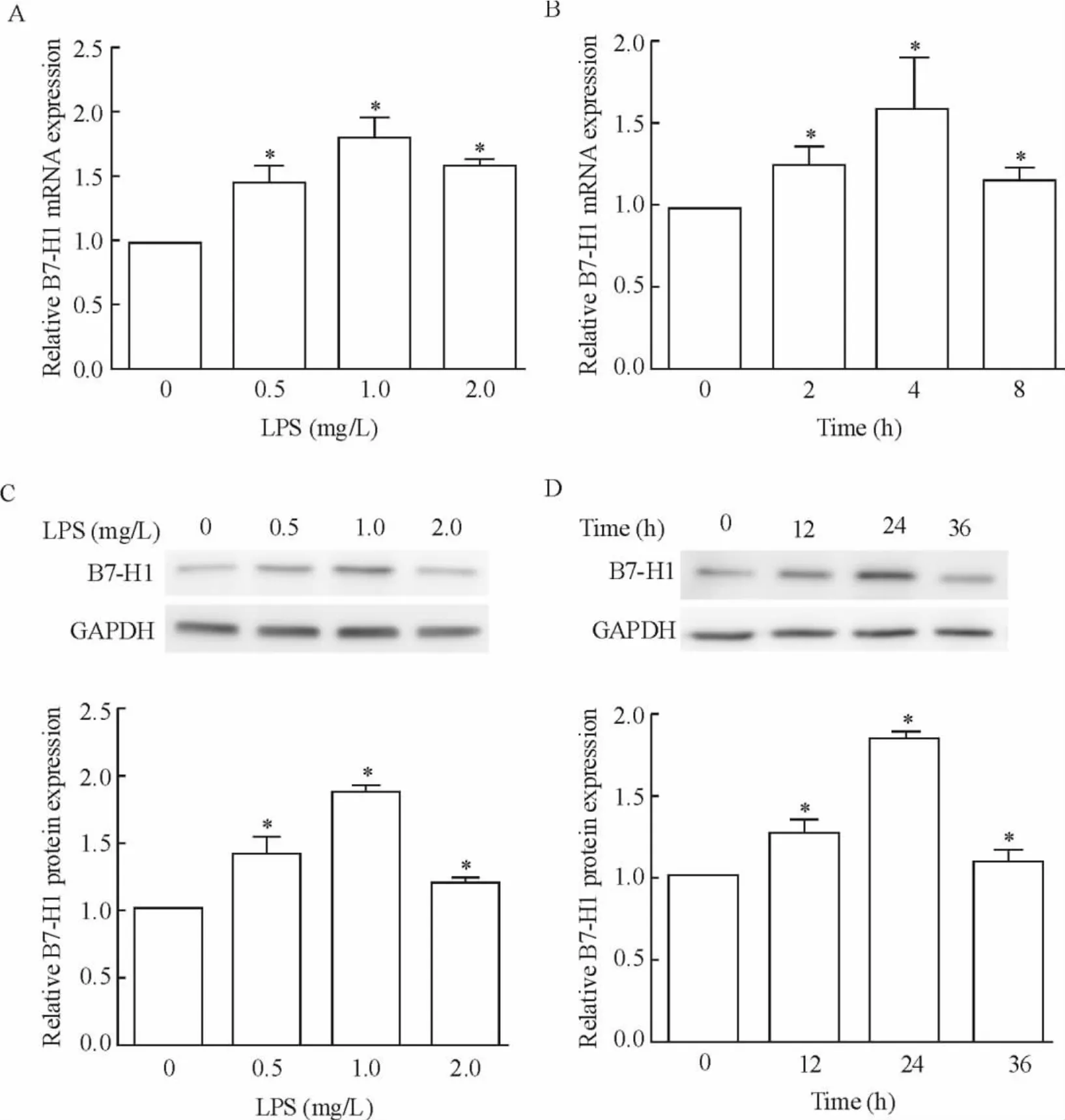
Figure 1.LPS induced up-regulation of the expression of B7-H1 in Panc-1 cells.Dose-dependent(A and C)and time-dependent(B and D)mRNA(A and B)and protein(C and D)expression of B7-H1 was observed in Panc-1 cells following LPS stimulation..n=4.*P<0.05 vs 0 mg/L or 0 h.图1 LPS诱导Panc-1细胞中B7-H1的表达上调
2 LPS刺激后可以活化Panc-1细胞中MAPKs信号通路
结果显示,TLR4表达于Panc-1细胞上,见图2A。LPS刺激后,p-p38、p-ERK和 p-JNK的表达水平随着作用时间的延长而增加,并分别在15、30、60 min时达到最高峰,见图2B-D,这表明在胰腺癌细胞中LPS可以活化MAPKs信号通路。
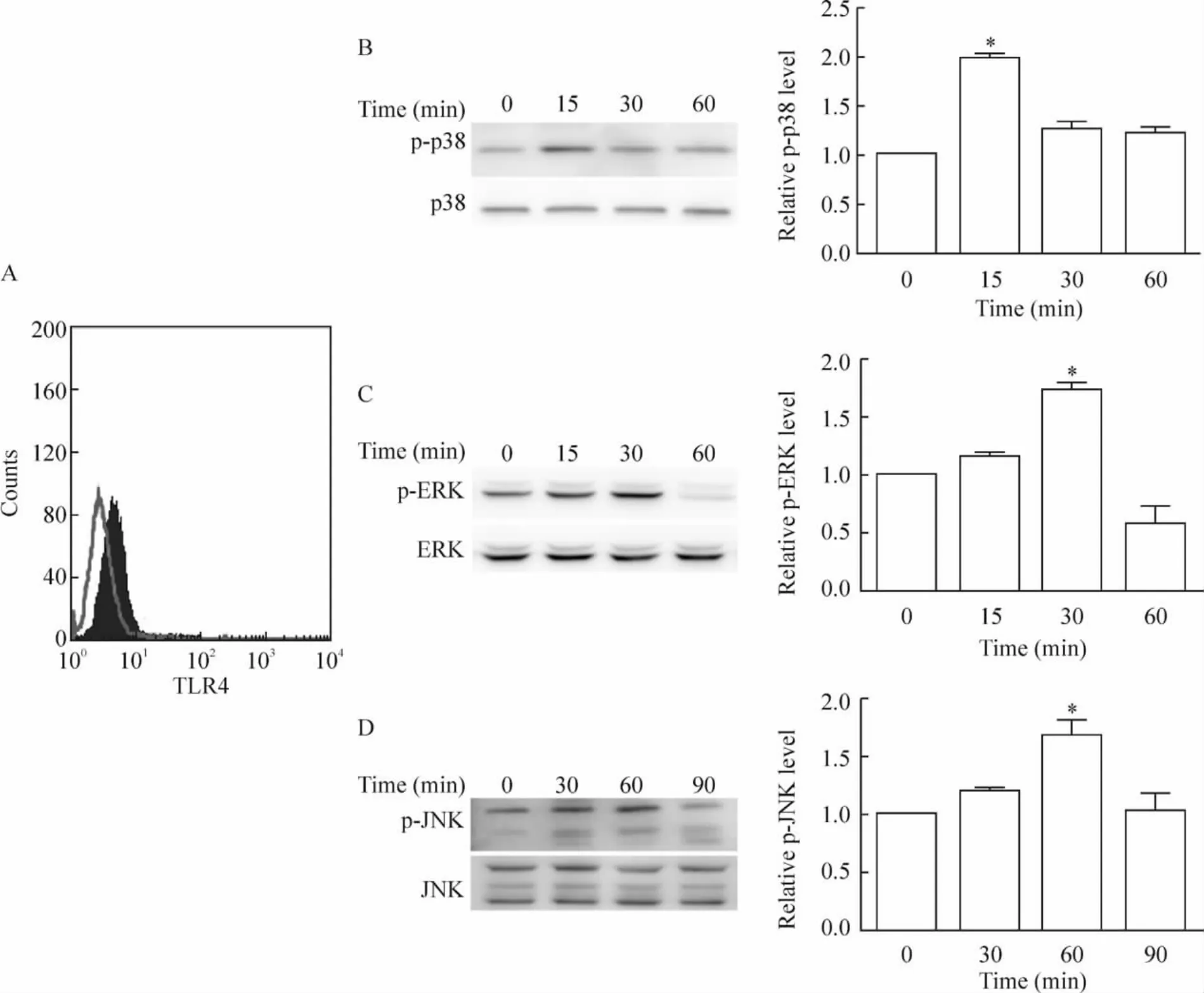
Figure 2.LPS activated MAPKs pathway.A:TLR4 expression on Panc-1 cells,the grey line indicates staining with unrelated isotype-matched control antibody.LPS induced the phosphorlation of p38(B),ERK(C)and JNK(D)..n=4.*P<0.05 vs 0 min.图2 LPS活化MAPKs通路
3 MAPKs信号通路在LPS诱导Panc-1细胞表达B7-H1的过程中起着重要作用
3种抑制剂的抑制效果如图3所示:当SB203580、PD98059和 SP600125的浓度分别为20 μmol/L、20 μmol/L 和 10 μmol/L 时可以显著下调p38、ERK和JNK的磷酸化水平。抑制p38或ERK都能显著下调由LPS诱导的B7-H1的表达(P<0.05);抑制JNK的活化在LPS诱导的B7-H1表达中没有明显作用(P>0.05),见图4。
讨 论
胰腺的原发性肿瘤主要来源于3种组织:胰腺外分泌、内分泌和间叶组织,而在所有的胰腺癌中,导管腺癌占胰腺癌的80% ~90%,因此我们选用来源于导管细胞的人胰腺癌细胞株Panc-1来研究LPS通过活化TLR4-MAPKs信号通路诱导B7-H1表达的分子机制。我们发现LPS刺激Panc-1细胞后可上调B7-H1的表达,且呈一定的浓度和时间相关性。同时我们用p38、ERK及JNK的特异性抑制剂来研究它们磷酸化水平的变化与B7-H1表达水平的关系,我们发现LPS诱导的B7-H1表达可受p38和ERK磷酸化水平变化的调节,而与JNK磷酸化水平的变化没有明显的相关性。
LPS与 TLR4结合后活化 MAPKs信号通路,MAPKs是细胞内的一种丝/苏氨酸蛋白激酶,它受到刺激后磷酸化而活化,近年来许多研究发现MAPKs信号转导途径在肿瘤的分化、侵袭和转移中都起着重要作用,它包括多个亚族,其中p38、ERK和JNK是最主要的3条信号途径[6]。我们的研究表明LPS刺激胰腺癌细胞株Panc-1后,p38、ERK和JNK磷酸化水平呈时间依赖性显著上调。之前已有报道证实干扰素调节因子1(interferon regulatory factor-1,IRF -1)和两面神激酶(Janus kinase,JAK)/信号转导及转录因子(signal transducers and activators of transcription,STAT)通路在干扰素 -γ(interferon-γ,INF-γ)诱导B7-H1的表达过程中起着重要作用[7]。但关于LPS诱导B7-H1表达的机制尚没有相关的研究报道。我们的研究发现,LPS刺激能使p38、ERK和JNK的磷酸化水平都显著升高,但只有p38和ERK的活化与B7-H1的表达具有明显相关性,而JNK的磷酸化水平变化与B7-H1的表达关系不大。进一步研究JNK活化参与的调控机制将很有意义。我们的实验第一次证实了在人胰腺癌细胞株Panc-1上,LPS可能通过活化p38和ERK来调控B7-H1的表达。

Figure 3.Inhibition of LPS-induced phosphorylation with specific inhibitors of MAPKs.A:p38 inhibitor;B:ERK inhibitor;C:JNK inhibitor..n=4.*P<0.05 vs LPS.图3 特异性抑制剂对LPS诱导活化MAPKs通路的影响

Figure 4.p38 and ERK were involved in LPS-induced B7-H1 expression.A-C:mRNA expression;D-F:protein expression.A,D:p38 inhibitor;B,E:ERK inhibitor;C,F:JNK inhibitor..n=4.*P<0.05 vs LPS.图4 p38和ERK对LPS诱导B7-H1 mRNA和蛋白的表达的影响
已有研究发现B7-H1通过诱导T细胞凋亡抑制肿瘤免疫反应促进肿瘤生长。B7-H1阻断可增强单核细胞来源的未成熟树突状细胞(dendritic cells,DCs)的免疫刺激活性,增强淋巴细胞增殖的能力[8]。在胰腺癌小鼠模型中用特异性抗体阻断B7-H1的表达能显著抑制肿瘤的进展,同时上调INF-γ及下调白细胞介素-10(interleukin-10,IL-10)的表达,且与治疗胰腺癌的化疗药物吉西他滨联合使用有协同作用[9]。Gong等[10]证实在胆管上皮中miRNA-513参与了B7-H1的翻译调控。而我们的实验首次在人胰腺癌Panc-1细胞株中证实,p38和ERK可调控B7-H1的表达。至于在人胰腺癌Panc-1细胞株中是否也存在miRNA对B7-H1表达调控目前尚不清楚,LPS的作用能否调控相关miRNA的水平也很值得进一步探索。
近年来研究发现,小鼠结肠癌细胞株(MC26)、乳腺癌细胞株(4T1)、前列腺癌细胞株(RM1)、黑色素瘤细胞株(B16)以及肺癌细胞株(LLC1)表面均表达TLR4。尽管对于在肿瘤上存在何种TLR4配体我们还不是很了解,但近来的研究显示包括LPS在内的如紫杉醇、热休克蛋白60(heat-shock protein 60,HSP60)、HSP70、呼吸道合胞病毒的融合蛋白以及鼠乳腺肿瘤病毒的包膜蛋白均能活化 TLR4[11]。用LPS刺激MC26,发现细胞培养上清液能够显著抑制T细胞的增殖及NK细胞的活化,从而使肿瘤逃避免疫监视,导致肿瘤生长加速。另外,Kelly等[12]发现TLR4表达于人卵巢癌上皮细胞表面,被LPS激活后可诱导细胞增殖和增强细胞因子的产生,他们提出肿瘤细胞可通过TLRs调控肿瘤微环境并影响免疫细胞的活性。B7-H1正是在肿瘤的免疫逃逸过程中发挥着重要作用的分子,另有研究表明在小胶质细胞以及U937细胞(人巨噬细胞系)中,LPS刺激均能使B7-H1的表达上调。这些研究使我们把TLR4的活化和B7-H1的表达联系起来,通过TLR4这一中介进一步去研究胰腺癌细胞中B7-H1表达的调控机制。而我们的研究也恰好证实了我们的猜想。另外,TLR4的活化还可以激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)进行信号转导[13],而对于PI3K信号的激活与B7-H1的表达之间是否存在某种关联尚需要进一步研究。
[1]Kuhlmann KF,de Castro SM,Wesseling JG,et al.Surgical treatment of pancreatic adenocarcinoma:actual survival and prognostic factors in 343 patients[J].Eur J Cancer,2004,40(4):549-558.
[2]Dong H,Zhu G,Tamada K,et al.B7-H1,a third member of the B7 family,co-stimulates T-cell proliferation and interleukin -10 secretion[J].Nat Med,1999,5(12):1365-1369.
[3]Dong H,Strome SE,Salomao DR,et al.Tumor-associated B7-H1 promotes T-cell apoptosis:a potential mechanism of immune evasion[J].Nat Med,2002,8(8):793-800.
[4]吴清松,黄东胜,刘军伟,等.B7H1在胰腺癌panc-1细胞的表达及其功能研究[J].中国病理生理杂志,2010,26(12):2337 -2341.
[5]Huang B,Zhao J,Li HX,et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005,65(12):5009 -5014.
[6]Fecher LA,Amaravadi RK,Flaherty KT.The MAPK pathway in melanoma[J].Curr Opin Oncol,2008,20(2):183-189.
[7]Lee SJ,Jang BC,Lee SW,et al.Interferon regulatory factor-1 is prerequisite to the constitutive expression and IFN-γ-induced upregulation of B7-H1(CD274)[J].FEBS Lett,2006,580(3):755 -762.
[8]李东印,闵 军,褚忠华,等.B7-H1阻断对未成熟树突状细胞免疫功能的影响[J].中国病理生理杂志,2005,21(5):906 -910.
[9]Okudaira K,Hokari R,Tsuzuki Y,et al.Blockade of B7-H1 or B7-DC induces an anti-tumor effect in a mouse pancreatic cancer model[J].Int J Oncol,2009,35(4):741-749.
[10]Gong AY,Zhou R,Hu G,et al.MicroRNA -513 regulates B7-H1 translation and is involved in IFN-γ-induced B7 - H1 expression in cholangiocytes[J].J Immunol,2009,182(3):1325 -1333.
[11]Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783 -801.
[12]Kelly MG,Alvero AB,Chen R,et al.TLR -4 signaling promotes tumor growth and paclitaxel chemoresistance in ovarian cancer[J].Cancer Res,2006,66(7):3859 -3868.
[13]Akira S,Takeda K.Toll- like receptor signalling[J].Nat Rev Immunol,2004,4(7):499 -511.
