靶向MRP1基因的shRNA稳定逆转肺癌的多药耐药性*
2011-07-31邵淑丽崔婷婷贾红双谢振丽张伟伟陈薇薇
邵淑丽,崔婷婷,贾红双,谢振丽,张伟伟,刘 迁,陈薇薇,李 爽,陈 丽
(齐齐哈尔大学生命科学与农林学院,黑龙江 齐齐哈尔 161006)
化疗是肺癌的主要治疗手段之一,而多药耐药是导致肺癌治疗失败的主要原因[1-2]。多药耐药(multidrug resistance,MDR)是指肿瘤细胞对一种抗肿瘤药物出现耐药的同时,对其它结构不同、作用靶位不同的抗肿瘤药物也产生抗药性的现象[3]。肿瘤多药耐药的机制复杂,其中主要涉及细胞外排药物的调控机制。已知相关的转运体(transporter)属ABC(ATP-binding cassette)转运蛋白超家族,ABC转运蛋白超家族是人类最大的转运蛋白基因家族,编码产物是一组跨膜蛋白,即ABC转运蛋白。其超家族又分为7个亚家族(ABCA、ABCB、ABCC、ABCD、ABCE、ABCF、ABCG),包括 49 个基因。其中参与肿瘤多药耐药的主要成员有ABCB1编码的P-糖蛋白、ABCC1编码的多药耐药相关蛋白、ABCG2编码的乳腺癌耐药蛋白。与肿瘤多药耐药相关的主要基因有位于第7号染色体的q21.1区的多药耐药蛋白1(multidrug resisitance protein 1,MDR1)基因、位于染色体16q13.1上的多药耐药相关蛋白1(multidrug resistance-associated protein,MRP1)基因,和位于人染色体4q22上的乳腺癌耐药蛋白(breast cancer resistence protein,BCRP)基因。肺癌多药耐药主要由MRP1基因介导,药物通过谷胱甘肽S转移酶和谷胱甘肽(GSH)结合,由 MRP1转运出胞外[4]。MRP1基因表达增高可导致多药耐药的产生,其编码产物为多药耐药相关蛋白,分子量为190 kD,属于跨膜转运蛋白。RNA干扰(RNA interference)作为一种新的特异性封闭目的基因表达的方法,已成功用于肿瘤基因功能和基因治疗的研究。为了稳定、持久地逆转肺癌细胞的多药耐药性,本研究采用MRP1 shRNA表达质粒载体转染A549/DDP肺癌多药耐药细胞,经G418筛选,有限稀释法挑取单克隆得到阳性单克隆细胞,探讨表达MRP1 shRNA阳性单克隆细胞与亲本A549/DDP多药耐药细胞在多药耐药方面的变化。
材料和方法
1 材料
pSilencer 2.1-U6 neo质粒(北京鼎国生物技术有限责任公司周卫东老师惠赠),敏感的和耐顺铂的肺癌细胞株A549和A549/DDP(北京肿瘤生物学检测中心),RPMI-1640培养基和胎牛血清(上海生工),ECM830型电穿孔仪(BTX),荧光定量RCP仪(Bio-Rad),流式细胞仪(Beckman),LSM710 激光共聚焦显微镜(Zeiss)。
2 方法
2.1 MRP1基因 shRNA表达载体的构建 根据GenBank MRP蛋白编码基因MRP1 cDNA的已知序列(GeneID:4363),选择2个shRNA特异性靶位点序列。设计合成MRP1基因编码shRNA的DNA模板,将其定向克隆到pSilencer 2.1-U6 neo载体上,2个shRNA表达质粒分别命名为pSilencer 2.1-U6 neo MRP1-2.1-1(1214~1234)和 pSilencer 2.1-U6 neo MRP1-2.1-2(1717~1737)。连接产物转化,提取质粒,测序鉴定。
2.2 细胞的培养及转染 细胞均用含0%胎牛血清、1×105U/L青霉素、100 mg/L链霉素的RPMI-1640培养液于37℃、5%CO2饱和湿度培养箱中培养。为了维持A549/DDP细胞株的耐药亚型,培养液中加1.0 mg/L的顺铂。实验前2周换用无顺铂的培养液。取对数生长期的A549/DDP细胞 ,通过pEGFP-N1质粒优化电转染条件,线性化的重组质粒于最佳电转染条件下电转染A549/DDP细胞,用700 mg/L G418筛选而建立稳定表达 siRNA的A549/DDP细胞克隆。有限稀释法挑取单克隆转染细胞分别得到转染单克隆细胞A549/DDP/sh-2.1-1-1和A549/DDP/sh-2.1-2-1。
2.3 实时荧光定量PCR检测MRP1 mRNA 采用UNIQ-10柱式Trizol总RNA抽提试剂盒(Sangon)提取细胞总RNA。MRP1正义链5'-CGCTGAGTTCCTGCGTACC-3',反义链 5'-TCTGCGGTGCTGTTGTGG-3',扩增产物为213 bp。以β-actin为内参照,正义链5'-TGACGTGGACATCCGCAAAG -3',反义链 5'-CTGGAAGGTGGACAGCGAGG-3',扩增产物为 205 bp。实时荧光定量PCR扩增条件:94℃ 4 min,94℃20 s,60 ℃ 30 s,72 ℃ 30 s,循环 35 次,72 ℃ 检测信号,循环结束后进行熔解曲线检测。实验重复3次,数据以 2-ΔΔCt法进行计算。
2.4 免疫荧光检测MRP1蛋白的表达 4%多聚甲醛的磷酸盐缓冲溶液固定实验组细胞15~20 min,用磷酸盐缓冲溶液(PBS)洗2次,加入鼠抗人MRP1单克隆抗体50 μL,室温孵育1 h,PBS洗1次,洗掉未结合的Ⅰ抗。加入荧光标记Ⅱ抗50 μL,避光室温孵育1 h,PBS洗去未结合的荧光Ⅱ抗,碘化丙啶(PI)染色封片,激光共聚焦荧光显微镜下观察,实验重复3次。
2.5 转染后细胞内罗丹明 123(rhodamine 123,Rho123)的潴留量 Rho123是MRP1蛋白的作用底物,当细胞的 MRP1合成减少时,其外排功能降低,Rho123在细胞内的潴留量增加。转染shRNA表达质粒的细胞和对照组细胞分别与0.25 mg/L Rho12337℃孵育1 h,用预冷的 PBS洗3次,以1×109cells/L重悬于预冷的PBS中。流式细胞仪测细胞Rho123荧光强度。
2.6 MTT法检测耐药逆转效果 细胞中分别加入终浓度为 5、10、20、40、80、160、320 μmol/L 顺铂或5 - 氟尿嘧啶,常规四甲基偶氮唑盐比色法(MTT法)于570 nm下测吸光度值(A)。计算细胞存活率=A实验组/A对照组×100%,以药物浓度为横轴、细胞存活率为纵轴绘制浓度效应曲线,求出回归方程,确定半数抑制浓度(IC50)并计算相对逆转率,实验结果重复3次。
3 统计学处理
采用SPSS 17.0统计学软件进行数据处理,行单因素方差分析(One-way ANOVA),组间比较用LSD法,数据以均数±标准差()表示。
结 果
1 MRP1基因shRNA表达载体的鉴定
经测序结果鉴定,重组质粒的碱基序列与预期结果一致,重组质粒构建成功。
2 pEGFP-N1质粒优化电转染条件
电转染时间定为30 ms,分别调节电压为140 V、160 V、180 V、200 V、220 V、240 V 进行电转染条件的摸索。结果显示,电压为180 V时,细胞存活率在40% ~50%之间,有约80%的细胞发绿色荧光,见图1。因此,确定脉冲时间30 ms、电压180 V为电转染A549/DDP细胞的最佳条件。
Figure 1.The expression of green fluorescent protein in A549/DDP cells transfected with pEGFP-N1 plasmid for 48 h(×200).图1 pEGFP-N1质粒转染A549/DDP细胞48 h后绿色荧光蛋白的表达情况
3 荧光定量PCR检测MRP1 mRNA的表达
应用定量PCR仪自带数据分析软件获得Ct计算出各组细胞MRP-1 mRNA表达值,计算各实验组细胞MRP1/β-actin的值。结果表明,重组质粒pSilencer 2.1-U6 neo MRP1-2.1-1-1和pSilencer 2.1-U6 neo MRP1-2.1-2-1可以显著降低A549/DDP细胞内MRP1 mRNA的表达,单克隆细胞A549/DDP/sh-2.1-1-1和A549/DDP/sh-2.1-2-1的MRP1 mRNA/β-actin mRNA比值明显降低,见图2。
4 免疫荧光检测MRP1蛋白表达水平
应用激光共聚焦图像分析与免疫荧光技术对A549、A549/DDP及转染质粒的单克隆细胞MRP1蛋白进行定位定量研究,通过激光共聚焦显微镜对各实验组细胞不同视野下采集荧光强度,各实验细胞采集20组荧光强度数据,每组实验重复3次,根据荧光强度数据绘制MRP1蛋白表达变化规律及蛋白表达水平图。结果表明,转染质粒的单克隆细胞MRP1蛋白相对表达量明显降低,MRP1蛋白位于细胞膜上,见图3。MRP1蛋白表达变化规律及蛋白表达水平见图4、5。

Figure 2.Exppression of MRP1 mRNA..n=3.*P<0.05 vs A549/DDP or vector control.图2 各实验细胞MRP-1 mRNA表达

Figure 3.Immunofluorescent staining for MRP1 protein expression.Green color represents MRP1 and blue color represents nuclei.Scale bar:10 μm.图3 免疫荧光检测实验细胞中MRP1蛋白表达
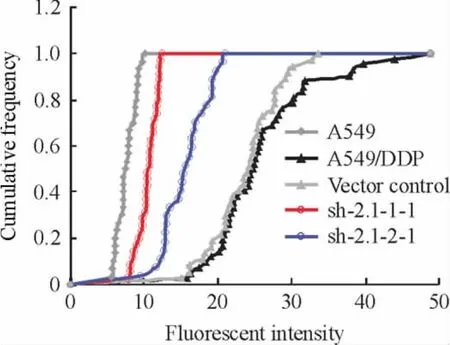
Figure 4.The changes of MRP1 protein expression.图4 MRP1蛋白表达变化规律图

Figure 5.The expression level of MRP1 protein..n=3.*P<0.05,**P <0.01 vs A549/DDP or control.图5 MRP1蛋白表达水平
5 实验细胞内Rho123潴留量的变化
转染单克隆细胞A549/DDP/sh-2.1-1-1和A549/DDP/sh-2.1-2-1细胞内荧光强度明显增加,与耐药细胞株A549/DDP比较,差异显著(P<0.05),见表 1。
表1 各组细胞Rho123的相对荧光强度Table 1.Accumulation of Rho123 in the cells of different groups(%..n=3)

表1 各组细胞Rho123的相对荧光强度Table 1.Accumulation of Rho123 in the cells of different groups(%..n=3)
*P <0.05 vs A549/DDP or vector control.
Group Rho123 retention A549/DDP 16.93 ±0.58 Vector control 18.44 ±0.45 sh-2.1 -1 -1 89.02 ±0.59*sh-2.1 -2 -1 82.56 ±1.37*A549 94.53 ±1.19*
6 多药耐药逆转效果
MTT检测显示,与对照组肺癌亲本细胞相比,稳定表达阳性单克隆细胞A549/DDP/sh-2.1-1-1和A549/DDP/sh-2.1-2-1抗肿瘤药的IC50均显著降低,见表2。
讨 论
RNA干扰因其可以高效、特异地抑制靶基因的表达而迅速成为一种非常有效的在真核细胞中研究基因功能的工具,从而提供了基因敲除之外的另一种选择。RNAi作为沉默基因的新方法已成功地用于肿瘤学的研究,而且siRNAs在极低浓度存在的情况下能特异地封闭mRNA的表达。夏忠胜等[5]应用RNAi技术,设计针对MDR1 mRNA的siRNAs转入人结肠癌细胞中,结果siRNAs可特异抑制MDR1在mRNA和蛋白质水平表达,抗癌药物敏感性增强,实验证实,siRNAs可特异逆转MDR1介导的耐药。同样魏军民等[6]在乳腺癌细胞MCF-7/ADR的研究中得到相似结果。
表2 A549/DDP亲本细胞及其来源的单克隆细胞DDP及5-FU的IC50和相对逆转率Table 2.The IC50and relative reversal rates of A549/DDP cells treated with siRNA for DDP and 5-FU(.n=3)

表2 A549/DDP亲本细胞及其来源的单克隆细胞DDP及5-FU的IC50和相对逆转率Table 2.The IC50and relative reversal rates of A549/DDP cells treated with siRNA for DDP and 5-FU(.n=3)
**P < 0.01 vs A549/DDP or vector control.
Group DDP(μmol/L) 5-FU(μmol/L) DDP reversal rate(%)5-FU reversal rate(%)A549/DDP 101.45 ±0.64 263.20 ±2.00— —Vector control 96.43 ±3.31 247.57 ±5.72 4.97 ±0.12 5.94 ±0.18 sh -2.1 -1 -1 38.06 ±0.05** 98.82 ±1.16** 79.35 ±1.86 78.55 ±0.59 sh -2.1 -2 -1 53.72 ±0.36** 141.81 ±0.49** 59.74 ±0.64 57.93 ±1.80 A549 21.56 ±0.44 53.30 ±2.52— —
本研究采用RNA聚合酶III U6启动子表达siRNA分子,采用此方法表达siRNA分子适合用于进行靶基因的表达受到抑制后细胞表型的长期变化观察,也适于进行文库的筛选。此方法克服了人工合成或体外转录的siRNA分子价格昂贵、基因沉默时间短、转染效果不稳定等问题。本实验根据MRP1基因表达序列设计有效的RNA干扰片段,在体外构建表达并获得 MRP1基因特异的 shRNA质粒表达载体pSilencer 2.1-U6 neo-MRP1,pSilencer 2.1-U6 neo-MRP1表达载体含有U6启动子和抗G418基因,能在细胞转染后用G418进行简便的筛选。本实验应用电穿孔转染将重组表达载体稳定导入A549/DDP细胞内,与其它技术相比更易操作,可以对很广范围的动物细胞发挥作用。
pEGFP-N1质粒含有可编码绿色荧光蛋白基因,转染细胞后,在细胞内发绿色荧光,通过荧光多少可以判断转染效率,采用pEGFP-N1质粒优化电转染条件,其操作简单、快速、直观、准确,可以取得较高的转染率。本研究用Sac I线性化酶将重组载体线性化后转染,有利于重组载体整合到宿主细胞的基因组中,提高了稳定转染的水平。本研究通过G418筛选和有限稀释法挑取单克隆,得到性能专一的单克隆细胞A549/DDP/sh-2.1-1-1和A549/DDP/sh-2.1-2-1,将所得单克隆投于液氮中,2个月后,经复苏传代1个月,实时荧光定量PCR及免疫荧光检测证实其MRP1 mRNA和蛋白的表达仍被稳定抑制,结果显示A549/DDP/sh-2.1-1-1和A549/DDP/sh-2.1-2-1与 A549/DDP细胞相比,MRP1 mRNA表达量分别下降到47.89% ±0.00%和55.03% ±0.81%,转染细胞蛋白表达量分别下降到83.83% ±1.20%和 48.16% ±0.69%。结果说明稳定转染含编码MRP1 siRNA的质粒载体能长期稳定抑制549/DDP肺癌多药耐药细胞MRP1 mRNA和蛋白的表达。单克隆细胞经过长期的冻存和传代培养,多药耐药逆转效果仍较好,可见本实验方法可长期、稳定逆转A549/DDP的多药耐药性,恢复对化疗药物的敏感性。
本研究结果初步证明RNA干扰技术能够稳定、长期地封闭MRP1基因的表达,也为进一步体内的动物实验提供了可能性。
[1]Pan GD,Yang JQ,Yan LN,et al.Reversal of multidrug resistance by pSUPER-shRNA-mdr1 in vivo and in vitro[J].World J Gastroenterol,2009,15(4):431 -440.
[2]Borel F,van Logtenstein R,Koornneef A,et al.In vivo knock-down of multidrug resistance transporters ABCC1 and ABCC2 by AAV-delivered shRNAs and by artificial miRNAs[J].J RNAi Gene Silencing,2011,7:434 - 442.
[3]谭伟欣,黄永明,刘金文.MRP1介导的多药耐药及其逆转剂的研究进展[J].广东医学,2006,27(9):1418 -1420.
[4]Li J,Li ZN,Du YJ,et al.Expresion of MRP1,BCRP,LRP,and ERCC1 in advanced non-small-cell lung cancer:correlation with response to chemotherapy and survival[J].Clin Lung Cancer,2009,10(6):414 - 421.
[5]夏忠胜,朱兆华,陈其奎,等.靶向MDRl基因的RNAi稳定逆转结肠癌细胞的多药耐药性[J].中国病理生理杂志,2009,25(5):898 -903.
[6]魏军民,侯 明,李丽珍,等.短发夹RNA干扰表达质粒逆转人乳腺癌细胞MCF-7/ADR多药耐药的研究[J].山东大学学报,2008,46(4):350-352.
