AMPK激活剂抑制PDGF诱导的大鼠血管平滑肌细胞增殖的机制研究*
2011-07-31童珊珊李钰青佘晓芬
吴 峻,郑 婷,童珊珊,李钰青,佘晓芬,张 萌,肖 云
(广州医学院第一附属医院心内科,广东 广州 510120)
研究表明,各种损伤因子(如血压、血脂等)可促使血管平滑肌细胞(vascular smooth muscle cells,VSMCs)分化、增殖并迁移形成新的内膜,这种增殖效应在动脉硬化、血管成形术后再狭窄发生机制中起着重要作用[1]。血小板源性生长因子(plateletderived growth factor,PDGF)是影响血管内皮的常见炎症因子之一,它有不同的单聚体或多聚体(如PDGF-AA、-BB、-CC等),可通过不同的受体对不同组织产生不同的效应。PDGF在动脉粥样硬化发生机制中的作用除了损伤血管内皮外,也可能通过促进VSMCs增殖来实现,其详尽机制仍在探索中[2,3]。一磷酸腺苷激活的蛋白激酶 (AMP-activated protein kinase,AMPK)是细胞能量代谢的调节因子,还可能参与细胞基因的转录调控,并导致细胞在分裂增殖周期中停滞,从而抑制细胞的增殖[4]。目前有关PDGF和AMPK影响VSMCs的详尽机制尚未明了,本实验通过应用AMPK激活剂5-氨基咪唑-4-甲酰胺核糖核苷(5-aminoimidazole-4 -carboxamide-1-β-D-riboside,AICAR)及 PDGF干预VSMCs,初步观察其作用下VSMCs的增殖变化;并通过检测AMPK活性对哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)表达强度的影响,探讨AMPK活化影响VSMCs增殖的可能途径。
材料和方法
1 试剂
胎牛血清(fetal bovine serum,FBS)(HyClone);DMEM培养基、1×青霉素-链霉素、胰蛋白酶(Gibco);二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)(Sigma);血小板衍生生长因子-BB(platelet-derived growth factor-BB,PDGF-BB)(Peprotech);AICAR(TRC);p-AMPK抗体(CST);p-mTOR抗体(Bioworld);αactin平滑肌细胞检测试剂盒(博士德公司);精准定量DNA marker(Trans);RT-PCR试剂盒(TaKaRa);全蛋白提取试剂盒(凯基公司)。仪器:低温冷冻离心机(Hettich),SM-F123制冰机(Sanyo),恒压恒流电泳仪DYY-III2(北京六一设备厂),低温冰箱(Forma Scientific),VCX750型超声波细胞粉碎机(Sonic),核酸定量仪(Eppendorf),PCR扩增仪(Biometra),Sunrise酶标仪(Tecan),电泳及转膜装置(Bio-Rad),凝胶成像及图像分析系统分析(中国上海天能)。
2 VSMCs的培养
雄性SD大鼠购自广东实验动物中心(粤监证字2008A002),体重200-300 g,戊巴比妥麻醉后引臼处死,无菌状态取出胸主动脉,采用组织块贴壁培养法培养,传代筛选后用α-actin平滑肌细胞检测试剂盒鉴定细胞,所有实验均采用4~6代细胞。
3 细胞增殖检测(MTT法)
取第4代VSMCs以2.5×104接种到96孔板贴壁24 h,饥饿24 h后更换10%胎牛血清的DMEM培养基并加入0.5 mmol/L AICAR,PDGF-BB干预浓度为 10 μg/L,分为:A 组(AICAR)、P 组(PDGF)、A+P组(AICAR+PDGF)和对照组4个组,每组6个复孔,每作用24 h、48 h及72 h前30 min加入MTT 试剂(5 g/L,20 μL),终点时间加入 200 μL DMSO溶解颗粒,酶标仪在570 nm处记录数值,每组5个复孔,实验重复5次。
4 蛋白活性检测(Western blotting)
4.1 p-AMPK表达检测 取第4代VSMCs以4×104接种到50 mm细胞培养皿贴壁24 h,饥饿24 h后更换10%胎牛血清的DMEM培养基并加入AICAR 其终浓度0.5 mmol/L。分别在30 min、1 h、3 h、6 h、12h采用凯基全蛋白提取试剂盒,抽提细胞总蛋白,取20 μg以4% ~12%的十二烷基硫酸钠-聚丙酰胺凝胶(SDS-PAGE,Invitrogen)电泳分离,转膜后,5%BSA的TBST封闭过夜,Ⅰ抗4℃孵育2 h,Ⅱ抗室温1 h,ECL试剂盒显带分析并测灰度值,实验重复3次;另取第4代VSMCs以4×104接种到50 mm细胞培养皿贴壁24 h,饥饿24 h后更换10%胎牛血清的DMEM培养基并按不同组加入AICAR浓度0.5 mmol/L,PDGF -BB 浓度10 μg/L,分为:A 组(AICAR)、P组(PDGF)、A+P 组(AICAR+PDGF)和对照组4个组,每组6个复孔,在12 h采用凯基全蛋白提取试剂盒抽提细胞总蛋白,按上述同法处理后检测各组灰度值,实验重复3次。
4.2 p-mTOR表达检测 取第4代VSMCs以4×104种到50 mm细胞培养皿贴壁24 h,饥饿24 h后更换10%胎牛血清的DMEM培养基并加入AICAR其终浓度 0.5 mmol/L。分别在 30 min、1 h、2h、6 h、12 h抽提细胞总蛋白,取20 μg以4% ~12%的SDS-PAGE电泳,进行分析并测灰度值,实验重复3次;另取第4代VSMCs以4×104接种到50 mm细胞培养皿贴壁24 h,饥饿24 h后更换10%胎牛血清的DMEM培养基并按不同组加入AICAR浓度0.5 mmol/L,PDGF -BB 浓度 10 μg/L,分为:A 组(AICAR)、P 组(PDGF)、A+P组(AICAR+PDGF)和对照组4个组,每组6个复孔,12 h采用凯基全蛋白提取试剂盒抽提细胞总蛋白,按上述同法处理后检测各组灰度值,实验重复3次。
5 统计学处理
结 果
1 VSMCs的培养及鉴定
光镜下可见,传代培养的第4代细胞呈长梭形,及典型的“峰-谷”样生长,经免疫组化染色后,可见胞浆内阳性着色的丝状 α-actin分布,确认为VSMCs,见图 1、2。
Figure 1.The growth of VSMCs(×200)VSMCs at the 4th passage showed peak-valley-like growth.图1 平滑肌细胞生长情况
Figure 2.Confirmation of VSMCs(×400).Positive-stained filamentous α - actin in the cytoplasm was obsered.图2 平滑肌细胞染色确认
2 PDGF及AICAR在不同时点对VSMCs增殖的影响
PDGF 干预24 h、48 h、72 h 后,明显促进 VSMCs的MTT值升高(P<0.05);AICAR在不同时点均可以使VSMCs的MTT值显著下降(P<0.05),见表1。
表1 PDGF及AICAR作用不同时间对细胞MTT值的影响Table 1.Effects of PDGF and AICAR on MTT value at different time points(.n=5)
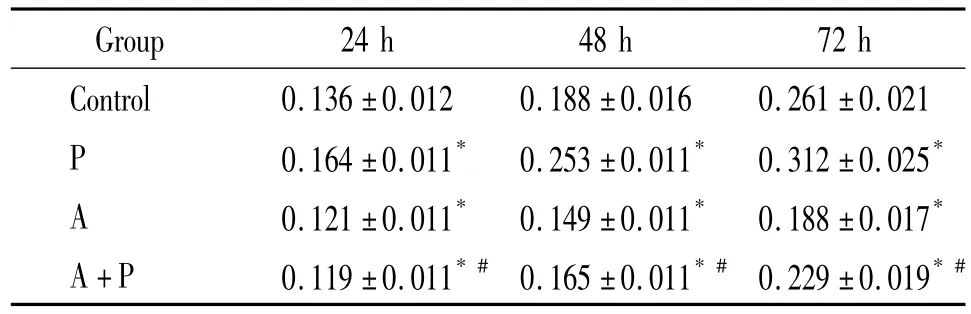
表1 PDGF及AICAR作用不同时间对细胞MTT值的影响Table 1.Effects of PDGF and AICAR on MTT value at different time points(.n=5)
*P<0.05 vs control;#P<0.05 vs group P.P:PDGF;A:AICAR;A+P:AICAR+PDGF.
Group 24 h 48 h 72 h Control 0.136 ±0.012 0.188 ±0.016 0.261 ±0.0210.164 ±0.011* 0.253 ±0.011* 0.312 ±0.025*A 0.121 ±0.011* 0.149 ±0.011* 0.188 ±0.017*A+P 0.119 ±0.011*# 0.165 ±0.011*# 0.229 ±0.019*#P
3 AICAR对细胞AMPK的激活作用
AICAR干预细胞,分别在不同时点检测到p-AMPK的表达,经灰度分析显示AMPK的激活随药物干预时间增加而逐渐增强,见图3。
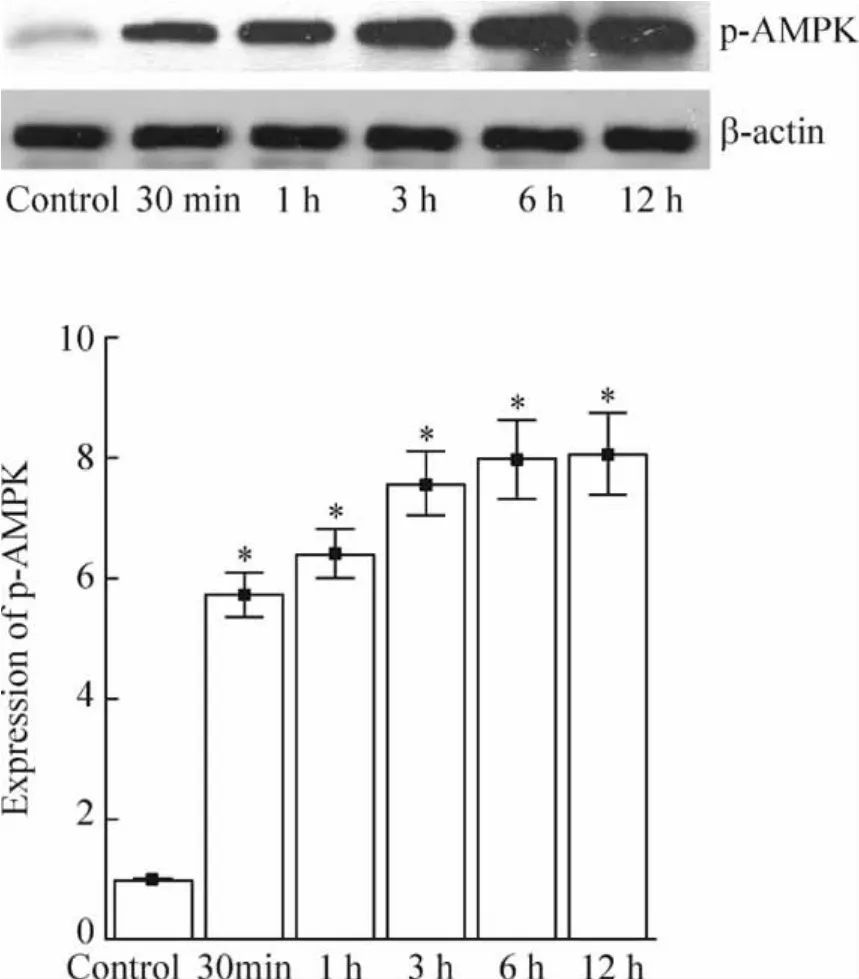
Figure 3.Expression of p-AMPK at different time points(Western blotting)..n=3.*P<0.05 vs control.图3 不同时点p-AMPK的表达
4 PDGF、AICAR及两者联合作用对细胞 p-AMPK的影响
各组干预细胞12 h后分别检测p-AMPK的表达。与对照组比较,P组灰度值降低、A+P及A组均升高,A+P组高于P组,见图4。
5 AICAR对磷酸化mTOR(p-mTOR)蛋白表达的影响
对照组细胞可见p-mTOR强表达,AICAR干预后p-mTOR表达活性减弱,随着药物干预时间延长,p-mTOR表达减弱更加明显,见图5。

Figure 4.Expression of p-AMPK at different groups(Western blotting)..n=3.**P<0.01 vs control;##P<0.01 vs group P.P:PDGF;A:AICAR;A+P:AICAR+PDGF.图4 p-AMPK在不同干预组的表达
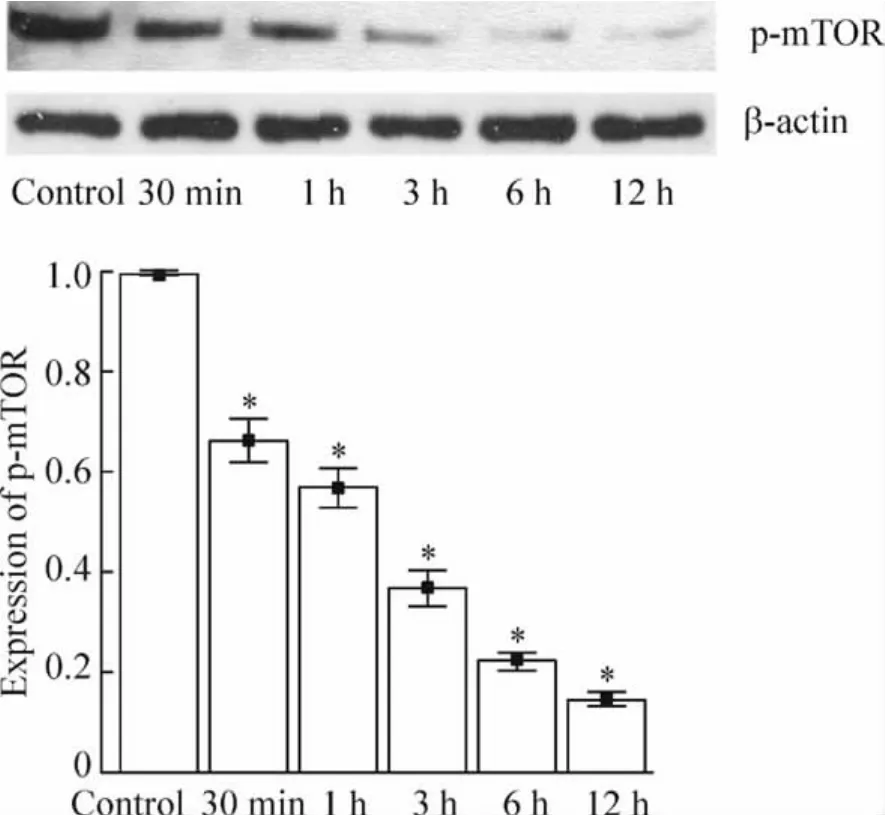
Figure 5.Expression of p-mTOR in different time points(Western blotting)..n=3.*P<0.05 vs control.图5 p-mTOR蛋白在不同时点的表达
6 PDGF、AICAR及两者联合作用对磷酸化mTOR的影响
各组干预细胞12 h后分别检测p-mTOR的 表达。与对照组比较,P组灰度值增高、A+P及A组均降低,A+P组低于P组,见图6。

Figure 6.Expression of p-mTOR in different groups(Western blotting)..n=3.*P<0.05 vs control;#P<0.05 vs group P.P:PDGF;A:AICAR;A+P:AICAR+PDGF.图6 p-mTOR蛋白在不同干预组的表达
讨 论
在动脉粥样硬化的发生、发展过程中,以及冠状动脉介入治疗后都会出现血管增殖性改变,严重威胁着治疗的进展和疾病的预后,在这一环节中,血管中层平滑肌细胞是否进入周期性的增殖状态起着关键的作用。在正常血管壁完整的情况下,血管壁中层平滑肌细胞处于G0期的稳定状态,只有在一些刺激因素的作用下(如球囊损伤、PDGF的刺激),才会触发其增殖[5]。血管平滑肌细胞的异常增殖成为冠心病急性事件的独立危险因素,探讨其增殖及抑制途径对于防治急性冠脉事件的发生具有重要意义。
AMPK是一个苏氨酸激酶,被认为是所有真核细胞的能量感受器,激活的AMPK对肿瘤细胞的生长有强烈抑制作用,其效应主要通过抑制细胞周期、胞内蛋白质合成以及体内脂肪酸和胆固醇的合成过程来实现。本研究显示,AMPK的激活对血管平滑肌细胞的增殖亦起着显著的抑制作用(P<0.05)。
AICAR是被广泛认可的AMPK激活剂,可能是今后治疗缺血性心脏病很有潜力的药物[6],AICAR通过腺苷载体转运到细胞内,在腺苷激酶的作用下被磷酸化形成5’-AMP类似物(zeatin riboside-5’-monophosphate,ZMP),ZMP 具有 AMP 的类似结构,它可以与γ亚基上的CBS序列结合,引起AMPK的构象改变,同时保护抑制Thr172位点的去磷酸化,在磷酸化的作用下,使AMPK激活[7]。研究发现,在大鼠股动脉的导丝损伤模型中,如果给予AICAR使AMPK能够持续的激活,血管损伤处新内膜的形成可受到明显抑制,内皮下平滑肌细胞的增殖也被明显抑制[8]。本实验结果显示,在AICAR作用下p-AMPK的表达强度随时间变化而逐渐增强,在12 h时达到最高值;PDGF干预后分别检测p-AMPK,PDGF能抑制对照组AMPK的表达,但AICAR激活作用下PDGF抑制AMPK表达的效应明显减弱,同时,检测 MTT值提示:AMPK的激活还可能抑制PDGF诱导的VSMCs增殖效应(P<0.05)。其机制尚未明了,可能与促进p53的表达上调和磷酸化,使血管平滑肌细胞增殖周期停滞在G1/S阶段有关,其抑制增殖的效应主要是通过抑制MAP激酶信号系统实现的[9]。
实验结果显示,AMPK激活后,p-mTOR的表达受到明显抑制,在AMPK激活12 h后,其表达几乎受到完全抑制,已知PDGF能诱导VSMCs增殖效应,PDGF干预后检测p-mTOR的 表达明显增强,但AICAR加PDGF联合干预后p-mTOR的 表达低于PDGF单独诱导组,即PDGF对mTOR活性的上调效应被AICAR抑制,进一步提示AMPK激活后的抑制增殖效应可能还与mTOR活性的下调有关,这中间可能同样存在AMPK/mTOR信号途径影响VSMCs的增殖。mTOR是细胞内多种重要信号转导通路的枢纽,调控翻译起始、转录、蛋白合成和降解功能,进而调节细胞的生存、增殖和凋亡等细胞重要生理功能,LKB1/AMPK/mTOR信号通路是其中较经典的信号通路之一,当细胞内AMP/ATP比值增高时,AMP与AMPK亚单位结合引起构象的改变,然后LKB1与AMPK的α亚单位结合引起AMPK磷酸化而激活[10],激活的AMPK通过使结节性硬化复合体2(tuberous sclerosis complex 2,TSC2)磷酸化来阻断mTOR的活化[11]。AMPK对 VSMCs的增殖抑制机制可能与mTOR下游的2个重要靶蛋白有关,即核糖体p70S6激酶(S6K1)和4E-BP1,两者均参与蛋白翻译的关键环节[12]。
综上所述,实验结果显示PDGF对VSMCs有促增殖效应,AICAR干预后可激活AMPK,并显著抑制PDGF诱导的VSMCs增殖,细胞mTOR活性的下调可能参与了VSMCs的抑增殖效应。
[1]Ross R.Atherosclerosis:an inflammatory disease[J].N Engl J Med,1999,340(2):115 -126.
[2]Vantler M,Karikkineth BC,Naito H,et al.PDGF - BB protects cardiomyocytes from apoptosis and improves contractile function of engineered heart tissue[J].J Mol Cell Cardiol,2010,48(6):1316 -1323.
[3]高 蕊,董丽华,谢肖立,等.PDGF-BB对血管平滑肌细胞表型标志物表达的影响[J].中国病理生理杂志,2010,26(12):2301 -2305.
[4]Son BK,Akishita M,Iijima K,et al.Adiponectin antagonizes stimulatory effect of tumor necrosis factor-α on vascular smooth muscle cell calcification:regulation of growth arrest-specific gene 6-mediated survival pathway by adenosine 5'-monophosphate-activated protein kinase[J].Endocrinology,2008,149(4):1646 -1653.
[5]Igata M,Motoshima H,Tsuruzoe K,et al.Adenosine monophosphate-activated protein kinase suppresses vascular smooth muscle cell proliferation through the inhibition of cell cycle progression[J].Circ Res,2005,97(8):837-844.
[6]Drew BG,Kingwell BA.Acadesine,an adenosine-regulating agent with the potential for widespread indications[J].Expert Opin Pharmacother,2008,9(12):2137 -2144.
[7]Grana X,Reddy EP.Cell cycle control in mammalian cells:role of cyclins,cyclin dependent kinases(CDKs),growth suppressor genes and cyclin-dependent kinase inhibitors(CKIs)[J].Oncogene,1995,11(2):211 -219.
[8]Nagata D,Takeda R,Sata M,et al.AMP-activated protein kinase inhibits angiotensin II-stimulated vascular smooth muscle cell proliferation[J].Circulation,2004,110(4):444-451.
[9]Kim JE,Choi HC.Losartan inhibits vascular smooth muscle cell proliferation through activation of AMP-activated protein kinase[J].Korean J Physiol Pharmacol,2010,14(5):299-304.
[10]Chiang PC,Lin SC,Pan SL,et al.Antroquinonol displays anticancer potential against human hepatocellular carcinoma cells:a crucial role of AMPK and mTOR pathways[J].Biochem Pharmacol,2010,79(2):162 -171.
[11]Cantrell LA,Zhou C,Mendivil A,et al.Metformin is a potent inhibitor of endometrial cancer cell proliferation:implications for a novel treatment strategy[J].Gynecol Oncol,2010,116(1):92 -98.
[12]Li X,Alafuzof I,Soininen H,et al.Levels of mTOR and its downstream targets 4E - BP1,eEF2,and eEF2 kinase in relationships with tau in Alzheimer's disease brain[J].FEBS J,2005,272(16):4211 -4220.
