茯苓菌丝体多糖径向流色谱分离参数优化
2011-07-30魏海龙甘庆军胡传久吴学谦程俊文李海波付立忠
魏海龙,贺 亮,2*,甘庆军,胡传久,2,吴学谦,2,程俊文,2,李海波,付立忠,2
(1. 浙江省林业科学研究院,浙江省森林资源生物与化学利用重点实验室,浙江 杭州 310023;2. 丽水市食用菌研究开发中心,浙江 丽水 323000;3. 庆元县食用菌科研中心,浙江 庆元 323800)
茯苓来源于多孔菌科真菌茯苓(Poria cocos)的菌核,具有利尿、镇静、抗肿瘤、增强免疫等药效,属药食两用的大宗药材[1],目前茯苓全国年需用量达17000 t左右。近年已报道,茯苓中提取的茯苓多糖或茯苓异多糖具有促进细胞分裂、补体激活、抗诱变、抗肿瘤、抗癌、增强免疫性等生物活性[2]。Narui等报道从茯苓菌丝体中分离出的多糖与天然菌核中的多糖结构几乎相同,主要为β-(1→3)-D-葡聚糖,带少量支链[3]。用液体发酵培养及分离提取等新技术来生产茯苓,可连续地、大规模地进行工业化生产,大大缩短生产时间,并可节省大量的木材,对我国资源和生物多样性的保护有着重要的意义。茯苓的液体发酵正逐渐成为研究的热点。发酵茯苓菌丝体与野生或人工种植的天然茯苓(干燥菌核)所含活性成分有所差别,因此,应将茯苓发酵菌丝体视为一种新型的发酵中药。多糖是茯苓的主要活性成分,本文以发酵茯苓菌丝体和天然茯苓为材料,探讨了茯苓多糖的提取分离工艺,并分别对二者总多糖的提取率及总糖的平均含量进行了测定,为茯苓相关保健食品和药品的开发打下基础[4]。
色谱分离技术已成为最主要最有效的分离纯化技术之一。在传统的轴向色谱分离过程中,随着色谱柱直径或柱长的增加,原来的色谱优化条件往往不适宜,特别是进一步放大较高倍数时,结果更不能令人满意[5]。对于大规模生物样品的制备,迫切需要发展新型色谱技术。径向流色谱法是近十年来发展起来的一种新型色偶分离技术,其独特的径向流动设计,可提高流速,降低柱压,便于线性放大,在血液制品、基因工程产品、生物药品和农产品等的分离纯化中已得到广泛应用[6]。
本文针对茯苓菌丝体的物料特性,采用径向色谱分离技术,对茯苓菌丝体多糖进行快速分离,通过考察影响其分离效率的因素样品浓度、上样量、上样流速、洗脱流速等,确定主要影响因子,同时结合响应面工艺优化法,把正交实验设计和回归分析有机的结合在一起,它可以在因素的试验范围内选择适当的试验点,用较少的试验建立一个精度高、统计性质好的回归方程,通过解回归方程可求得茯苓菌丝体多糖分离最佳工艺条件,从而为茯苓菌丝体多糖的快速分离提供了工业化的前景。
1 材料和方法
1.1 材料与仪器
茯苓菌丝体粗多糖由浙江益圣发展有限公司提供;DEAE-Sepharose FF,购自 sigma公司;Superflo-50mL径向色谱分离柱购自美国sephagen公司;Tris,葡萄糖、苯酚、硫酸、95%乙醇、无水乙醇、丙酮、乙醚均为分析纯,购自国药集团化学试剂有限公司。
台式离心机,thermo fisher公司;数显恒温水浴锅HH-6,国华电器有限公司;旋转蒸发器RE-52AA,上海亚荣生化仪器厂;UV-9100紫外可见分光光度计,北京瑞利分析仪器公司;BS224S电子天平,北京赛多利斯仪器系统有限公司;pHS-3C精密pH计,上海雷磁仪器厂。
1.2 方法
1.2.1 多糖含量的测定 采用苯酚—硫酸法测定多糖含量[7]。
标准葡萄糖溶液:准确称取0.1 g经过105℃干燥至恒质量的葡萄糖(AR),加水溶解后以水稀释至100 mL,此溶液1 mL含1 mg葡萄糖,用时从中吸取10 mL,用蒸馏水定容至250 mL,这时葡萄糖标准溶液的浓度记为C(约40 μg/mL左右)。
精密移取葡萄糖标准溶液0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL,各以水补至2.0 mL,用旋涡混匀器振匀,然后加入6%苯酚1.0 mL,用旋涡混匀器振匀,再加5 mL浓硫酸,迅速振匀。室温放置5 min,然后在沸水浴中保温15 min,用自来水冷却5 min,再用旋涡混匀器振匀,于490 nm测光密度,以2.0 mL水按同样显色操作作为空白,以葡萄糖溶液浓度(μg/mL)为横坐标,以吸光度(Abs)为纵坐标,得标准曲线。
样品含量测定:吸取样品液1.0 mL,按上述步骤操作,测定OD值,以标准曲线回归方程Y= 0.0166X+0.01计算多糖含量。其中X为葡萄糖浓度(μg/mL),Y为吸光值A,R2= 0.9947,说明线性关系良好。
1.2.2 茯苓菌丝体多糖的径向流色谱分离 填料的灌装:先将50 mL蒸馏水以25 mL/min流速冲入Superflo-50 mL径向色谱柱,再将50 mL脱气处理后的DEAE-Sepharose FF填料以5 mL/min用蠕动泵输入到Superflo-50 mL径向色谱分离柱内,然后将径向柱颠倒,用蒸馏水以10 mL/min流速冲填料,最后再用蒸馏水以20 mL/min流速正反平衡填料,直到填料装填均匀。取适量称质量后的多糖样品溶于蒸馏水中,以优化的流速上样,然后用蒸馏水按一定的流速洗脱,直至最后的洗脱液在490 nm处基本无吸收峰。将所得多糖分离液用去离子水透析,冷冻干燥机冻干称质量。待整个分离过程完成后,用1.5 mL/min NaCl溶液冲洗径向柱,直至280 nm处无蛋白吸收峰,再用蒸馏水洗脱平衡。
1.2.3 分离条件的研究
1.2.3.1 茯苓菌丝体多糖径向流色谱分离的响应面分析试验[2]为了优化茯苓菌丝体多糖径向分离工艺条件,根据Box-Behnken组合试验设计原理,通过对样品浓度、上样量、上样流速、洗脱流速的单因素试验考察,选取对茯苓菌丝体多糖分离多糖回收率影响显著的3个因素:上样量(5、20、35 mL)、上样流速(2、10、18 mL/min)、洗脱流速(5、20、35 mL/min),分别以X1、X2、X3代表,每一个自变量的低、中、高实验水平分别以-1、0、1进行编码,试验设计如表1所示[6]。
1.2.4 多糖回收率的计算 茯苓菌丝体多糖回收率Y(%)=Y1/Y2×100%。其中Y1是茯苓菌丝体分离纯化后的多糖重量;Y2为茯苓菌丝体粗多糖重量。
1.2.5 径向流色谱分离与传统方法的比较 本实验的传统轴向色谱分离采用玻璃分离柱(50 mL,2.6 cm×10 cm,上海沪西分析仪器厂),洗脱方法和径向色谱分离条件相同;传统化学方法为先用seveg法对一定量的茯苓菌丝体粗多糖脱出蛋白质,反复4 ~ 5次,再用30%双氧水除去色素,去离子水透析后,冷冻干燥称质量。最后计算每种方法的多糖回收率。
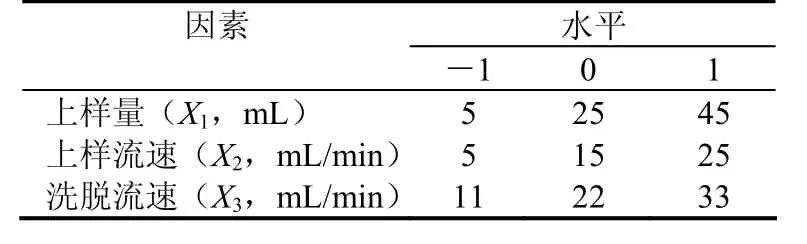
表1 响应面分析因子及水平表Table 1 Factors and levels of RSM analysis
2 结果与分析
2.1 响应面分析试验结果
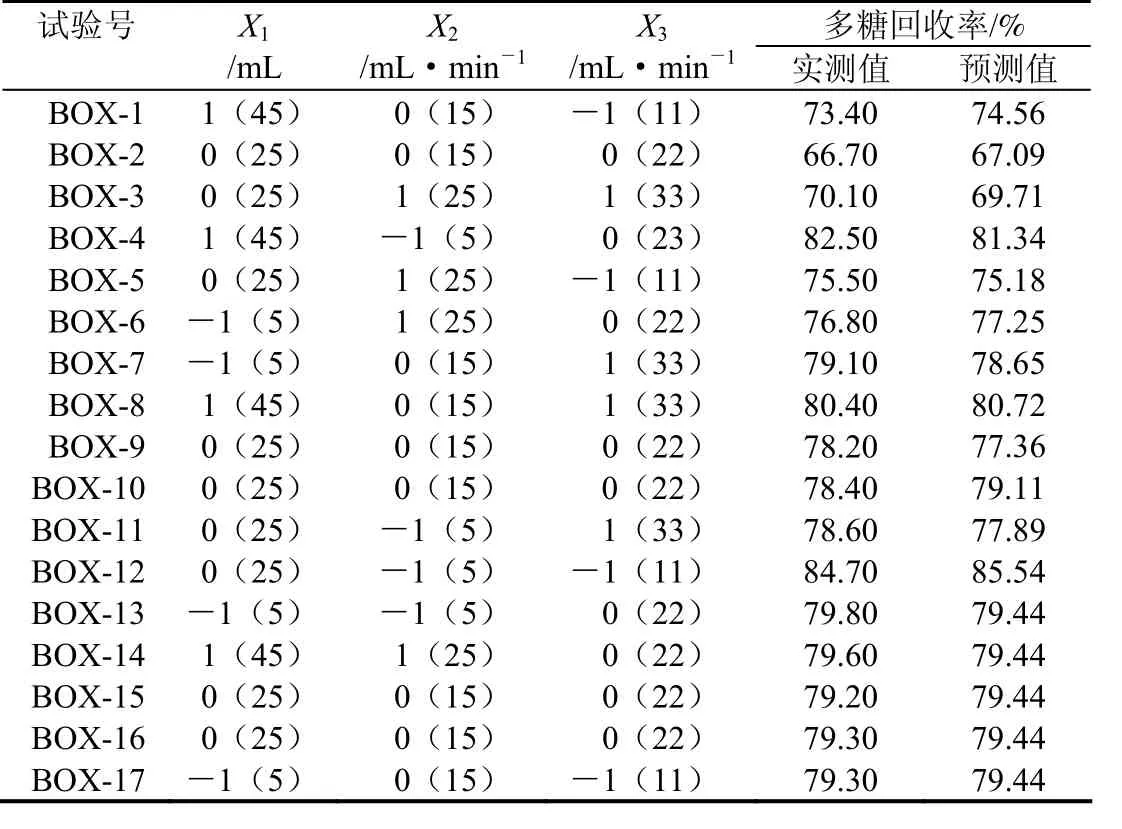
表2 响应面试验设计方案及试验结果Table 2 Experiment design and results of RSM
2.2.1 响应面分析方案及结果 响应面分析实验结果见表2、表3。
利用Design Expert7.0软件对表2实验数据进行分析[7],获得茯苓菌丝体多糖回收率对上样量、上样流速和洗脱流速的多元二次回归方程:

显著性检验表明,模型回归达到极显著水平(表3),模型的决定系数R2= 0.9791,说明模型与实际实验拟合有97.91%的符合度;校正决定系数Adj R2= 0.9523,说明该模型能解释95.23%响应值的变化;失拟项P值0.0030,说明检验结果与模型计算结果没有显著差异;若模型很好地预测了实验结果,则F检验值应远远大于理论计算值,从方差分析表知,模型F检验值为36.46,理论值在0.05水平上查表可得F(9,5)= 4.48,说明方程显著性很高。在α为 0.05 水平上,X1、X2、X3、X1X2、X2X3、X1X1、X2X2、X3X3对响应值的影响显著,X1和X2交互间影响显著,可用上述回归方程描述各因子与响应值的关系对不同分离条件下茯苓菌丝体多糖回收率进行分析和预测。
对模型回归系数进行显著性检验,结果见表3。从表3可以看出,在α= 0.05水平上,上样流速的线性效应极显著,上样量和上样流速的线性效应不显著;上样量和上样流速及上样流速与洗脱流速交互作用显著;三个因素的一次、二次曲面效应均显著(P < 0.01)。
2.2.2 响应面图形分析 分别将模型中的上样量、上样流速及洗脱流速的其中一个因素固定在0水平,得到另外两个因素的交互影响结果,二次回归方程的响应面及其等高线如图1至图3所示,各个因素及其相互间的交互作用对响应值的影响结果通过该组图可以直观地反映出来。极值条件应该在等高线的圆心处。由几组图可以看出,影响茯苓菌丝体多糖径向流色谱分离的最显著的因素为上样量流速(X2),表现为响应面变化弧度较大;上样量(X1)和洗脱流速(X3)响应面弧度变化平缓,说明对响应值影响相对较小。

表3 回归模型方差分析Table 3 ANOVA regression model
此外,等高线的形状可反映出交互效应的强弱,椭圆形表示二因素交互作用显著,而圆形则与之相反。从图1至图3可以看出,X1与X3交互作用显著;X2与X3,X1与X2均无交互作用,表明一因素对响应值的影响规律并不会随着另一因素的改变而有明显变化。

图1 上样量和上样流速交互影响茯苓菌丝体多糖径向色谱分离的曲面图和等高线图Figure 1 Response surface and contour for yield recovery as a function of sample volume and sample flow-rate at elution flow-rate 22 mL/min

图2 上样量和洗脱流速交互影响茯苓菌丝体多糖径向色谱分离的曲面图和等高线图Figure 2 Response surface and contour for yield recovery as a function of sample volume and elution flow-rate at sample flow-rate 15 mL/min

图3 上样流速和洗脱流速交互影响茯苓菌丝体多糖径向色谱分离的曲面图和等高线图Figure 3 Response surface and contour for yield recovery as a function of sample flow-rate and elution flow-rate at sample volume 25 mL
2.2.3 验证实验 通过Design-expert软件对上述方程进行求解,得到最佳提取条件为:上样量39.01 mL,上样流速25.00 mL/min,洗脱流速33.00 mL/min。在此条件下,茯苓菌丝体多糖回收得率理论值可达84.12%。为检验该法的可靠性,考虑到实际操作的便利,将最佳工艺参数修正为:当样品浓度为8 mg/mL,上样量为40 mL,上样流速为25 mL/min,洗脱流速为33 mL/min时进行径向流色谱分离茯苓菌丝体多糖的验证试验,经3次平行试验,实际多糖回收率为 83.43%、83.71%、82.65%,实际多糖回收率平均值为 83.26%,与回归模型预测的回收率理论值无显著差异,实验结果与模型符合良好,说明该模型能较好地模拟和预测茯苓菌丝体多糖回收率。
2.4 径向流色谱分离与传统方法的比较
当茯苓菌丝体多糖浓度为8 mg/mL,同样上样量为30 mL时,径向色谱分离只需25 min即可完成整个过程,且多糖回收率高达83.32%,而传统轴向色谱分离需耗时135 min,且多糖回收率下降4.75百分点;化学方法更加耗时,且多糖回收率在分离过程中大大下降,损失较多,具体结果见表4。

表4 径向流色谱分离与传统方法的比较结果Table 4 Comparison of RFC with AFC and chemical method
3 结论
将径向流色谱分离技术应用于茯苓菌丝体多糖中,并用响面分析法优化分离工艺,采用合理的实验设计,依据回归分析确定各因素对多糖回收率的影响,取得了比较好的结果[8~10]。经优化后确定径向流色谱分离茯苓菌丝体多糖的最佳工艺条件为:当样品浓度为8 mg/mL,上样量为40 mL,上样流速为25 mL/min,洗脱流速为33 mL/min时,多糖回收率达到83.26%,比传统轴向分离和化学方法更缩短时间,从而为茯苓菌丝体多糖的工业化开发和应用提供了理论基础。
[1]费荣昌. 实验设计与数据处理(第四版)[M]. 无锡:江南大学出版社,2001. 59-63.
[2]沈雅琴,张明发,朱自评,等. 茯苓菌丝体皮的镇痛抗炎和抗血栓形成作用[J]. 药物研究,1998,7(10):30-31.
[3]韩莉,万福珠,刘朝奇. 茯苓菌丝体果浸出液对荷瘤小鼠及其感染白色念珠菌的影响[J]. 咸阳医学院,1999,13(3):149-151.
[4]郑丽红,陈冠敏,林鸿,等. 微波辅助水提取茯苓多糖的安全性研究[J]. 海峡药学,2010,22(10):17-20.
[5]方圆,王雪彦,晁若冰. 土茯苓药材中落新妇苷和总黄酮的含量测定方法研究[J]. 药物分析杂志,2010(9):1738-1741.
[6]杨丹,程忠泉,刘玉清,等. 茯苓皮的化学成分研究[J]. 安徽农学通报,2010,16(19):45-46.
[7]张越非,甘琳,池汝安,等. 离子液体微波辅助提取土茯苓中黄酮的研究[J]. 时珍国医国药,2010,21(8):1975-1977.
[8]姜慧燕,邵平,孙培龙,等. 径向流色谱分离技术原理及应用分析[J]. 核农学报,2009,23(1):118-122.
[9]龚志华,邓燕莉,陈芳,等. 植物复合酶SPE-002提取茯苓多糖工艺研究[J]. 湖南农业大学学报,2010,36(5):565-568.
[10]陶跃中,姜辉,舒志愚,等. 响应面法优化茯苓菌丝体多糖的提取工艺研究[J]. 安徽农业科学,2010(17):9095-9097.
