猪FcγRⅡB多种剪接异构体的基因克隆与序列分析①
2011-07-30张宜娜刘肖萍张志远段二珍张继希周永辉夏平安崔保安
张宜娜 刘肖萍 张志远 段二珍 张继希 周永辉 夏平安 崔保安
(河南农业大学牧医工程学院兽医免疫学实验室,郑州450002)
Fc受体是免疫细胞上一类能够结合抗体Fc片段的受体,广泛表达于免疫辅助细胞和效应细胞,介导免疫细胞与抗原-抗体复合物及其他细胞间的相互作用,触发和调控机体多种免疫学效应,是机体体液免疫与细胞免疫间关键的联系纽带,在机体免疫防御中起着极其关键的作用[1]。
根据FcγR胞内区功能特征不同可将其分为激活型受体和抑制型受体两类,二者共表达于巨噬细胞、单核细胞等免疫细胞表面,共同调节抗体对免疫细胞的活化作用,激活型受体的胞内区或者γ链含有基于酪氨酸的受体活化基序(ITAM),能激活免疫效应细胞,诱导多种免疫学效应[2-5]。FcγRⅡB是目前发现的唯一的抑制型受体,其胞内区含有基于酪氨酸的受体抑制基序(ITIM),通过免疫复合物与激活型受体交联,抑制ITAM基序介导的细胞活化[6]。
人和哺乳动物的FcγR 主要有FcγRⅠ(CD64)、FcγRⅡ(CD32)和FcγRⅢ(CD16)3个亚群,都属于 Ig超家族成员,每个亚群都存在几种亚类和不同的RNA剪接异构体[7]。目前已发现人的FcγRⅡB通过信号肽、跨膜区和胞内区的选择性剪接形成了五种转录体,鼠的FcγRⅡB通过胞内区的选择性剪接形成了两种转录体。Qiao等[8]克隆并鉴定了猪的FcγRⅡB 受体(swFcγRⅡB),刘玉松等[9]随后发现其存在RNA剪接异构体FcγRⅡB1(GenBank accession No.FJ608551),与swFcγRⅡB受体相比,胞内区有57个碱基的插入。
本研究利用RT-PCR技术从猪肺巨噬细胞中扩增猪FcγRⅡB基因,并进行测序、序列分析,寻找猪FcγRⅡB受体基因是否存在其它的RNA剪接异构体。对所克隆基因的核苷酸及氨基酸序列进行分析比对,探明猪FcγRⅡB各转录体的选择性剪接方式,为进一步研究猪FcγRⅡB多种转录体的生物学功能及其相互作用奠定基础。
1 材料与方法
1.1 菌株及试剂 pTG19-T载体购自上海捷瑞生物工程有限公司,大肠杆菌DH5α由河南农业大学兽医微生物研究室保存,Trizol LS Reagent、T4 DNA连接酶 、rTaq 酶、DNA marker DL2000、DNA marker DL15000、RT试剂盒等购自大连宝生物工程有限公司,DNA胶回收纯化试剂盒购自北京百泰克生物技术有限公司。
1.2 实验动物 20头大白猪购自河南省多个猪场。
1.3 RT-PCR引物设计 根据GenBank中已发表的猪IgGⅡB类Fc受体cDNA基因序列(DQ026064),利用Primer5.0软件,设计一对可扩增猪FcγRⅡB基因完整ORF特异引物。引物序列如下:T24:5′-CAGAGGCAACCTGCGTAC-3′;T25:5′-CAAGTCCCAGGCAAGATAAT-3′。
1.4 猪肺巨噬细胞的分离 无菌采集猪的新鲜肺脏,按参考文献[10]提供的方法分离猪肺巨噬细胞,并调整细胞浓度为6×106个/ml。
1.5 猪肺巨噬细胞总RNA的提取 取猪肺巨噬细胞250 μl,加入 750 μl的 Trizol裂解液,振摇混匀,室温放置10分钟加入氯仿200μl,室温放置10分钟,12 000 r/min,4℃离心15分钟,取上清液,加入等体积的异丙醇,室温放置15分钟,以12 000 r/min,4℃离心15分钟,弃上清,沉淀用75%乙醇洗涤,用滤纸吸干剩余的液体,加入15μl焦碳酸二乙酯(DEPC)灭菌水溶解,-80℃保存备用。
1.6 RT-PCR扩增猪FcγRⅡB受体基因 按照反转录试剂盒使用说明进行反转录。以反转录所获取猪肺巨噬细胞cDNA为模板,以引物T24和T25扩增猪FcγRⅡB基因,PCR反应体系为 25μl。PCR反应条件:94℃预变性5分钟;94℃45秒,58.6℃1分钟,72℃1分钟,共35个循环;72℃10分钟;4℃保存。反应结束取6μl用10 g/L琼脂糖凝胶进行电泳。
1.7 目的基因的克隆与鉴定 按北京百泰克DNA胶回收试剂盒说明书纯化回收PCR产物,并连接于pTG19-T载体中,连接产物按常规方法转化DH5α感受态细胞[11],进行蓝白斑筛选,挑选白斑接于含有氨苄青霉素的LB培养基,37℃培养过夜。取培养物提取质粒,进行酶切和PCR鉴定,筛选出阳性重组质粒,送上海尼桑生物技术有限公司测序。
1.8 猪FcγRⅡB编码区cDNA序列分析 序列对比和翻译使用DNAMAN软件包进行,同源性检索分别使用NCBI(National centre for Biotechnological Information)和 DDBJ(Dan Data Bank of Japan)提供的BLAST和FAST检索和分析软件进行。结构分析、信号肽和糖基化位点预测及其它序列分析使用CBS服务器提供的软件包进行。
2 结果
2.1 目的基因的扩增 用RT-PCR法从猪肺巨噬细胞中扩增出大小不同的6个目的片段,经胶回收纯化,连接,转化,挑取阳性克隆提取质粒,用Bam HⅠ酶切,得到了与预期目标大小相符的两个条带,扩增结果及酶切鉴定见图1、2。
2.2 序列测定与分析 将获得的DH5α阳性克隆菌液送上海尼桑生物技术有限公司测序,通过DNAStar和Blast软件分析表明,扩增得到的序列为猪FcγRⅡB基因序列。扩增的6个片段长度分别为1 005、945、948 、999、639 和 573 bp,经测序分析,完整的ORF长为951、891、894、948、639 和 519 bp。根据Fc受体命名规则,FcγRⅡB1-6基因分别命名为猪FcγRⅡB 转录体1、2、3、4、5和 6。这六个转录体是从不同个体猪体内提取出来的,其中转录体1和转录体3的提取频率可达90%,而其他的只提取出过一次。另外转录体1和3以及转录体5和3均在同一猪体内也提取过,即在机体中有两种或两种以上的转录体同时存在,只是转录体1和3是优势表达。经氨基酸序列比对分析,FcγRⅡB转录体1与本实验室提交序列(FJ608551)ORF序列一致,转录体3与swFcγRⅡBORF大小一致,仅存在 4个氨基酸的变异(丙氨酸第11位,精氨酸第44位,酪氨酸第110位,半胱氨酸第246位)。扩增出的6个转录体与swFcγRⅡB相比,核酸同源性分别为:98.8%、99.1%、99.6%、98.2%、98.7%和 98.3%,氨基酸同源性分别为97.0%、97.6%、98.3%、96.3%、96.7%和95.4%。FcγRⅡB转录体1含有6个糖基化位点(NTT 、NFT 、NFS 、NQS 、NIT 、NHT),胞外区有 2个 Ig结构域(EC1、EC2),信号肽由45个氨基酸组成。转录体2也含有6个糖基化位点,胞外区2个Ig结构域,信号肽区域包含42个氨基酸,缺失第45位氨基酸(丙氨酸)。转录体3与4在糖基化位点和胞外区结构相同,信号肽区域包含45个氨基酸。转录体4与1相比,只在信号肽区包含42个氨基酸,缺失45为氨基酸。转录体5,6缺少3个糖基化位点(NFS、NQS和NIT),形成胞外区的第二个Ig结构域。FcγRⅡB转录体6缺失由23个氨基酸组成的跨膜区,为可溶性FcγⅡB受体。转录体2、3和5与转录体1相比胞内区有19个氨基酸的缺失,如图3。
猪FcγRⅡB的氨基酸组成与人的有高度同源性与相似性。人FcγRⅡB转录体2,4与转录体1,3相比缺失了第46位氨基酸,同样是一个丙氨酸,转录体2,3胞质尾区有19个氨基酸的缺失。有意义的是,猪FcγRⅡB与人的一样,缺失丙氨酸的转录体信号肽都只有42个氨基酸,不缺失丙氨酸的转录体信号肽有45个氨基酸。比对猪FcγRⅡB转录体1~4与人FcγRⅡB转录体1~4的氨基酸同源性分别为61.7%、61.9%、62.0%和62.6%。
用DQ026064序列在GenBank中进行BLAST分析,在猪的染色体4上找到了猪FcγRⅡB相应的DNA序列(CU468575)。共有9个外显子组成,长度分别为112、21、258、255、255、120、57、38 和90 bp。内含子以GT-AG的机制剪切。各转录体核苷酸序列与猪FcγⅡB DNA序列进行比对,转录体1由外显子1,2,3,5,6,7,8,9组成,转录体2由外显子1,2,4,5,6,8,9组成,转录体3由外显子1,2,3,5,6,8,9组成,转录体4由外显子1,2,4,5,6,7,8,9组成,转录体5由外显子1,2,3,6,8,9组成,转录体6由外显子1,2,3,8,9组成。外显子3,4,5,6,7为选择性剪接位点,外显子3与外显子4的选择性剪接形成了各转录体间信号肽的差别,外显子5编码EC2结构域,外显子6编码跨膜区。各转录体的外显子组成如图4。

图1 FcγRⅡB1-3 PCR扩增及重组质粒酶切鉴定图Fig.1 A,B and C are PCR product and enzymes clipping graphs of FcγRⅡB1,FcγRⅡ B2 and FcγRⅡB3

图2 FcγRⅡB4-6 PCR扩增及重组质粒酶切鉴定图Fig.2 D,E and F are PCR product and enzymes clipping graphs of FcγRⅡB4,FcγR ⅡB5 and FcγRⅡB6
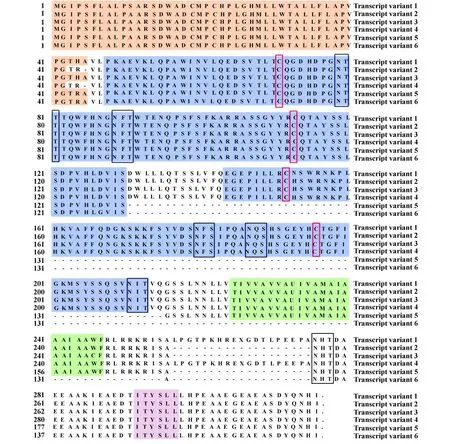
图3 猪FcγRⅡB不同转录体之间氨基酸序列的比对Fig.3 Comparison of different porcine FcγRⅡB transcript variants amino acid sequences
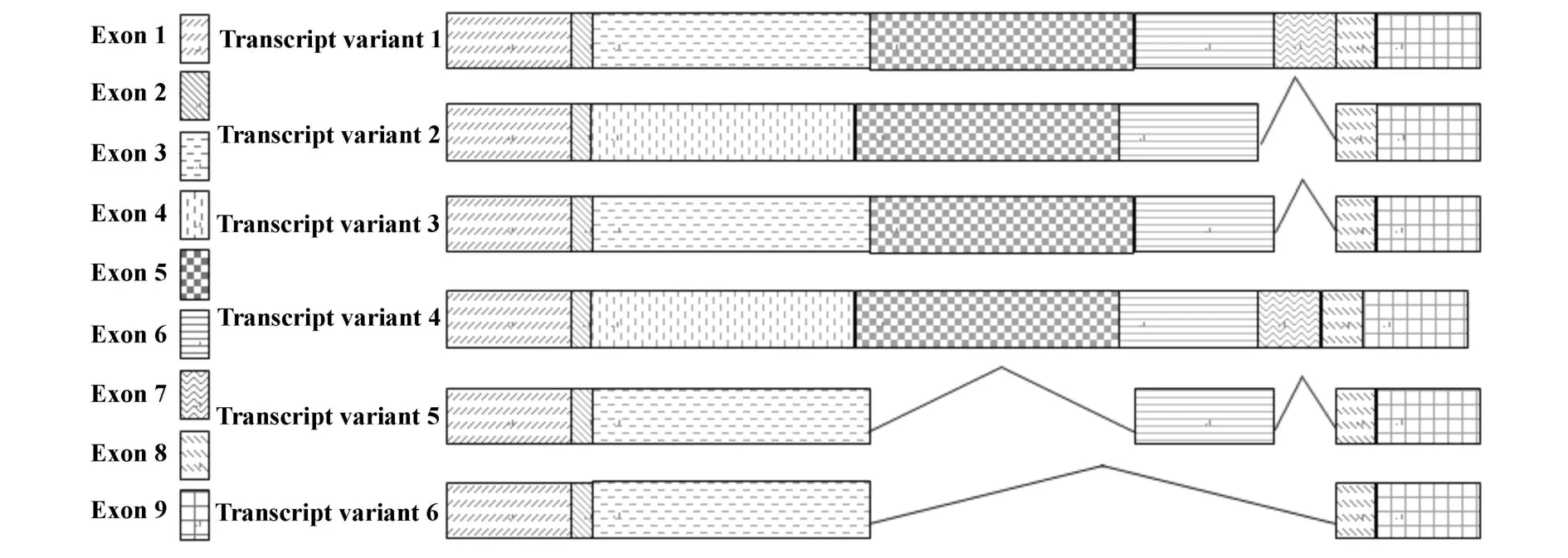
图4 猪FcγRⅡB各转录体的外显子组成结构分析图Fig.4 Construction analysis of exons of porcine FcγRⅡB transcript variants
3 讨论
第一个被分离鉴定的猪FcγRⅡB基因序列是Qiao[8]所发表的DQ026064,ORF全长894 bp,为单次跨膜糖蛋白,胞外区包括45个氨基酸的信号肽和两个Ig结构域(EC1:83个氨基酸,EC2:70个氨基酸),跨膜区和胞质尾区分别由23和50个氨基酸组成,胞质尾区包含一个ITIM抑制基序:ITYSLL。经生物学功能鉴定该受体蛋白能够结合抗原-抗体复合物。随后本实验室发现该受体存在RNA剪接异构体(FJ608551),胞质尾区有19个氨基酸的插入,经生物学功能鉴定同样能够结合抗原-抗体复合物。为进一步研究猪FcγRⅡB是否存在其它的转录体,免疫细胞的选择性表达机制,本研究根据DQ026064设计了一对特异性引物,对猪不同个体的肺泡巨噬细胞进行扩增,结果出现了与DQ026064和FJ608551不同的另外4个转录体,经氨基酸序列分析比对,我们发现转录体4和转录体1相比,信号肽部分有一个丙氨酸的缺失,转录体2和转录体3相比信号肽部分同样有一个丙氨酸的缺失。猪FcγRⅡB转录体5和6是两种新型的FcγRⅡB,其他物种中尚未发现有相似结构的FcγRⅡB。转录体5胞外区缺失了EC2结构域,只含有一个Ig结构域,转录体6缺失了EC2结构域和跨膜区及胞质尾区的27个氨基酸,是一个可溶性FcγRⅡB受体。由此我们推断猪FcγRⅡB至少存在4个亚类。在多次的扩增试验中,我们发现转录体1和转录体3的提取频率可达90%,而其他的只提取出过一次,推测这两种转录体的表达是猪FcγRⅡB的主要表达方式,而且在机体中有两种或两种以上的转录体同时存在。
可溶性FcγRⅡB被首次克隆鉴定是在小鼠体内[12],可溶性Fc受体的产生通过两种方式:膜结合蛋白的裂解和缺失跨膜区外显子的选择性剪接[13],牛FcγRⅡB3缺失编码跨膜区的外显子120 bp[14],和猪FcγRⅡB转录体6同属于RNA选择性剪接可溶性Fc受体。可溶性Fc受体在体液中循环,结合免疫复合物干扰抗体的免疫学功能,还可以与细胞表面的配体结合发挥多种生物学效应,调节细胞的增殖,成熟或抗体的产生[15]。
DNA中内含子是以剪接供体位点GT或GC,受体位点AG为选择性剪接位点[16]。在猪FcγRⅡB DNA序列中,内含子以GT-AG为选择性剪接位点。猪FcγRⅡB DNA共有9个外显子组成,其中外显子1,2,8,9为6个转录体的共有序列,外显子3,4的选择性剪接造成了各转录体间信号肽的差异,外显子5,6分别编码了EC2结构域和跨膜区,外显子7的选择性剪接造成了各转录体间胞质尾区的不同,从猪FcγRⅡBDNA外显子结构图推断,猪FcγRⅡB可能还存在其它的转录体形式。
目前各种物种的FcγRⅡB基因相继克隆,基因外显子组成及FcγRⅡB蛋白分子特征都有很大的相似之处,但RNA选择性剪接机制,各转录体间的相互关系及每个外显子的生物学功能等方面的研究还相对较少,这需要我们进一步的研究和探索。
1 Daeron M.Fc receptor biology[J].Annu Rev Immunol,1997;15(1):203-234.
2 Nimmerjahn F,Ravetch J V.Fc gamma receptors:old friends and new family members[J].Immunity,2006;24(1):19-28.
3 Nimmerjahn F,Bruhns P,Horiuchi K et al.Fc gamma RIV:a novel Fc R with distinct IgG subclass specificity[J].Immunity,2005;23(1):41-51.
4 Ravetch JV,Bolland S.IgG Fc receptors[J].Annu Rev Immunol,2001;19:275-290.
5 Hamerman J A,Lanier L L.Inhibition of immune responses by ITAM-bearing receptors[J].Sci STKE,2006;(320):189-227.
6 Baerenwaldt A,Nimmerjahn F.Immune regulation:FcgammaRⅡB-regulating the balance between protective and autoreactive immune responses[J].Immunol Cell Biol,2008;86(6):482-484.
7 Cohen-Solal JF,Cassard L,Fridman WH et al.Fc gamma receptors[J].Immunol Lett,2004;92(3):199-205.
8 Qiao S L,Zhang G P,Xia C H et al.Cloning and characterization of porcine Fc gamma receptor II(FcγRII)[J].Vet Immunol Immunopathol,2006;114(1-2):178-184.
9 刘玉松,夏平安,刘肖萍 et al.猪IgGIIB类Fc受体基因剪接异构体的克隆及序列分析[J].河南农业大学学报,2010;44(5):542-548.
10 徐红运,夏平安,王中明 et al.猪肺巨噬细胞FcγRⅢ受体基因的克隆与序列分析[J].中国畜牧兽医,2010;37(4):66-70.
11 梁国栋.最新分子生物学实验技术[M].北京:科学出版社,2001:30-43.
12 Fridman WH,Golstein P.Immunoglobulin-binding factor present on and produced bythymus-processed lymphocytes(T cells)[J].Cell Immunol,1974;11(1-3):442-455.
13 Galon J,Paulet P,Galinha A et al.Soluble Fc gammareceptors:interaction with ligands and biological consequences[J].Int Rev Immunol,1997;16(1-2):87-111.
14 Firth M A,Chattha K S,Hodgins D C et al.Multiple bovine FcγRIIb sub-isoforms generated by alternative splicing[J].Vet Immunol Immunopathol,2010;135(1-2):43-51.
15 Fridman WH,Teillaud JL,Bouchard C et al.Soluble Fcγreceptors[J]JLeukoc Biol,1993;54(5):504-512.
16 Hyun B J,Daesong Y,Yoon B K.Porcine FcγRⅢA isoforms are generated by alternative splicing[J].Mol Immunol,2009;46(6):1189-1194.
