抗肠道病毒71型特异性卵黄抗体的制备及鉴定①
2011-07-30朱思思赵肃清李月明温俊林广东工业大学轻工化工学院广州510006
朱思思 赵肃清 李月明 温俊林 (广东工业大学轻工化工学院,广州510006)
肠道病毒71型是细小RNA病毒科,肠道病毒属,自1974年首次报道以来,已在全世界范围内多次爆发和流行[1,2]。EV71感染除了能引起手足口病(Hand-foot-and-mouth disease,HFMD)外,还能引起一系列神经系统相关的严重疾病如脑干脑炎、无菌性脑膜炎和脊髓灰质炎样的麻痹[3]。然而目前针对肠道病毒EV71感染仍没有有效的预防疫苗及治疗特效药。近年来,卵黄抗体(egg yolk immunoglobulin Y,IgY)因其具有经济、安全、制备方便、稳定性好等优点而成为当今生物科学研究的一个热点[4]。IgY抗体在动物与人的被动免疫保护方面的应用引起了广泛的关注。国内外已有一些关于抗猪繁殖与呼吸综合症病毒、抗流感病毒、抗甲肝病毒IgY抗体的研究报道[5-7]。本研究的目的在于制备与鉴定特异性抗EV71病毒的IgY抗体并检测其生物学性能,为EV71感染手足口病的预防和治疗奠定基础。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 高速冷冻离心Allegra TM 64R Centrifuge(Beckman,America);酶标分析仪Tecan infinite 200(Tecan,Switzerland);生物安全柜NE-430-600E(NUAIRE,America);真空冷冻干燥机(北京松源华兴科技发展有限公司);HRP标记山羊抗鸡IgY二抗为Promega公司产品;弗氏佐剂(Freund's adjuvant)、四甲基联苯胺(Tetrabenzidine,TMB)购自Sigma公司;胎牛血清、DMEM培养基均为Gibco公司产品;CsCl为MERCK公司产品;PEG6000为日产购自广东国奥生物科技公司;其他试剂为国产分析纯。
1.1.2 实验动物 广州太和良田养鸡场健康产蛋母鸡4只,未经任何免疫,正常饲养。
1.1.3 实验抗原 EV71肠道病毒广东惠州株由广东省疾病预防控制中心提供。
1.2 方法
1.2.1 抗原的纯化 将EV71病毒株接种到生长至单层的横纹肌肉瘤细胞RD细胞中,CO2培养箱中培养至90%左右细胞出现细胞病变CPE时收获,-20℃冻融3次,4℃,10 000 r/min离心90分钟,收集上清液。上清液经4℃,26 000 r/min离心3小时,弃上清,沉淀用PBS缓冲液悬浮。CsCl密度梯度离心,4℃45 000 r/min离心3小时,弃上清去除残余CsCl,加入少量PBS稀释纯化后病毒液,56℃高温灭活,4℃保存。
1.2.2 免疫方法 取纯化后的EV71病毒原液与弗氏完全佐剂等体积混合,乳化充分后按200μl/只的抗原量经肌肉多点注射免疫实验鸡;然后分别在一免后14、24、34天分别进行三次加强免疫,加强免疫用弗氏不完全佐剂与病毒液等体积乳化,免疫方法和剂量与首免相同。首免后第7天开始收集每日鸡蛋,编号4℃冰箱保存备用。收集免疫前鸡蛋及血清为阴性对照。
1.2.3 卵黄抗体的分离纯化 将收集的鸡蛋破壳,收集蛋黄并在无菌定性滤纸上滚动以除去残留卵白蛋白,破卵黄膜收集卵黄液,测卵黄液体积并平分两份,提取纯化方法分别采用PEG三步沉淀法及本实验室改良的水提综合PEG法纯化蛋白[8]:加卵黄液9倍体。积的4℃冻存蒸馏水,调pH值至5.2,充分搅匀后放4℃静置过夜。4℃,10 000 r/min离心20分钟,过滤,弃沉淀。上清液中加入PEG6000粉末使其终浓度为8.5%,调pH值至7.2,充分混匀后4℃,10 000 r/min离心20分钟,弃上清液。沉淀用适量4℃PBS缓冲液(0.01 mol/L,pH7.2)溶解后再加入PEG6000至终浓度为12%,10 000 r/min,4℃离心20分钟,弃上清。再用少量PBS溶解沉淀,转入透析袋(分子截留量14 kD),透析24小时以上,收集透析液,-56℃真空冷冻干燥至粉末,-20℃保存。
1.2.4 卵黄抗体纯度及含量检测 参照文献[9]用考马斯亮蓝G-250染色法测定IgY纯化后冻干粉中总蛋白含量。还原性SDS-PAGE凝胶电泳(5%浓缩胶、15%分离胶)分析IgY的纯度,凝胶成效扫描分析计算总蛋白中IgY含量。
1.2.5 间接ELISA法检测卵黄抗体效价 将纯化过的EV71病毒抗原用0.01 mol/LPBS1∶1 000稀释后包被于96孔酶标板上(100μl/孔),37℃温浴1小时后,4℃过夜。用含3%脱脂奶粉的0.01 mol/L PBS液封闭(100μl/孔),37℃温浴1小时。卵黄抗体IgY用0.01 mol/L PBS倍比系列稀释后加入96孔酶标板(100μl/孔),37℃温浴反应1小时后加入酶标二抗HRP-GAM IgY(100μl/孔),37℃温浴 1小时。用TMB显色液显色约15分钟后2 mol/LH2SO4溶液终止反应(50μl/孔),立即用酶标仪测定OD450nm处吸光值。以免疫鸡IgY与未免疫鸡阴性IgY OD450nm吸光值之比大于2.1,且阴性IgY吸光值大于0.1作为抗体阳性的判定阀值。
1.2.6 免疫双向琼脂扩散检测 琼脂糖与PEG6000各1 g溶于100 ml生理盐水,煮沸至透明,趁热倒入洁净培养皿中,每平皿约18~20 ml,加盖置平台。待其冷却凝固后用打梅花样孔,孔径约4 mm,孔距约3 mm。用针头小心挑出孔内琼脂糖,封闭孔底。
往中心孔加入一定量抗原原液,外周孔加入等量不同稀释倍数的抗体IgY溶液。静置至孔内样液完全吸入琼脂中,将培养皿倒置平放于湿盒内,37℃恒温水浴,24~48小时后观察结果。
1.2.7 免疫印迹(Western blot)分析卵黄抗体的特异性 将SDS-PAGE凝胶电泳分离的EV71病毒蛋白转移至NC膜,室温下以含5%脱脂奶粉的TBST为封闭液,纯化IgY为一抗,HRP标记山羊抗鸡IgY为二抗,增敏二氨基联苯胺(DAB)显色液显色。同时设定阴性对照。
2 结果
2.1 IgY的提取 BSA的Bradford法标准曲线如图1,得蛋白浓度计算公式Y=0.008 3X+0.036,R2=0.990 5。计算得水提综合PEG法和PEG三步沉淀法两种不同提取方法提取的冻干粉中蛋白含量分别为89.64%、85.90%。
由SDS-PAGE电泳结果(图2)可见目的蛋白在还原条件下二硫键打开,分裂约64 kD的IgY重链和26 kD的IgY轻链。WSF中含有大量杂蛋白;经3.5%和8.5%PEG两步沉淀法提取的沉淀蛋白中仍含有一定量40 kD的β活性蛋白;而由水提综合PEG法、PEG三步沉淀法提取蛋白中杂蛋白大量减少,IgY纯度显著提高,凝胶成像系统软件分析IgY抗体纯度分别为94.86%和92.56%。同时由表1可知,水提综合PEG法提取IgY产量达7.76 mg/ml,而PEG三步沉淀法提取IgY产量仅为3.96 mg/ml。
2.2 ELISA检测IgY效价及消长规律 抗EV71病毒IgY抗体ELISA检测效价变化规律如图3。蛋鸡初免约10天后蛋黄中可检测到特异性卵黄抗体,加强免疫后特异性IgY效价呈明显的增长趋势。初免约40天后抗体效价达最高1∶20 480,此高效价大约维持30天后抗体效价水平开始逐步下降。
2.3 免疫双向琼脂扩散 以双向免疫琼脂扩散法检测初免后第40天特异性抗EV71病毒IgY抗体效价。结果如图4,当抗体以1∶16稀释时,抗原孔与抗体孔之间仍出现显著白色沉淀线,而PBS空白对照孔与抗原孔之间无沉淀线。
2.4 Western blot分析 抗EV71病毒IgY Western blot分析结果(如图5)显示能特异性地与EV71病毒蛋白条带产生良好免疫反应。如图5所示抗EV71病毒IgY与EV71病毒蛋白在约38、36、24 kD出现特异性结果条带,由文献[10]可知,相对分子量为36、24 kD左右的蛋白条带分别为EV71病毒的VP1(α)、VP3蛋白。而阴性IgY与EV71病毒不具有免疫反应性,图中没有特异性结合的蛋白条带出现。
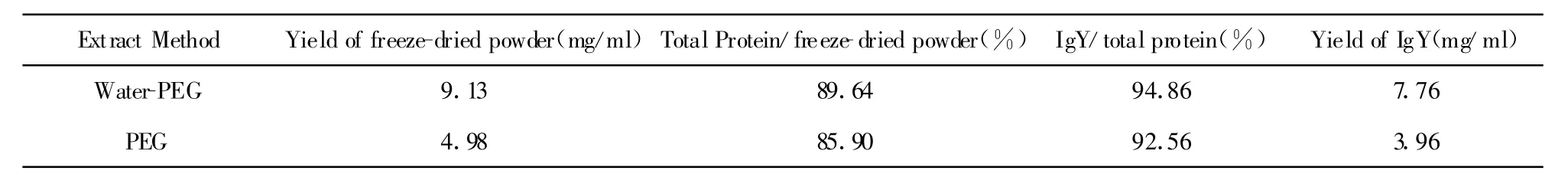
表1 两种提取方法提取卵黄抗体产量及纯度对比表Tab.1 Comparetheyield and purity of IgY extracted by PEG method and Water-PEG method
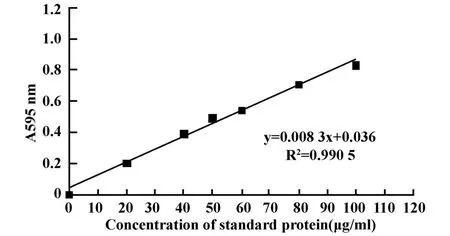
图1 蛋白质标准曲线图Fig.1 Standard curve of protein
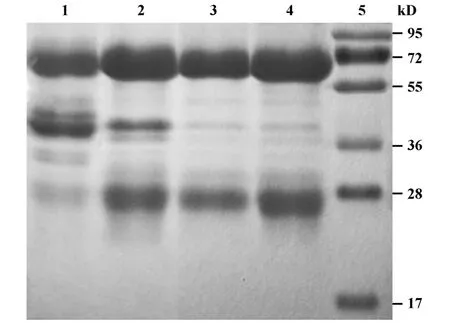
图2 纯化IgY的SDS-PAGE分析Fig.2 SDS-PAGE patterns of IgY purified by three methods
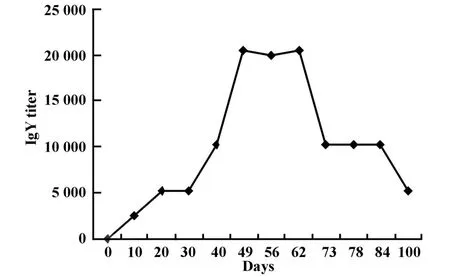
图3 抗EV71病毒IgY抗体效价消长规律Fig.3 The development pattern of anti-EV71 IgY after primary immunization

图4 双向免疫琼脂扩散Fig.4 Agar double immunodiffusion
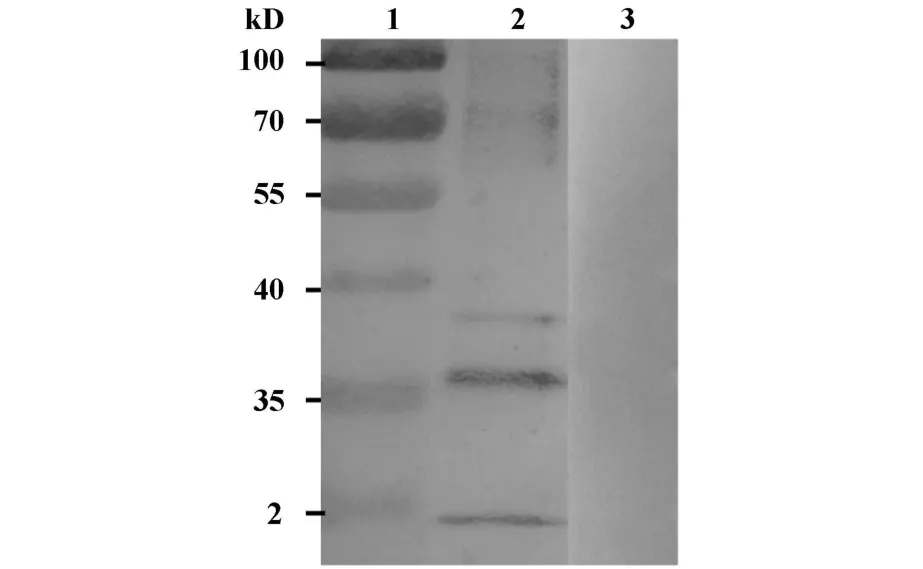
图5 蛋白印迹分析抗EV71病毒IgYFig.5 Western blot analysis the immunoreactivity of IgY anti-EV71
3 讨论
目前,提取IgY常用方法主要有水提硫酸铵沉淀法、PEG三步沉淀法等[11]。水提硫酸铵沉淀法获得卵黄抗体的产量大,纯度高,但实验周期长,硫酸铵消耗量大,成本高,不适合实验室小型研究;而PEG三步沉淀法虽实验周期短,但提取IgY产量低,浪费严重。本研究采用综合以上两种提取方法的水提综合PEG法,并成功获得抗EV71的特异性IgY抗体,操作步骤简便快捷,实验成本低、周期短,得到的卵黄抗体纯度高达94.83%,产量达7.76 mg/ml,明显高于PEG三步沉淀法得92.56%和3.96 mg/ml。
EV71病毒颗粒为二十面体立体对称的球形结构,直径约24~30 nm,病毒颗粒的衣壳组成非常复杂,分子量分别为34、30、26和7 kD的四种结构蛋白VP1(α)、VP2(β)、VP3(γ)、VP4(δ)中,除 VP4 包埋在病毒粒子外壳的内侧与病毒核心紧密连接以外,其他三种结构蛋白均暴露在病毒颗粒的表面,因而抗原决定簇基本上位于VP1-VP3上[10]。本研究Western blot分析显示相对分子量为36、24 kD左右的蛋白条带分别为纯化EV71病毒的VP1、VP3蛋白。
EV71病毒颗粒没有类脂性的包膜,对一般去污剂、75%乙醇、5%甲酚皂溶液等常见消毒液等具有抵抗力,这些都决定了该病毒较强的野外生存能力[12,13]。EV71病毒耐酸、耐热,极易在湿热环境下传播繁殖,然而对高温(50℃以上)及紫外线的抵抗能力较差。以EV71病毒为常见病原体的手足口病是一种全球性的传染病,其在世界范围内的传播流行给社会造成了极大的恐慌。如今预防EV71感染的疫苗还在研制中,同时仍没有治疗由EV71感染所致疾病的特效药物。近年来,IgY在诊断和治疗应用方面的研究在国内外都已经取得了积极的成果。Wang等[14]研究表明证明了抗金黄色葡萄球菌的卵黄抗体对乳腺炎有治疗作用;叶翠莲等[15]也报道了抗幽门螺杆菌卵黄抗体对幽门螺杆菌感染具有较好治疗效果。本研究利用灭活病毒免疫蛋鸡所获得的抗EV71病毒IgY抗体ELISA检测效价达1∶20 480,具有良好的免疫反应性,相对于传统的哺乳动物抗体制备具有制备简单、成本低、无需杀害动物等优点,为预防和治疗抗EV71药物提供了基础。同时,可再深入通过体外中和活病毒实验和抗EV71动物模型实验检测该特异性抗EV71 IgY体内外抗病毒的能力。因卵黄抗体安全卫生,稳定性好,不易被胰蛋白酶、胃蛋白酶水解失活[16],因此,可通过向饮料及洗手液等产品中添加该特异性抗EV71 IgY,来达到预防及治疗EV71感染。
1 Schmidt N J,Lennette EH,Ho H H.An apparently new enterovirus isolated from patients with disease of the central nervoussystem[J].J Infect Dis,1974;129(3):304-309.
2 Yeo WM,Chow V T.The VP1 structural protein of enterovirus 71 interactswith human ornithinedecarboxylase and gene trap ankyrin repeat[J].Microb Pathog,2007;42(4):129-137.
3 Mong HO,See CW,Penny L et al.Clinical features,diagnosis,and management of enterovirus71[J].Lancet Neurol,2010;11(9):1097-1105.
4 黄 莉,赵德明.卵黄抗体研究进展[J].实验动物科学与管理,2003;20(3):39-41.
5 万晓媛,扈鸿霞,陈 宁 et al.猪繁殖与呼吸综合征病毒N蛋白特异性卵黄抗体的制备与鉴定[J].浙江大学学报(农业与生命科学版),2010;36(3):269-274.
6 张雪梅,盛 军,王玉梅 et al.抗甲3型流感病毒卵黄抗体的研制[J].微生物学免疫学进展,2002;30(3):17-20.
7 De Paula V S,da Silva A D,de Vasconcelos G A et al.Applied Biotechnology for production of immunoglobulin Y specific to hepatitis A virus[J].JVirol Methods,2011;171(1):102-106.
8 张明娟,杨 军,段宗明 et al.抗哇巴因抗体IgY的制备及其应用[J].南方医科大学学报,2007;27(9):1358-1360.
9 南 亚,李宏高.考马斯亮蓝G-250法快速测定牛乳中的蛋白质[J].检测与分析,2007;10(12).41-42.
10 金 奇编.医学分子病毒学[M].北京:科学出版社,2001:606-607.
11 Akita E M,Nakai S.Immunoglobulins from egg yolk:isolation and purification[J].JFood Sci,1992;57(3):629-634.
12 杜厚伟,李 静,刘景勤.肠道病毒71型感染与手足口病的诊治[J].中国实用医药,2009;28(4):83-84.
14 Wang L H,Li X Y,Jin L J et al.Characterization of chicken egg yolk immunoglobulins(IgYs)specific for the most prevalent capsular serotypes of mastitis-causing Staphylococcus aureus[J].Vet Microbol,2011;149(3-4):415-421.
15 叶翠莲,杨致邦,张 吉 et al.融合蛋白VacA-HpaA卵黄抗体的体外研究[J].中国免疫学杂志,2008;24(2):114-118.
16 Shin JH,Yang M,Nam SW et al.Use of Egg Yolk-derived immunoglobulin as an alternative to antibiotic treatment for control of helicobacter pylori infection[J].Clin Diagn Labimmun,2002;9(5):1061-1066.
