五步蛇毒纤溶组分FⅨcaⅠ的分离纯化和生物活性的测定
2011-07-28杨亚萍陈家树
杨亚萍,刘 涛,陈家树,林 熙
(1.暨南大学分析测试中心,广东广州 510632;2.中山大学医学院药理学教研室,广东 广州 510080;3.暨南大学医学院药理学系,广东广州 510632)
蛇毒中除了含有多种致命的神经毒素和细胞毒素外,还含有许多作用于人凝血-纤溶系统的蛋白酶和活性多肽[1-2]。尖吻蝮蛇,又称五步蛇,是我国特有的剧毒蛇种,分布广泛,资源丰富,富含纤溶成分。Liang等[3]已从安徽产五步蛇毒中提取出纤溶酶FⅡa,该组分具有无出血活性,分子量低,纤溶活性强等优点,其基因工程产品亦具有广阔的应用前景。但该蛇毒中是否还存在更具开发价值的纤溶组分,尚不得而知。本研究选用安徽产五步蛇毒干粉,着力于该蛇毒中另一纤溶组分FⅨ的研究,试图从中分离纯化出一种分子量更低,活性更强的新纤溶组分,并对其生化特征和生物学活性等相关内容进行研究。
1 材料与方法
1.1 材料 五步蛇(安徽产)粗毒冻干粉由广州医学院蛇毒研究所提供;DEAE-Sephadex A-50、Sephadex G-75、Sephadex G-50(美国 Parmacia Biotech);Chelating Sepharose Fast Flow(美国Amersham Bioscience);人凝血酶(珠海经济特区生物化学制药厂);牛纤维蛋白原、纤溶酶、标准蛋白质(美国 Sigma Aldrich);尿激酶(广东天普生化医药股份有限公司);昆明系小鼠30只(粤检证字05A064),由中山大学实验动物中心提供。
1.2 仪器 可见/紫外分光光度计、微型双垂直板电泳槽、恒压恒流电泳仪(美国Bio-Rad),J-21型高速离心机(美国 Beckman),电子天平(德国Sartorius),真空冷冻干燥机(美国labconco),凝胶成像设备(英国 UVI-tech公司),BS-100A自动部分收集器、BS-160A自动部分收集器(上海沪西分析仪器厂),凝胶成像设备(英国 UVI-tech公司)。
1.3 方法
1.3.1 五步蛇(安徽产)粗毒的分离纯 DEAESephadex A-50阴离子交换层析:取1.0 g五步蛇(安徽产)粗毒溶于4 ml的50 mmol·L-1(pH 8.0)的乙酸铵缓冲液中,低温离心去沉渣后取上清液。上清液装入用同样缓冲液平衡的DEAE-Sephadex A-50阴离子交换层析柱(2.6 cm×80 cm),洗脱约1 000 ml后,改用 50 mmol·L-1(pH 8.0)和 1.0 mmol·L-1(pH 8.0)的乙酸铵缓冲液各750 ml作直线梯度洗脱,流速 12 ml·h-1[4]。Sephadex G-75凝胶层析:将DEAE-Sephadex A-50离子交换层析得到的纤溶活性组分30 mg溶于1.5 ml以上50 mmol·L-1(pH 8.0)的乙酸铵缓冲液平衡的Sephadex G-75凝胶层析柱 (1 cm×150 cm),流速6 ml·h-1[5]。Chelating Sepharose Fast Flow 金属离子螯合亲和层析:取Sephadex G-75凝胶过滤得到的纤溶活性组分20 mg溶于含50 mmol·L-1NaCl的50 mmol·L-1(pH 7.0)Na2HPO4溶液平衡的 Chelating Sepharose Fast Flow金属离子螯合亲和层析柱(1.6 cm×30 cm),待洗脱约5倍柱床体积后,换用不同pH的上述缓冲液各100 ml作 (pH 7.0~2.0)直线梯度洗脱,流速 36 ml·h-1[6]。Sephadex G-50 凝胶层析:将Chelating Sepharose Fast Flow金属离子鳌合层析得到的纤溶活性组分20 mg溶于50 mmol·L-1(pH 8.0)的乙酸铵缓冲液平衡的Sephadex G-50凝胶层析柱(1 cm ×150 cm),流速6 ml·h-1。以上洗脱液均在280 nm波长下测定光吸收值。
1.3.2 SDS-PAGE电泳 采用 SDS-PAGE垂直平板式电泳[7],分离胶浓度为12%,pH 8.8;浓缩胶浓度为4%,pH 6.8;电极缓冲液采用Tris-甘氨酸,电压100 V,待指示剂进入分离胶后改恒压200 V,电泳时间为1 h。
1.3.3 分子量及等电点测定 用Auto Flex MALDI-TOF-TOF-MS质谱仪检测纤溶酶的分子量。等电聚焦电泳仪检测纤溶酶的等电点。
1.3.4 FⅨcaⅠ降解纤维蛋白(原)活性的分析
1.3.4.1 FⅨcaⅠ降解纤维蛋白原的作用 用0.1 mol·L-1(pH 7.8)Tris-HCl缓冲液配制浓度为1 g·L-1的牛维蛋白原溶液,取 0.5 g·L-1的 FⅨcaⅠ0.15 ml加入牛维蛋白原溶液450 μl中,于37℃温育。分别在 1、5、15、30 min、1、2、8、24 h 各取 20 μl的反应液,立即加入5 μl的等量的电泳上样缓冲液,100℃水浴3 min,以4%的浓缩胶和12%分离胶作 SDS-PAGE[8]。同样以 500 U·L-1的人纤溶酶0.15 ml作对照。
1.3.4.2 FⅨcaⅠ降解纤维蛋白的作用 采用纤维蛋白平板法[9]。取20 μl不同浓度的纤溶酶FⅨcaⅠ于平板表面,每一样品加3点,37℃保温24 h,观察透明圈的形成测量其直径并计算面积(mm2)。同样,在将标准平板于85℃加热30 min制作成的“加热平板”上重复上述试验。用生理盐水作阴性对照,尿激酶作阳性对照。纤维蛋白降解产物同样经过SDS-PAGE分析。取牛纤维蛋白原(50 μl,0.8 g·L-1)和 5 μl凝血酶(100 kU·L-1)混合并于 37℃下温育30 min。形成的蛋白凝块用Tris-HCl缓冲液0.75 ml洗涤 3次,加入 2 kg·L-1的 FⅨcaⅠ0.15 ml继续37 ℃温育,分别在 1,5,15、30 min、1、2、8、24 h时取样加入SDS-PAGE电泳样品处理液作SDS-PAGE。用同样方法以50 U·L-1的人纤溶酶0.15 ml作阳性对照。
1.3.5 FⅨcaⅠ的出血活性 昆明系小鼠(20 ±1)g,随机分成5组,每组6只,用生理盐水将FⅨcaⅠ配制成一系列浓度,(0.25、0.5、0.75、1、1.25 g·L-1)0.1 ml注射于小鼠背部皮下,注射6 h后,处死小白鼠,剥下皮肤,测量注射皮下出血斑的面积对样品剂量作图,从图中求出最小出血剂量,最小出血剂量(minimum hemolytic dose,MHD)定义为引起10 mm直径的出血斑大小所需样品的剂量[10]。
1.3.6 统计学方法 采用SPSS统计分析软件处理。实验数据以±s表示,组间比较采用t检验。
2 结果
2.1 五步蛇组分FⅨcaⅠ的分离纯化 五步蛇粗毒经DEAE-Sephadex A-50阴离子交换层析得到10个蛋白峰(Fig 1A),其中第二峰(FⅡ)和第9峰(FⅨ)具有较强的纤维蛋白溶解活性;第9峰蛋白进一步经Sephadex G-75凝胶过滤层析得到3个蛋白峰(Fig 1B),其中第3峰具有纤溶活性;将第3峰蛋白再经过Chelating Sepharose Fast Flow金属离子螯合亲和层析得到简单洗脱1个峰,梯度洗脱2个峰(Fig 1C),其中梯度洗脱第2峰具有纤溶活性,该峰再经过Sephadex G-50凝胶过滤层析得到的第一个峰即为目的组分FⅨcaⅠ(Fig 1D)。
2.2 FⅨcaⅠ的纯度鉴定、分子量和等电点测定FⅨcaⅠ经SDS-PAGE显示为单一条带,提示FⅨcaⅠ为单链蛋白(Fig 2A)。等电聚焦电泳测定FⅨcaⅠ等点电为4.8(Fig 2B)。质谱MALDI-TDF-MS测得FⅨcaⅠ的分子量为23 ku。
2.3 FⅨcaⅠ蛋白溶解活性的测定
2.3.1 FⅨcaⅠ的纤维蛋白原溶解活性 SDS-PAGE结果显示,FⅨcaⅠ对牛纤维蛋白原的Aα链、Bβ链和γ链均有水解作用,但对Aα链最敏感,15 min内降解完全,Bβ链其次,对γ链不敏感,约24 h后γ链亦出现一定程度的降解(Fig 3A)。人纤溶酶可迅速降解牛纤维蛋白原的Aα链、Bβ链和 γ链(Fig 3B)。
2.3.2 FⅨcaⅠ的纤维蛋白溶解活性 采用纤维蛋白平板法测定 FⅨcaⅠ的纤溶活性。不同浓度(0.0625,0.125,0.25,0.5 g·L-1)的 FⅨcaⅠ 20 μl加到纤维蛋白平板表面。结果显示随着FⅨcaⅠ浓度的增加,其产生的透明溶解圈的面积逐渐增大(Fig 4A)。以透明溶解圈垂直两直径的乘积(R*R)表示纤溶活力的大小(Tab 1),FⅨcaⅠ可溶解纤维蛋白,其作用随剂量的增加而增强。
在普通纤维蛋白平板上,FⅨcaⅠ(0.5 g·L-1)和尿激酶(20 kU·L-1)都能产生明显的纤维蛋白溶解透明圈(Fig 4a);而在加热平板上,FⅨcaⅠ(0.5 g·L-1)出现纤维蛋白溶解圈,而尿激酶(20 kU·L-1)却没有纤溶现象(Fig 4b),说明 FⅨcaⅠ的纤溶机制与尿激酶不同,提示FⅨcaⅠ是以直接溶解纤维蛋白为主要作用方式。

Fig 1 The purification of FⅨcaⅠ
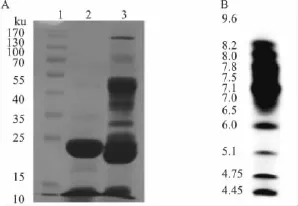
Fig 2 Electrophoresis of FⅨcaⅠ
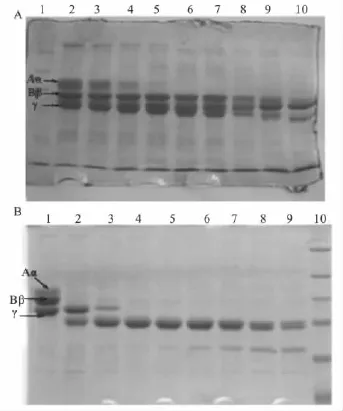
A:Fibrinogenolytic activity of FⅨcaⅠ;Lane 1:mixture of molecular weight standards;Lane 2:bovine fibrinogen;Lane 3~10:bovine fibrinogen incubated with FⅨcaⅠ in different time intervals:1,5,15,30 min,1,2,8,24 h;B:Fibrinogenolytic activity of plasmin;Lane 1:bovine fibrinogen;Lane 2~9:bovine fibrinogen incubated with plasmin in different time intervals:1,5,15,30 min,1,2,8,24 h;Lane 10:mixture of molecular weight standards
SDS-PAGE结果显示,FⅨcaⅠ可降解纤维蛋白的α链、β链和γ-γ二聚体,8 h后才出现α链和γγ二聚体的少量降解,24 h后降解明显,人纤溶酶可迅速降解牛纤维蛋白的α链、β链和γ-γ二聚体,且人纤溶酶与FⅨcaⅠ降解纤维蛋白原产生的降解产物也不相同(Fig 5 A,B)。
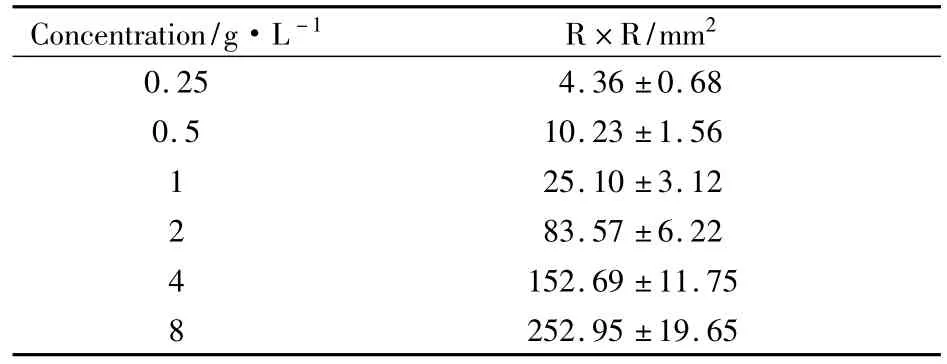
Tab 1 Fibrinolytic activity of FⅨcaⅠ(n=3)
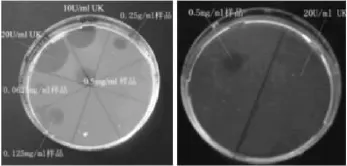
Fig 4 Fibrinolytic activity of FⅨcaⅠ

Fig 5 SDS-PAGE analysis of bovine fibrin cleavage by FⅨcaⅠand plasmin
2.4 FⅨcaⅠ的出血活性 不同浓度FⅨcaⅠ(0.25、0.5、0.75、1、1.25 g·L-1)0.1 ml注射于小鼠背部皮下,6 h后处死小鼠测量出血点直径分别为(5.12 ± 0.23)、(8.57 ± 0.42)、(14.48 ±0.66)、(16.34 ± 0.58)、(22.93 ± 0.37)mm。计算最小出血剂量(MHD)为54.9 μg。
3 讨论
血栓栓塞性疾病是目前临床上发病率及病死率均很高的一类疾病。蛇毒纤溶酶在治疗血栓栓塞性疾病方面有其独特的优势[11]。首先,这类酶不像t-PA等受到血浆丝氨酸蛋白酶(serine proteinase inhibitors,SERINs)的抑制,能保证其长效的发挥作用;其次,蛇毒纤溶酶除降解纤维蛋白原和纤维蛋白外,不水解其它凝血因子和血小板膜,因而蛇毒纤溶酶的底物特异性比血纤溶酶更专一,从安全角度出发,具有良好的开发价值;再次,对蛇毒纤溶酶蛋白质氨基酸序列进行分析,发现蛇毒纤溶酶与神经生长因子的N末端序列高度同源,达到80% ~90%,因此蛇毒纤溶酶具有神经生长因子作用,对受损的神经细胞有营养作用,这与rtPA的作用恰好相反。
本研究中,五步蛇(安徽产)粗毒经四步分离纯化得到具有明显纤溶活性组分FⅨcaⅠ,分子量为23 ku,等电点为4.8,为单链蛋白,进一步对其生物活性测定,FⅨcaⅠ既可以溶解纤维蛋白原又可以溶解纤维蛋白,且其溶解作用随着作用时间的延长而增强。结果显示:FⅨcaⅠ可降解纤维蛋白(原)的α链、β链和γ-γ二聚体,对 Aα链最敏感,FⅨcaⅠ优先裂解纤维蛋白原的Aα链,然后缓慢裂解Bβ链,这同大多数具有纤溶活性的蛇毒金属蛋白酶的选择性作用相同。温育较长时间(浓度为0.5 g·L-1的FⅨcaⅠ与纤维蛋白原共育约24 h)后,γ链开始降解,且产物也不同于人纤溶酶,提示二者的水解方式不同。蛇毒纤溶酶与血纤溶酶的分子结构完全不同,它们对纤维蛋白原的裂解机制及裂解位点也不同,对于一般的金属蛋白酶性质的蛇毒纤溶酶而言,作用机制是因为水分子在锌离子作用下发生极化,质子转移至144位的谷氨酸残基,随后OH-对底物的赖氨酸残基中的H原子发动攻击,造成413Lys-414Leu键断裂,继而发生降纤作用[12],但实际上各种蛇毒纤溶酶的作用位点并不完全相同。
通过采用纤维蛋白平板法测定FⅨcaⅠ的纤溶活性,并经过普通平板与加热平板的对比测定发现,FⅨcaⅠ与尿激酶的溶纤机制不同,尿激酶是通过激活纤溶酶原间接溶栓,而FⅨcaⅠ是直接起效。这是由于纤维蛋白原与纤溶酶原以结合状态存在,所以在纤维蛋白原制剂中一般都混杂有少量的纤溶酶原。在凝血酶作用下,纤维蛋白板凝结,点入尿激酶后,残留在纤维蛋白原中的纤溶酶原激活成纤溶酶进而溶解纤维蛋白。在加热平板上,纤溶酶因为加热失活,故尿激酶在加热平板上无作用;而FⅨcaⅠ在加热平板上仍保持着溶解纤维蛋白的能力。经SDS-PAGE电泳发现,FⅨcaⅠ的纤溶作用是通过直接降解纤维蛋白的α链、β链和γ-γ二聚体,但作用较慢。同时FⅨcaⅠ不具有类凝血酶或促凝因子活性,这与目前尚未有兼有纤溶和促凝双重活性的蛇毒纤溶酶报道一致,因此其作用方式是单一的,不具有双向作用。
我们还检测了FⅨcaⅠ的酶学特征,证实FⅨcaⅠ为金属蛋白酶,EDTA和DTT可明显抑制其活性,PMSF可轻度抑制其活性,而抑肽酶对其活性无影响。Ba2+、Ca2+、Mg2+可增强 FⅨcaⅠ的酶活性,而Zn2+、Ni2+、Cu2+可抑制其活性。酶的适宜pH为7~10,适宜温度为30~50℃,其适宜pH偏碱性,都与人的体液外环境相符合,提示其具有较好的应用前景。
综上所述,本研究从五步蛇(安徽产)毒分离纯化的FⅨcaⅠ是一种新的纤溶活性强,无出血活性的蛇毒纤溶酶,为开发新的溶栓药物和研究蛇毒纤溶酶三维结构与出血活性关系提供基础。
[1] Seegers W H,Ouyang C.Snake Venoms[M].Berlin:Springer,1979:684-750.
[2] Markland F S.Snake venoms and hemostatic system[J].Toxicon,1998,36(12):1749-800.
[3] Liang X X,Chen J S,Zhou Y N,et al.Purification and biochemical characterization of FIIa,a fibrinolytic enzyme from Agkistrodon acutus venom[J].Toxicon,2001,39(8):1133 -9.
[4] Huang T F,Chang M C,Peng H C,Teng C M.A novel alphatype fibrinogenase from Agkistrodon rhodostoma snake venom[J].Biochim Biophys Acta,1992,1160(3):262-8.
[5] Sanchez E F,Santos C I,Magalhaes A,et al.Isolation of a proteinase with plasminogen-activating activity from Lachesis muta muta(bushmaster)snake venom[J].Arch Biochem Biophys,2000,378(1):131-41.
[6] Lawung R,Prachayasittikul V,Bülow L.Purification and characterization of a beta-lactamase from Haemophilus ducreyi in Escherichia coli[J].Protein Expr Purif,2001,23(1):151 -8.
[7] 陈 洲,黄剑钧,薛 玲,等.眼镜蛇毒L-氨基酸氧化酶分离纯化及对血管内皮细胞的抑制作用[J].中国药理学通报,2009,25(3):1024-8.
[7] Chen Z,Huang J J,Xue L,et al.Purification of L-amino acid oxidase from Naja atra venom and its effects on endothelial cells[J].Chin Pharmacol Bull,2009,25(3):1024 -8.
[8] 江伟健,邱鹏新,颜光美.基因重组蛇毒纤溶因子rFⅡ理化特性及纤溶能力的研究[J].中山大学学报(医学科学版),2005,26(3):245-9.
[8] Jiang W J,Qiu X P,Yan G M.Studies on enzyme characteristics of recombinant fibrinolytic enzyme of Agkistrodon acutus venom[J].J Sun Yat-sen Univ(Med Sci),2005,26(3):245-9.
[9] 黎肇炎,雷丹青,杨 斌,等.尖吻蝮蛇毒无出血活性纤维蛋白溶解酶的纯化及其理化性质研究[J].广西医科大学学报,2003,20(2):157-60.
[9] Li Z Y,Lei D Q,Yang B,et al.Purification and characterization of non-hemorrhagic fibrinolytic enzyme from Agkistrodon acutus[J].J Guangxi Med Univ,2003,20(2):157 -60.
[10] Baramova E N,Shannon J D,Bjarnason J B,Fox J W.Degradation of extracellular matrix proteins by hemorrhagic metalloproteinases[J].Arch Biochem Biophys,1989,275(1):63 - 71.
[11] Verstraete M,Lijnen H R,Collen D.Thrombolytic agents in development[J].Drugs,1995,50(1):29 -42.
[12] Doolittle R F.The structure and evolution of vertebrate fibrinogen[J].Ann N Y Acad Sci,1983,408(2):13 -27.
