紫杉醇对PTEN不同状态的子宫内膜癌细胞株的作用及其机制探讨
2011-07-28许成芳李小毛王小韵
许成芳,李小毛,李 田,王小韵
(中山大学附属第三医院妇产科,广东广州 510630)
PTEN基因(phosphatase and tension homolog deleted on chromosome ten)作为一个抑癌基因,与肿瘤的发生发展、转移以及耐药性的产生密切相关。有研究发现,多数子宫内膜癌中都存在PTEN基因的突变,是目前已知的子宫内膜癌中突变率最高的基因[1]。紫杉醇是一种新型的治疗子宫内膜癌的化疗药物,其抗肿瘤机制主要是引起细胞DNA产生不可修复的损伤从而导致细胞凋亡[2]。紫杉醇在临床上的应用日益广泛,但是其非特异性的毒副作用以及晚期或复发的子宫内膜癌患者对其耐药性的增加大大限制了紫杉醇在临床上的应用[3]。因此,本研究拟通过比较紫杉醇对不同PTEN基因状态的子宫内膜癌细胞的作用,探讨PTEN基因在影响紫杉醇疗效中的作用及其可能机制。
1 材料与方法
1.1 细胞株及慢病毒载体 人子宫内膜癌细胞株Ishikawa细胞及HEC-1A细胞由广州市中山大学第三附属医院中心实验室提供。人PTEN基因RNAi慢病毒载体和PTEN基因过表达慢病毒载体购自上海吉凯基因化学有限公司。
1.2 主要试剂 胎牛血清、DMEM培养基购自美国Gibco公司;兔抗 p-AKT单抗购自美国Cell Signaling Technology公司;鼠抗人PTEN购自美国Santa Cruz Biotechnology公司;鼠抗β-actin多克隆抗体购自美国Sigma公司;细胞总蛋白提取试剂盒购自美国Pierce公司;蛋白分子量Marker购自日本Fermentas公司;Annexin V-FITC凋亡试剂盒购自北京宝赛生物技术有限公司。
1.3 实验方法
1.3.1 细胞培养 Ishikawa及 HEC-1A培养于含10%胎牛血清的DMEM培养基中,培养条件在5%CO2、饱和湿度及37℃下进行。
1.3.2 PTEN基因过表达慢病毒载体和小分子干扰RNA表达慢病毒载体稳定转染 收集对数生长期的细胞,Ishikawa细胞以2.5×105/孔,HEC-1A细胞以5×104/孔铺于6孔板中。Ishikawa细胞按MOI为10,HEC-1A细胞按MOI为50进行慢病毒转染,分别设对照组和目的基因病毒转染组。转染4 h后将无血清培养基换为含10%胎牛血清的培养基继续培养。
1.3.3 MTT实验 以5×103/孔接种细胞于96孔板中,培养24 h后分别按浓度梯度予紫杉醇:0.1、1、5、10、20、50、100 mg·L-1,并分别于加药 24、48、72 h后检测。每孔加入MTT溶液20 μl继续孵育4 h,然后每孔加入150 μl DMSO,振荡10 min,用酶联免疫检测仪读取每孔的吸光度(A)值,绘制细胞增殖曲线。细胞存活率/%=A试验组/A对照组×100%,根据Sigma-plot软件计算紫杉醇24 h的IC50值。实验重复3次,每次、每时段均设3复孔。
1.3.4 流式细胞仪检测细胞凋亡情况 按6 mg·L-1浓度紫杉醇作用于细胞24 h,胰酶消化,1 000 r·min-1离心5 min去除培养基,PBS洗涤1次,弃上清,收集细胞。100 μl PBS重悬细胞,分别加入Annexin V-PE和7-AAD试剂各2.5 μl,室温中避光孵育30 min,1 h内流式细胞仪(FACS Calibur,Becton-Dickinson公司)检测。培养基+细胞组作为空白对照组。结果用Cell Quest软件分析。
1.3.5 Western blot检测 提取细胞蛋白,BCA法定量,取等量样本上样于10%SDS-PAGE凝胶电泳,100 V,电泳至溴酚蓝达分离胶,加大电压至200 V,直至溴酚蓝达凝胶的底部,并转移至硝酸纤维素膜上,室温封闭1 h,一抗4℃孵育过夜,二抗室温孵育1 h,加入ECL化学发光试剂检测。结果用Quantity One软件进行条带分析。
1.4 统计学分析 所有实验数据采用SPSS11.5软件进行分析,以±s表示,两组均数间的比较采用t检验,各样本均数间比较采用方差分析。
2 结果
2.1 紫杉醇作用后子宫内膜癌细胞增殖情况的变化 MTT实验显示,紫杉醇(6 mg·L-1)可明显抑制子宫内膜癌细胞,包括未转染的HEC-1A细胞(PTEN阳性)和Ishikawa细胞(PTEN阴性)以及转染后的HEC-RNAi细胞(PTEN阴性)和Ishikawa-PTEN细胞(PTEN阳性)的生长,其抑制率与时间、剂量成正相关(Fig 1)。
与 Ishikawa细胞(PTEN阴性)相比,过表达PTEN基因(Ishikawa-PTEN细胞)可明显降低紫杉醇作用24 h的 IC50,其差异有统计学意义(P<0.05)。而在HEC-1A细胞中,敲除PTEN基因后,紫杉醇作用24 h的IC50明显升高(P<0.05)。
2.2 紫杉醇作用后子宫内膜癌细胞凋亡率的变化
用紫杉醇(6 mg·L-1)作用于不同PTEN基因状态的子宫内膜癌细胞24 h,采用流式细胞术检测处理前后细胞的凋亡率变化。结果发现,与未用药组相比,紫杉醇处理后细胞凋亡率明显升高。对比紫杉醇处理不同PTEN基因状态的子宫内膜癌细胞发现,Ishikawa-PTEN细胞的凋亡率(55.00% ±5.86%)明显高于 Ishikawa细胞(13.35% ±1.78%),P<0.05;HEC-1A细胞的凋亡率(21.70%±2.37%)明显高于 HEC-1A-RNAi的凋亡率(13.35% ±1.78%),P<0.05(Fig 2)。以上结果提示,PTEN基因阳性的细胞对紫杉醇更敏感。
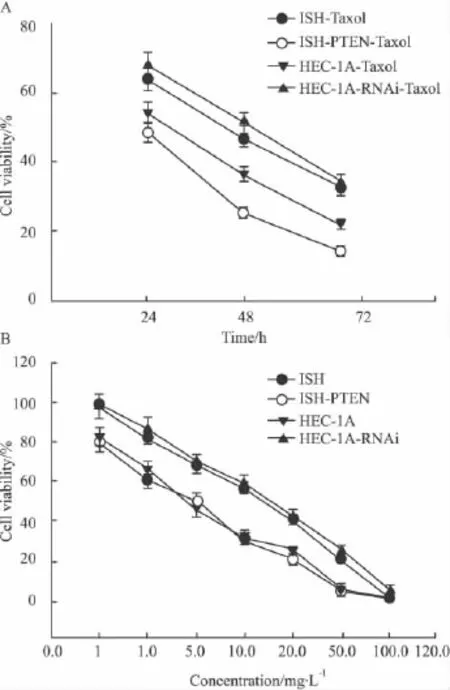
Fig 1 Effects of taxol on proliferation in endometrial cancer cells(±s,n=3)
2.3 紫杉醇作用后子宫内膜癌细胞中磷酸化AKT及Caspase-3的变化 Western blot结果显示,与Ishikawa细胞(PTEN阴性)相比,过表达PTEN基因(Ishikawa-PTEN细胞)可以明显降低磷酸化AKT蛋白的表达,上调Caspase-3的蛋白水平;而在HEC-1A细胞中,敲除 PTEN基因后(HEC-1A-RNAi细胞)磷酸化AKT蛋白的表达上升,Caspase-3的蛋白水平下降。紫杉醇(6 mg·L-1)作用24 h均可明显下调细胞的磷酸化AKT蛋白水平以及上调Caspase-3的蛋白水平,但在PTEN阳性的细胞中磷酸化AKT以及Caspase-3蛋白变化更加明显,差异有统计学意义(P<0.05)(Fig 3)。
3 讨论
紫杉醇在子宫内膜癌化疗中的应用日益广泛,但许多复发或晚期子宫内膜癌患者对紫杉醇作用不敏感,其原因尚不清楚。因此,除了常规治疗外,选择分子标记物来预测或者改善子宫内膜癌对紫杉醇敏感性,将为临床合理选用化疗药物提供理论依据[6-7]。PTEN基因是迄今发现的第1个具有磷酸酶活性的抑癌基因,其突变和杂合性缺失常见于多种晚期原发性恶性肿瘤。目前的研究发现,PTEN基因在子宫内膜癌组织中的突变率最高,常发生在子宫内膜癌病变的早期阶段[8-9]。因此,本研究通过构建人PTEN基因RNA干扰和PTEN基因过表达慢病毒载体,分别建立PTEN基因敲除和过表达的细胞模型,从而探讨PTEN基因在紫杉醇治疗子宫内膜癌中的作用。

Fig 2Effects of taxol on apoptosis in endometrial cancer cells(±s,n=3)
我们的实验发现,紫杉醇可以抑制子宫内膜癌细胞的增殖,诱导细胞凋亡。尤其是在PTEN基因阳性的细胞,其作用更加明显。与PTEN阴性的细胞相比,紫杉醇在PTEN阳性细胞的IC50明显降低,细胞抑制率增加,细胞凋亡率增加,提示PTEN基因能增强紫杉醇的细胞毒性。
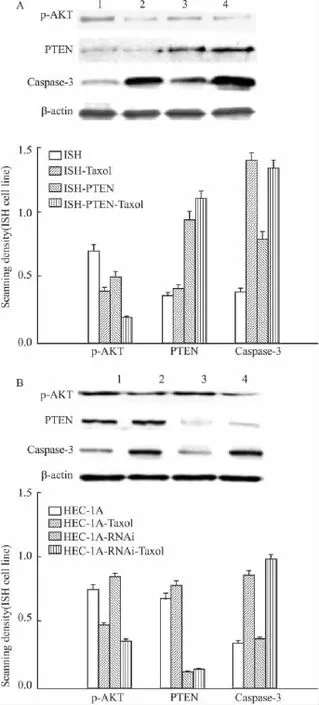
Fig 3 Effects of taxol on the expression of P-AKT and Caspase-3 in endometrial cancer cells(±s,n=3)
PTEN基因能够增强紫杉醇对子宫内膜癌细胞抑制作用的机制尚未阐明。有研究表明,磷酸肌醇3激酶/蛋白激酶B(phosphoinositide kinase/protein kinase B,PI3K/AKT)是PTEN作用的下游信号通路,其在肿瘤的发生发展和治疗过程中起重要作用[11-12]。尤其是 AKT通路,其与肿瘤细胞耐药性的产生密切相关,抑制该通路可增加肿瘤化疗或放疗的敏感性[13-14]。我们的研究发现紫杉醇处理子宫内膜癌细胞后,磷酸化AKT蛋白的表达下降,Caspase-3的表达上调,提示紫杉醇可能是通过PI3K/AKT信号通路,增加Caspase-3蛋白的表达,进而诱导子功能内膜癌细胞凋亡。有趣的是,这种变化在PTEN阳性的细胞中更加明显。将PTEN基因敲除后,磷酸化AKT蛋白水平增加,Caspase-3的表达下降;而PTEN缺失的细胞重新表达PTEN蛋白后,则出现相反的改变。以上结果提示PTEN基因是通过PI3K/AKT信号途径增强紫杉醇诱导凋亡的作用的。
因此,子宫内膜癌患者化疗选用细胞毒性药物-紫杉醇时,应考虑患者的PTEN基因状态,这将为临床个体化用药提供新的资料。同时,PTEN基因的导入可提高子宫内膜癌细胞株对紫杉醇的敏感性,PTEN基因有望成为治疗的子宫内膜癌的新的靶点。
[1] Carracedo A,Alimonti A,Pandolfi P P.Pten level in tumor suppression:How much is too little[J].Cancer Res,2011,71:629 -33.
[2] 魏向阳,涂 悦,徐忠伟,等.紫杉醇对U373细胞周期阻滞及增殖抑制的机制研究[J].中国药理学通报,2011,27(4):543-7.
[2] Wei X J,Tu Y,Xu Z W,et al.The mechanism of the induction of cell cycle arrest and inhibition on U373 cells by PTX[J].Chin Pharmacol Bull,2011,27(4):543 -7.
[3] Lincoln S,Blessing J A,Lee R B,et al.Activity of paclitaxel as second line chemotherapy in endometrial carcinoma:A gynecologic oncology group study[J].Gynecol Oncol,2003,88:277 - 81.
[4] 熊 飞,詹 瑧,唐于平,等.PI3K/Akt信号转导通路在非小细胞肺癌中的作用[J].中国药理学通报,2010,26(10):1264-7.
[4] Xiong F,Zhan Z,Tang Y P,et al.The effect of PI3K/Akt signal transduction pathway in non-small cell lung cancer[J].Chin Pharmacol Bull,2010,26(10):1264 -7.
[5] Salvesen H B,Stefansson I,Kretzschmar E I,et al.Significance of pten alterations in endometrial carcinoma:A population-based study of mutations,promoter methylation and pten protein expression[J].Int J Oncol,2004,25:1615 - 23.
[6] Dedes K J,Wetterskog D,Ashworth A,et al.Emerging therapeutic targets in endometrial cancer[J].Nat Rev Clin Oncol,2011,8:261-71.
[7] Zuo Q,Shi M,Li L,et al.Development of cetuximab-resistant human nasopharyngeal carcinoma cell lines and mechanisms of drug resistance[J].Biomed Pharmacother,2010,64:550 - 8.
[8] James V L,Hannah Y,Mia M G,et al.Endometrial cancer and genetic variation in PTEN,PIK3CA,AKT1,MLH1,and MSH2 within a population-based case-control study[J].Gynecol Oncol,2011,120(2):167-73.
[9] Nisha B,Vimala Y,Robert M W.The molecular biology of endometrial cancers and the implications for pathogenesis,classification,and targeted therapies[J].Cancer Control,2009,16(1):8-13.
[10] Odonkor C A,Achilefu S.Modulation of effector caspase cleavage determines response of breast and lung tumor cell lines to chemotherapy[J].Cancer Invest,2009,27:417 - 29.
[11] Anna D,Sungeun K,Richard J S,et al.The role of PTEN/Akt/PI3K signaling in the maintenance and viability of prostate cancer stem-like cell populations[J].PNAS,2009,106(1):268 -73.
[12] Echeverria C G,Sellers W R.Drug discovery approaches targeting the PI3K/Akt pathway in cancer[J].Oncogene,2008,27:5511-26.
[13] Ali I U.Gatekeeper for endometrium:The pten tumor suppressor gene[J].J Natl Cancer Inst,2000,92:861 -3.
[14]谢 霞,高 青,王艳丽,等.抑制PI3K/PKB信号通路提高胃癌细胞化疗敏感性的研究[J].中国药理学通报,2008,24(12):1666-70.
[14] Xie X,Gao Q,Wang Y L,et al.Inhibition of PI3K/PKB signal pathway improves chemotherapeutic effect on gastric carcinoma cell lines[J].Chin Pharmacol Bull,2008,24(12):1666 - 70.
