尼泊尔菊三七的离体快繁技术研究
2011-07-28贾景明
高 倩,李 娜,贾景明
(沈阳药科大学,辽宁 沈阳 110016)
尼泊尔菊三七 Gynura nepalensis DC.为菊科菊三七属植物,以地上部位入药,为多年生草本植物,是我国最新发现的极具药用价值的珍贵物种。该植物中含有大量具有药理活性的生物碱、萜烯、苷类、黄酮、糖类、有机酸等化学成分[1],其中黄酮类和多糖类成分具有明显的降血糖作用。其主要分布在尼泊尔、缅甸、不丹、锡金和我国的贵州、云南等地,生长于海拔1100~2100 m的地区,见于溪边岩石上和田边[2]。由于其对气候要求高,受繁殖方法和繁殖速度的影响,目前尚未人工引种栽培,而野生资源已远不能满足市场需求。离体快繁技术通常包括4个环节:无菌培养体系的建立,培养物的增殖,器官的分化,植株的生成和移栽[3]。笔者通过茎段诱导丛生芽建立的离体快繁体系能在短时间内提供优质种苗,实现人工大规模栽培,对开发该药用植物具有重要意义,报道如下。
1 材料和试剂
尼泊尔菊三七新鲜野生植株,采集于云南腾冲,经沈阳药科大学孙启时教授鉴定为尼泊尔菊三七。MS培养基,6-苄氨基嘌呤(6-BA),萘乙酸(NAA),蔗糖,琼脂,酒精,升汞。
2 方法与结果
2.1 外植体的准备
将3~6个月尼泊尔菊三七的幼嫩茎段用洗洁精清洗干净后,再用蒸馏水浸泡数小时,沥干水滴,备用。
2.2 外植体的灭菌与接种
将清洗好的尼泊尔菊三七茎段,放入烧杯中,用75%的乙醇溶液处理10~40 s,用0.1%的升汞溶液浸泡4~8 min,浸泡期间不断摇动,使灭菌剂升汞和外植体充分接触,进行表面消毒,再用无菌蒸馏水清洗5~6次,将经过消毒后的茎段切成0.5~1.0 cm且含有一个茎节的茎段,进行接种诱导正交试验,确定其最佳消毒时间。以 75% 乙醇(因素 A)、0.1% 升汞(因素B)消毒时间为考察因素,诱导率和染菌率为指标进行正交试验,因素水平表见表1,试验结果见表 2。可见,最佳搭配为 A2B3,即用乙醇消毒20 s和升汞消毒6 min,诱导率最高且染菌数目最少。
2.3 试管苗的增殖培养
采用MS培养基,其中含有3%蔗糖、0.5%琼脂,pH为6.0。培养温度为(25±1)℃,光照时间为每天12h,光照强度为1400μmol/(m2·s)。设定好乙醇和升汞灭菌时间的同时,在MS培养基上,分别添加不同质量浓度的 NAA(0,0.2,0.5,1.0 mg/L)和 6-BA(1.0,2.0,3.0,4.0 mg/L)。培养45 d后,进行幼芽增殖统计,计算芽诱导率(出芽的外植体数/接种的外植体数),确定最佳外源激素配比。以6-BA(因素A)、NAA(因素B)的质量浓度为考察指标,繁殖率为指标进行正交试验,因素水平表见表3,试验结果见表4。在培养过程中,尼泊尔菊三七的茎段诱导成苗需要较长的时间,一般20 d后肉眼才能观察到其形态变化。最初生长的小芽为嫩黄白色,随着时间的延长逐渐转变为黄绿色。经过45 d的继代培养,细胞分裂素6-BA均能诱导含有腋芽的尼泊尔菊三七茎段产生腋芽苗。由表4可知,各因素的最优水平为A1和B3,即尼泊尔菊三七的继代培养基添加剂素分别为NAA 0.5 mg/L和6-BA 1.0 mg/L,该激素浓度下的增殖倍数最大,达到4.8倍。

表1 尼泊尔菊三七的灭菌供试因素水平表
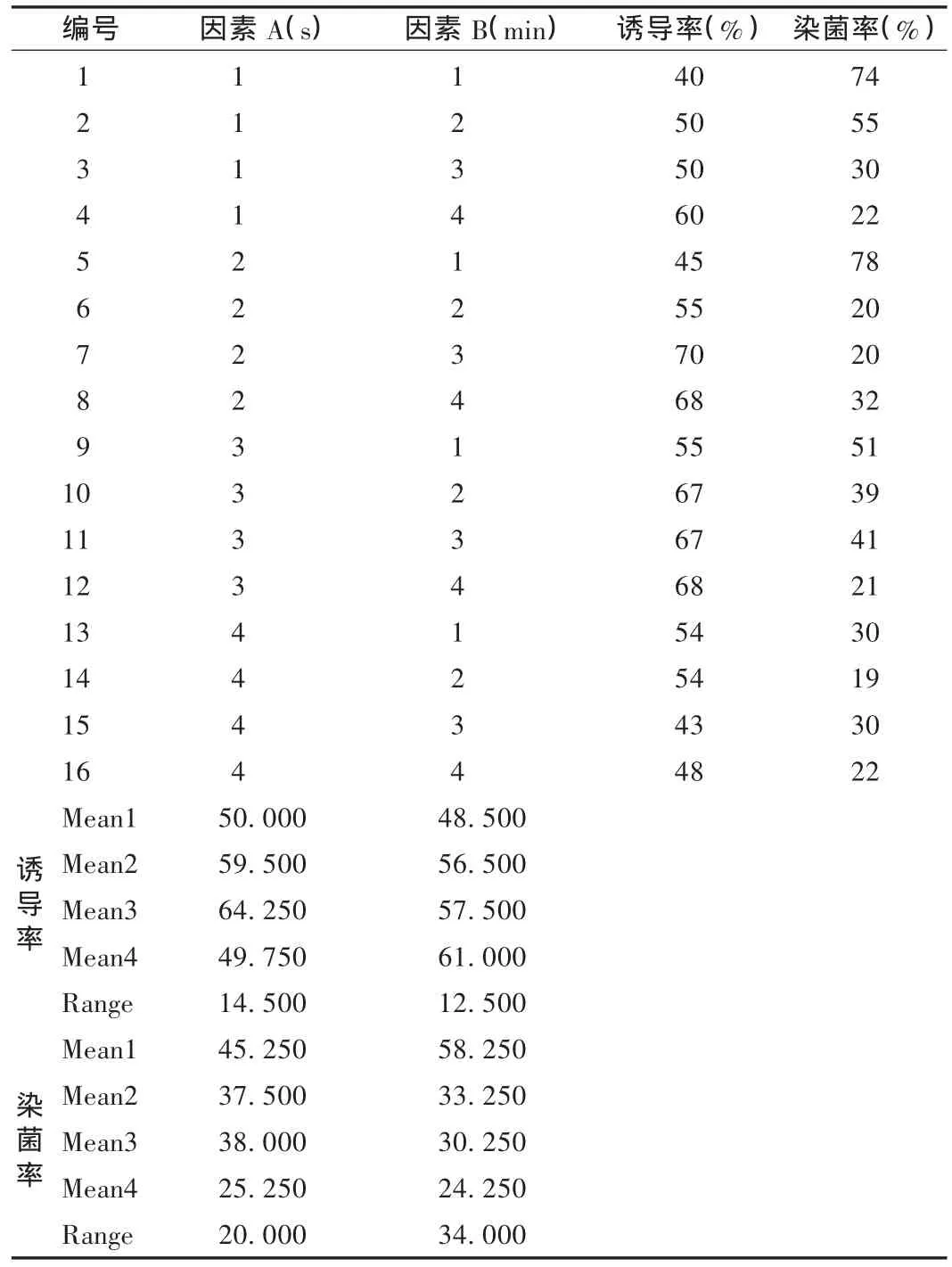
表2 尼泊尔菊三七的灭菌正交试验表 L16(45)

表3 尼泊尔菊三七丛生芽诱导供试因素水平表
2.4 壮苗与生根培养
将 2.5~3.0 cm 高的试管小苗接种于 1,1/2,1/4,1/6 MS4 种培养基并附加 6-BA1.0 mg/L、NAA 0.5 mg/L、30 g/L 蔗糖、2 g/L活性炭进行生根培养,45 d后观察生长情况,统计生根率并确定无机元素最适合浓度。同时考察添加不同浓度的活性炭(1,2,5 g/L)对其壮苗和生根培养的影响,培养60 d,统计生根率并且确定添加活性炭最佳浓度(生根率=接种后的生根苗数/接种的试管苗数)。结果见表5和表6。在植物离体快繁过程中,试管苗生根培养是最重要的步骤,是进行移栽成苗的基础[4]。通过调整基本培养基中的无机元素成分和含量,可以解决植物繁殖困难、生根率低的问题[5]。由表5可知,1/2MS培养基中根最长,须根生长旺盛,生根率最高,为85%。活性炭的浓度在一定程度上会影响无菌苗的生根情况[5]。由表6可知,活性炭质量浓度为2.0 g/L时,植株的生理状态最佳,生根率最高,平均每株根数最多,主根比较长,须根也生长旺盛。
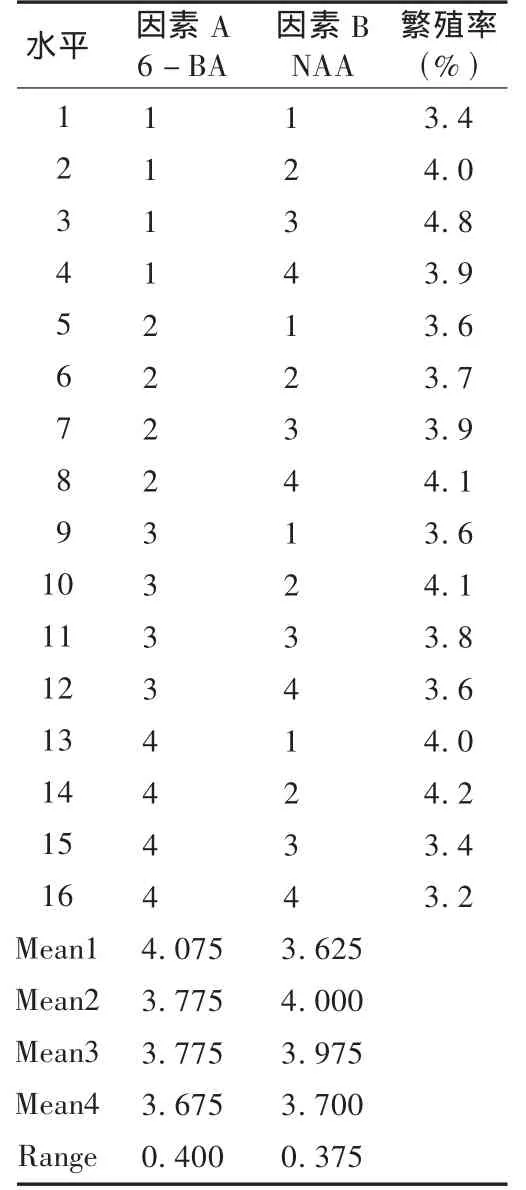
表4 尼泊尔菊三七的增殖培养基正交试验表 L16(45)
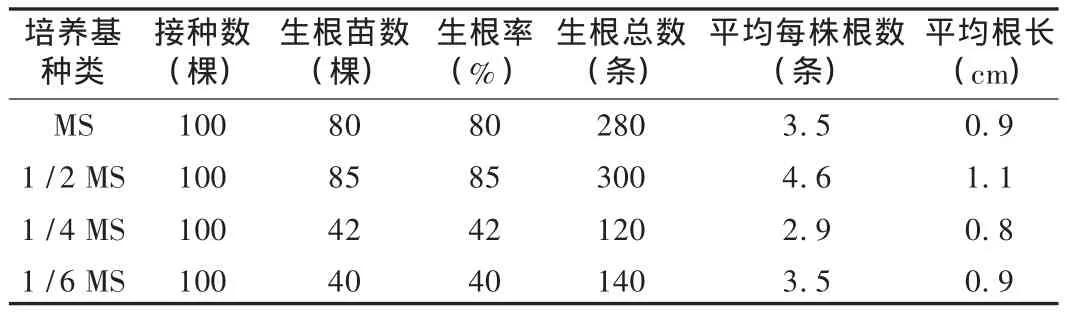
表5 无机元素浓度对尼泊尔菊三七生根的影响

表6 活性炭浓度对尼泊尔菊三七生根的影响
2.5 炼苗与移栽
尼泊尔菊三七在壮苗与生根培养基上生长45 d后,苗高度达到10 cm左右时,选取其中植株健壮、根系发达的组培苗,将敞开的组培瓶置室温炼苗5~7 d后,除去根部的残留培养基并植于含细砂的腐殖土中,保湿10~15 d,直接移栽到不同组成的基质中考察其在不同基质中的生长情况,待苗生长健壮后,移植于大地栽培。结果见表7。
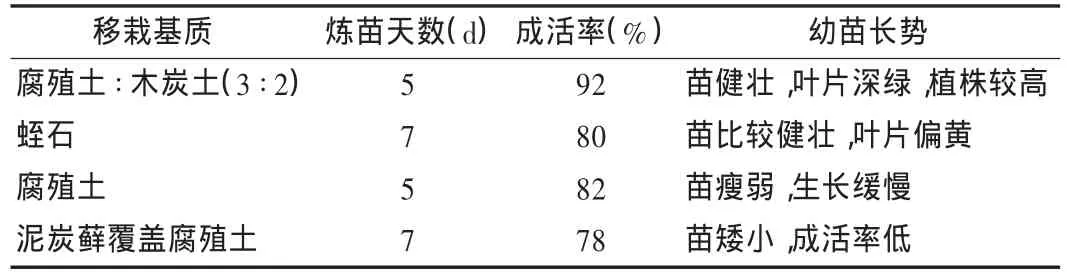
表7 试管苗在不同移栽基质中的生长情况
3 讨论
以尼泊尔菊三七的茎段作为外植体,在以往文献报道的配方基础上[6],改变消毒时间诱导得到无菌苗,最佳条件为乙醇消毒20 s,升汞消毒6 min。消毒时间越长,消毒剂对外植体的影响越大,外植体的染菌率虽能有所下降,但试管苗诱导率、长势与污染率成反比。由外植体诱导的试管苗通过更换激素种类和浓度,运用16种培养基对腋芽试管苗进行增殖培养,其中MS+NAA 0.5 mg/L+6-BA 1.0 mg/L+30 g/L蔗糖+2 g/L活性炭最适合尼泊尔菊三七的试管苗增殖培养。其中6-BA的质量浓度不宜过高,否则会刺激外植体的多酚氧化酶活性,加之试管苗在瓶中生长,容易产生乙烯,使得试管苗褐变现象加深,而且容易出现玻璃化现象[7],其茎不易生根且繁殖系数下降。含有不同浓度无机元素的培养基和不同浓度活性炭对生根的试验表明,1/2 MS是最适宜的生根基本培养基,当活性炭质量浓度为2 g/L时,尼泊尔菊三七生根速度最快[8]。添加活性炭浓度过高时,培养基中的成分被其吸附,使苗的生长发育受阻;浓度适当,可以使培养基环境变黑,有利于试管苗的生根和阻止在生长过程中释放酚类物质,促进生长。关于尼泊尔菊三七的研究还比较少,本试验结果为保护该物种及今后更全面的研究与开发奠定了基础。
[1]闵伶俐,唐源宏.菊三七属植物研究进展[J].中药材,2009,32(8):1322-1325.
[2]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1988,77(1):314.
[3]谢从华.植物细胞工程[M].北京:高等教育出版社,2004:97-99.
[4]Kevers C,Hausman JF,Fairre-Rampant O,et al.Hormonal control of adventitious rooting:progress and questions[J].J App Bot,1997,71:71-79.
[5]Ramage CM,Williams RR.Mineral.Nutrition and plant morphyogenesis[J].In Virto Cell Dev Biol Plant,2002,38:116-124.
[6]杨 桦,邓小梅,龙 蔚.菊三七的组织培养[J].江西林业科技,2000(6):11-12.
[7]张 鹏,傅爱国,王爱同.AgNO3在植物离体培养中的作用及可能机制[J].植物生理学通讯,1997,33(5):376.
[8]刘用生,李友勇.植物组织培养活性炭的使用[J].植物生理学通讯,1994,30(3):24.
