水热法制备SrF2:Ce3+,Tb3+荧光粉及其发光性质研究
2011-07-26霍涌前陈小利王升文张纷飞
霍涌前,陈小利,王升文,王 潇,张纷飞
(延安大学化学与化工学院,陕西 延安 716000)
由于Tb具有5D4→7F5等特征能级跃迁使之成为国内外研究的首选激活剂,掺杂Ce3+的Tb3+掺杂材料的发光性能会得到较大的提高。如LaPO4:Ce,Tb[1,2]、Sr2MgSi3O9:Ce3+,Tb3+[3]、LaF3:Ce,Tb[4]、CaYAl3O7:Ce3+,Tb3+[5]、SrAl2O4:Tb3+,Ce3+[6]等,这类稀土离子双掺杂发光材料的发光颜色分为三类:蓝绿光、黄绿光、绿光,相应的发光机理为Ce3+被紫外光激发后,可以将吸收的能量直接传递给Tb3+,使得Tb3+的绿色发光强度显著增强[7]。目前,国内对于Ce3+和Tb3+共掺杂的SrF2发光材料的研究还很少。
作者在此通过水热法合成了Ce3+、Tb3+共掺杂的SrF2发光材料,研究了掺杂量、水热反应时间、激发波长等对其发光性能的调控作用,并讨论了掺杂离子间的能量传递现象。
1 实验
1.1 试剂
Sr(NO3)2、Ce(NO3)3、NH4F、Tb4O7(99.99%,上海跃龙稀土新材料有限公司)、N,N-二甲基甲酰胺(DMF),均为分析纯;0.10 mol·L-1Tb(NO3)3溶液由Tb4O7直接称重后,用浓HNO3溶解,除去HNO3后配制而成;0.10 mol·L-1Ce(NO3)3溶液直接配制。
1.2 方法
按照适量的配比,分别称取Sr(NO3)2、NH4F置于25 mL聚四氟乙烯内衬的高压反应釜内,用移液管移取适量Ce(NO3)3、Tb(NO3)3溶液,继续加入DMF、蒸馏水,使混合液总体积约20 mL,密封后放入真空干燥箱,150 ℃恒温反应一定时间,自然冷却至室温,将所得沉淀离心分离,并依次用蒸馏水、无水乙醇各洗涤3次,在60 ℃真空干燥,得到SrF2:xCe3+,yTb3+系列样品。
1.3 分析测试
样品的物相采用日本岛津公司XRD-7000型全自动X-射线粉末衍射仪鉴定,Cuκα(λ=0.15418 nm),管电压40 kV,管电流30 mA,步长0.02°,扫描范围20°~80°,扫描速度为2°·min-1。光致发光谱和光致发光激发谱由日本日立公司F-4500型荧光分光光度计测量,激发源为150 W氙灯,分辨率为0.1 nm。所有测试都在室温下进行。
2 结果与讨论
2.1 SrF2:0.01Ce3+,0.01Tb3+的XRD分析
不同水热反应时间下的SrF2:0.01Ce3+,0.01Tb3+的XRD图谱见图1。
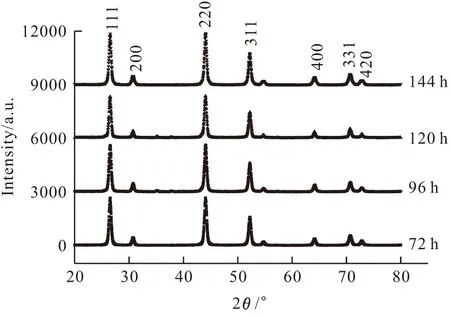
图1 不同水热反应时间下的SrF2:0.01Ce3+, 0.01Tb3+的XRD图谱
通过与标准粉末衍射卡片对比,SrF2:0.01Ce3+,0.01Tb3+的衍射峰数据与JCPDS(PDF No.06-0262)卡片数据一致,没有任何杂质峰,SrF2:0.01Ce3+,0.01Tb3+属于立方晶系,其晶体结构并未因Ce3+、Tb3+的掺入而改变。并且随着水热反应时间的延长,SrF2特征峰强度逐渐增强,表明延长水热反应时间有利于立方晶系SrF2相的形成。
2.2 荧光光谱
2.2.1 SrF2:0.01Ce3+,0.01Tb3+的荧光光谱
图2为150 ℃时水热反应120 h获得的SrF2:0.01Ce3+,0.01Tb3+荧光粉的激发光谱与发射光谱。

图2 SrF2:0.01Ce3+, 0.01Tb3+荧光粉的激发光谱(a)与发射光谱(b)
由图2可以看出,在谱线a中,以Tb3+的5D4→7F5跃迁发射峰545 nm(绿光)作为监测波长,观察到激发峰位置在275 nm处,对应于Ce3+的4f-5d吸收[8]。用254 nm紫外光激发样品,除了508 nm处倍频峰外,发射光谱主要由4组峰组成:位于491 nm、545 nm、585 nm、623 nm的发射峰分别对应于Tb3+的5D4→7F6、5D4→7F5、5D4→7F4、5D4→7F3跃迁。激发光谱(a)中有Ce3+的特征吸收峰,发射光谱(b)中没有Ce3+的特征发射峰,由此推测,存在离子间Ce3+→Tb3+能量传递作用。
2.2.2 水热反应时间的影响
图3为150 ℃时水热反应72 h、96 h、120 h、144 h时获得的SrF2:0.01Ce3+,0.01Tb3+荧光粉的发射光谱,激发波长均为254 nm。

图3 不同水热反应时间下的SrF2:0.01Ce3+, 0.01Tb3+荧光粉的发射光谱
由图3可以看出,发射光谱主要由4组峰组成,分别对应于Tb3+的5D4→7F6、5D4→7F5、5D4→7F4、5D4→7F3跃迁(极弱峰),545 nm处5D4→7F5跃迁发光峰的发光强度在水热反应时间为120 h时达到最大、在水热反应时间为144 h时反而减小。
2.2.3 Ce3+、Tb3+掺杂量的影响
图4为SrF2:xCe3+,yTb3+系列荧光粉的发射光谱。

图4 SrF2:xCe3+, yTb3+荧光粉的发射光谱
由图4可以看出,在254 nm紫外光激发下,4组发射光谱峰分别对应于Tb3+的5D4→7F6、5D4→7F5、5D4→7F4、5D4→7F3(极弱峰)跃迁,最大峰值的波长基本没有变化,其中SrF2:0.04Ce3+,0.04Tb3+的545 nm处Tb3+的5D4→7F5跃迁发光峰发光强度最大,再增加掺杂量该发射峰发光强度反而减小,可能存在浓度淬灭效应。
2.2.4 激发波长的影响
改变激发波长,测定SrF2:0.01Ce3+,0.01Tb3+的发射光谱,结果见图5。

图5 不同激发波长下SrF2:0.01Ce3+, 0.01Tb3+的发射光谱
由图5可以看出,Tb3+的545 nm处5D4→7F5跃迁发射峰的发光强度随激发波长的增大而减小;激发波长为230 nm、236 nm时,除460~480 nm处的倍频峰外,SrF2:0.01Ce3+,0.01Tb3+的发射光谱中均出现391 nm、393 nm处的宽峰,该峰为Ce3+的4f-5d能级跃迁,说明紫外激发波长很小时,易产生Ce3+的紫色发光峰,此时Ce3+→Tb3+能量转移效率减小,说明改变激发波长,可对材料的发光颜色进行微调。
3 结论
采用水热法合成了立方晶系SrF2:Ce3+,Tb3+荧光粉。SrF2:0.01Ce3+,0.01Tb3+的荧光光谱表明,以545 nm作为监测波长,275 nm处有Ce3+的4f-5d吸收峰。在254 nm紫外光激发下,发射光谱中有Tb3+的5D4→7F6、5D4→7F5、5D4→7F4、5D4→7F3等跃迁发射峰,说明存在Ce3+→Tb3+的能量传递作用,此时材料发蓝绿光。水热反应时间和Ce3+、Tb3+掺杂量均能改变Tb3+的5D4→7F6、5D4→7F5跃迁峰的发光强度。激发波长为230 nm、236 nm时,均出现Ce3+的4f-5d能级跃迁紫光发光峰,此时Ce3+→Tb3+能量转移效率减小,说明改变激发波长,可对SrF2:0.01Ce3+,0.01Tb3+荧光粉发光颜色进行微调。
[1] 孟献丰,李磊.稀土草酸盐先驱体法制备LaPO4:Ce,Tb绿色荧光粉[J].稀有金属材料与工程,2009,38(Z1):338-341.
[2] 孙日圣,张小林,邹建国,等.绿色荧光粉LaPO4:Ce,Tb的发光性能研究[J].稀土,2003,24(3):16-19.
[3] 翟永清,冯仕华,李艳威,等.新型黄绿色发光材料Sr2MgSi3O9:Ce3+,Tb3+的合成及光谱分析[J].功能材料,2009,40(7):1068-1070,1073.
[4] 张茂峰,孟建新,刘应亮,等.水热法制备LaF3:Ce,Tb纳米荧光粉及发光性质研究[J].光谱学与光谱分析,2007,27(2):232-235.
[5] 戴俊,林祥,乔旭升,等.柠檬酸溶胶-凝胶法制备CaYAl3O7:Ce3+,Tb3+蓝绿色荧光粉[J].稀有金属材料与工程,2010,39(Z2):313-316.
[6] 邱克辉,李峻峰,高晓明,等.SrAl2O4:Tb3+,Ce3+发光材料的合成与发光特性[J].发光学报,2004,25(2):197-201.
[7] 张海燕,曹亮军,王琳琨,等.KMgF3:Ce3+,Tb3+纳米粒子中Ce3+→Tb3+的发光及能量传递[J].无机化学学报,2010,26(5):822-826.
[8] 李峻峰,邱克辉,赖雪飞,等.CaAl12O19:Tb3+,Ce3+发光粉体的燃烧合成与表征[J].稀有金属材料与工程,2009,38(Z1):188-191.
