砂箱内土著柴油降解菌的生长条件优化及其降解性能初步研究
2011-07-25杨金凤陈鸿汉曹冠楠杨正礼
杨金凤,陈鸿汉,曹冠楠,杨正礼
(1.中国农业科学院农业环境与可持续发展研究所,北京 100081;2.中国地质大学(北京)水资源与环境工程北京市重点实验室,北京 100083)
柴油在其加工及应用过程中导致土壤污染的问题已为全球所关注,据统计,柴油对土壤的污染最易发生在加油站地下储油罐的泄漏[1,2]。目前对地下储油罐的泄漏污染修复主要采取生物方法,并取得了一定的成果[3~5]。由于柴油组成的复杂性及其生物难降解性,有必要对柴油降解菌种进行筛选,为此,作者对从模拟修复柴油污染土壤的砂箱装置中富集、分离得到的土著柴油降解菌进行了生长条件优化和降解能力初步评价,希望为合理控制和修复柴油污染土壤提供理论基础。
1 实验
1.1 菌株和培养基
从模拟修复柴油污染土壤的砂箱装置中富集、分离、筛选出微生物菌株:B-1(微杆菌属)、B-2(短波单胞菌属)、B-3(Tetrathiobacterkashmirensis,将菌株B-3与GenBank数据库中同源性较高的细菌模式株进行比较,其16S rDNA序列与Tetrathiobacterkashmirensis有较高的序列同源性,且经系统发育分析与菌株B-4的同源性为97%,综合形态学特征、生理生化指标,将菌株B-3归于假单胞菌属)和B-4(假单胞菌属)[6]。
牛肉膏蛋白胨培养基:牛肉膏 5 g,蛋白胨 10 g,NaCl 5 g,蒸馏水 1000 mL,pH值7.2~7.4,121℃灭菌20 min。
LB液体培养基[7]:蛋白胨 10 g,酵母菌 5 g,NaCl 10 g,蒸馏水 1000 mL,pH值7.2~7.4,121℃灭菌30 min。
无机盐培养基:K2HPO40.8 g,MgSO4·7H2O 0.25 g,CaCl20.03 g,KH2PO40.2 g,FeSO4·7H2O 0.09 g,pH值7.2~7.4,蒸馏水 1000 mL。
1.2 方法
1.2.1 环境因素对菌株生长影响的考察
分别从保存有菌株B-1、B-2、B-3、B-4的斜面培养基上挑取环菌接入无机盐培养基内,培养温度分别为10℃、15℃、20℃、25℃、30℃、40℃,摇床转速为165 r·min-1,采用光电比浊法测定OD值,筛选出菌株生长的最适温度。
在各菌株最适温度下,通过改变无机盐培养基中的K2HPO4和KH2PO4的比例,使pH值分别为6.0、6.5、7.0、7.5、8.0,摇床转速为165 r·min-1,采用光电比浊法测定OD值,筛选出菌株生长的最适pH值。
1.2.2 菌株对柴油降解能力的考察
通过观察菌株的表面形态特征[6]和分析各菌株整个培养期内不同温度、pH值对其OD值变化的影响,选取菌株B-3(未见文献对其降解性能进行评价)和菌株B-4(代表典型降解石油烃的细菌)考察其对柴油的生物降解能力。
1.3 分析与测试
1.3.1 菌株生长量的测定
由于细菌悬浮液的浓度与浊度成正比,以菌悬液在波长600 nm的OD值来表征细菌的生长情况,其OD值变化曲线即为菌株的生长曲线。在已接种的细菌斜面培养基上挑取环菌放入LB液体培养基内,然后将其置于30℃恒温摇床上,165 r·min-1培养45 h。每间隔1 h取一次样,在波长600 nm下测定其OD值。对细胞密度大的培养基进行适当稀释后测定,以不加菌的LB培养液为空白对照。
1.3.2 培养液中残余TPH(Total petroleum hydrocarbon)含量的测定
取10个磨口锥形瓶,各加入25 mL无机盐培养基,分装5 mL B-3菌液于前5个锥形瓶,分装5 mL B-4菌液于后5个锥形瓶,在装有B-3菌液的5个锥形瓶中分别加入0.2%(体积分数,下同)、0.5%、1.0%、1.5%、2.0%柴油,置于30℃恒温摇床上培养,转速为165 r·min-1,培养3~5 d后,对培养基内的有机相进行预处理,在其中加入CH2Cl2,振荡摇匀,以打破水包油乳液,静置分层,取下部有机相,用无水Na2SO4过滤脱水,室温氮吹至1 mL,由进样口注射入气相色谱仪测定培养液中的残余TPH含量。以不接菌的30 mL无机盐培养基作为空白对照。
柴油降解率(η)依下式计算:
式中:A0为对照培养液中残余TPH含量;Ax为测试菌培养液中残余TPH含量。
1.3.3 培养液中柴油的主要代表性正烷烃组分测定
用微量进样器取1 μL经CH2Cl2预处理过的下部已脱水有机相,由进样口注射入气相色谱仪(美国Agilent6820型气相色谱仪,HP-5柱,进样口温度200℃,FID检测器温度280℃,分流比5∶1,流速2 mL·min-1,载气为N2),具体升温程序是:45℃保持1 min,其后以5℃·min-1的速度升至100℃保持1 min,再以8℃·min-1的速度升至275℃保持1 min,再以15℃·min-1的速度升至310℃保持2 min。实验所用储备液包括柴油中的主要代表性正烷烃组分为:壬烷(C9)、癸烷(C10)、正十二烷(C12)、正十六烷(C16)、十八烷(C18)、二十二烷(C22)和二十八烷(C28)。
2 结果与讨论
2.1 菌株生长条件的优化
2.1.1 温度对菌株生长的影响(图1)
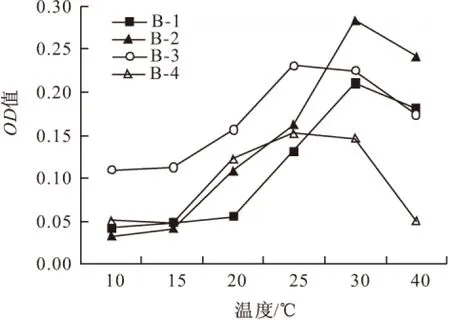
图1 温度对菌株生长的影响
从图1可以看出,随着培养温度的升高,各菌株的OD值逐渐上升,说明各菌株长势良好;当温度升高到一定值时,OD值开始下降,只是下降幅度有所差异;菌株B-1和菌株B-2的最适培养温度为30℃,菌株B-3和菌株B-4的最适培养温度为25℃。值得注意的是,同一温度(≤25℃)下,菌株B-3的OD值比其它菌株均要大,说明其在培养液中的适应能力强、生长良好;菌株B-4对高温更敏感,当温度从30℃升至40℃时,其OD值约下降了0.10。
2.1.2 pH值对菌株生长的影响[8,9](图2)

图2 pH值对菌株生长的影响
由图2可以看出,随着pH值的增大,各菌株的OD值缓慢升高,pH值为7.5时,OD值达到最大;pH值继续增大,OD值开始下降,菌株的生长受到抑制。从图2还可以看出,随pH值的增大,菌株B-3的生长量变化较大,说明菌株B-3受pH值影响较大,但其OD值在pH值7.0~7.5之间相差不大。
4株菌株在温度为25~30℃、pH值为7.0~7.5的条件下,生长最佳。
2.2 菌株对柴油的降解能力
2.2.1 菌株对不同初始体积分数柴油的降解能力比较
菌株B-3、B-4对不同初始体积分数柴油的降解率见表1。

表1 菌株B-3、B-4对不同初始体积分数柴油的降解率/%
从表1可以看出,在柴油初始体积分数为0.2%~1.5%时,菌株B-3的柴油降解率明显较菌株B-4的高,尤其在柴油体积分数为1.5%时,降解率达到了60.98%,较菌株B-4的高出23.8%;但随着柴油初始体积分数的增加,菌株B-3的柴油降解率下降明显,在柴油初始体积分数为2.0%时,降解率仅为30.17%;菌株B-4在柴油初始体积分数为0.5%、1.0%时降解率较高,但从同一柴油初始体积分数下的降解率来看,B-3菌株基本上高于B-4菌株。这表明相同降解条件下菌株B-3的降解能力高于菌株B-4,是一株更加优势的降解柴油菌株。
2.2.2 菌株对柴油组分的降解
对不同初始体积分数柴油不接种菌株和分别接种菌株B-3、B-4摇床培养3~5 d后测其残余TPH含量的同时,利用气相色谱仪进行柴油中主要代表性正烷烃组分浓度变化分析,结果见图3。

a~e的柴油初始体积分数为:0.2%,0.5%,1.0%,1.5%,2.0%
从图3可以看出,柴油初始体积分数较低(<1.0%)时,与空白样品对照,两菌株对残余TPH中主要代表性正烷烃组分的降解都较为彻底;随着柴油初始体积分数的增大,降解程度呈下降趋势。当柴油初始体积分数为0.2%时,添加菌株B-3的样品中C10以下的短链烃已经降解完全,而添加菌株B-4的样品中还存在组分C12;当柴油初始体积分数为0.5%时,两菌株对各主要代表性正烷烃组分均有降解,表现为各组分浓度都在降低,但仅有C22以上组分被降解完全;当柴油初始体积分数增至1.0%时,两菌株对样品的降解程度进一步降低,但添加菌株B-3的样品中各主要代表性组分浓度降低的幅度要略大于添加菌株B-4的样品;当柴油初始体积分数为1.5%时,添加菌株B-3的样品各代表性正烷烃组分的浓度下降最大,C16以下的短链烃已降解完全,而添加菌株B-4的样品由于柴油初始体积分数的增大,降解能力开始减弱,各代表性正烷烃组分的浓度降低较少。这说明菌株B-3比菌株B-4在降解柴油方面更有优势,更说明菌株B-3的最适柴油初始体积分数为1.5%,此时其降解柴油能力最强;当柴油比例为2.0%时,两菌株的降解能力都在减弱,与空白样品对照,各代表性正烷烃组分浓度下降的程度基本一致,说明添加的柴油已超过微生物自身的耐受范围,抑制了微生物对柴油的降解。
3 结论
对从模拟修复柴油污染土壤的砂箱装置中筛选到的4株土著柴油降解菌进行了生长条件优化和降解性能初步评价,结果如下:
(1)通过分离、筛选得到的土著柴油降解菌株B-1、B-2、B-3、B-4在10~35℃范围内均可生长,相应的最佳培养温度分别为30℃、30℃、25℃、25℃,最适pH值为7.0~7.5。
(2)通过对菌株B-3、B-4的降解特性进行研究表明:不同初始体积分数柴油下,菌株B-3在降解柴油方面更有优势,对柴油的降解率明显较菌株B-4高,尤其在柴油初始体积分数为1.5%时达到了60.98%,比菌株B-4高出23.8%;随着柴油初始体积分数的增大,菌株B-4的降解能力逐渐减弱,而菌株B-3则有一个最适的柴油初始体积分数(1.5%),此时,其降解能力最强。
(3)与空白样品对照,柴油初始体积分数较低(<1.0%)时,两菌株对TPH主要代表性正烷烃组分的降解均较为彻底;随着柴油初始体积分数的增大,降解程度呈下降趋势;继续增大柴油初始体积分数,微生物对柴油的降解受到抑制。
[1] Atlas R M.Bioremediation[J].Chemical and Engineering News,1995,73(14):32-34.
[2] Gallego J L R,Loredo J,Llamas J F,et al. Bioremediation of diesel-contaminated soils:Evaluation of potentialinsitutechniques by study of bacterial degradation[J].Biodegradation,2001,12(5):325-335.
[3] Banat I M.Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation:A review[J].Bioresource Technology,1995,51(1):1-12.
[4] Boopathy R. Factors limiting bioremediation technologies[J].Bioresource Technology,2000,74(1):63-67.
[5] Mihopoulos Philip G,Suidan Makram T,Sayles Gregory D, et al. Numerical modeling of oxygen exclusion experiments of anaerobic bioventing[J].Journal of Contaminant Hydrology,2002,58(3-4):209-220.
[6] 杨金凤.生物通风修复柴油污染土壤实验及柴油降解菌的降解性能研究[D].北京:中国地质大学(北京),2009.
[7] 沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999:97-99.
[8] 王绍玲,熊运实,向兰,等.石油及其它有机污染的生物治理法[J].油气田环境保护,1994,4(4):33-38.
[9] 姚伟静.高效除油微生物菌株的筛选及表面活性剂增强生物降解石油烃的研究[D].重庆:重庆大学,2007.
