神经束植入治疗家兔腓肠肌失神经支配的疗效评价
2011-07-24杨延军邱伟婷马立峰张子清
杨延军, 邱伟婷, 黄 刚, 陈 飞, 马立峰, 张子清
(广东省深圳市龙岗中心医院, 广东 深圳 518116)
周围神经损伤在临床上极为常见。尽管周围神经修复技术已有了长足的进步,但即使是新鲜、清洁的周围神经断裂伤,及时采用先进的显微外科技术进行修复,通常也不可能获得完全再生,功能也往往不能完全恢复;而长时间的感觉或运动的缺失将引起肌肉萎缩、关节挛缩畸形等[1]。因此,如何促进周围神经损伤的再生,最大限度地恢复其功能,一直是神经修复的基础和临床研究的热点。其中神经修复的显微外科手术包括:神经松解术、神经缝合术、神经移植术、神经移位术和神经束植入骨骼肌术等[1,2]。本研究拟对家兔失神经支配腓肠肌神经束植入后其肌湿质量、肌肉收缩能力的变化以及乙酰胆碱酯酶含量的变化进行连续观察,为临床寻找检测肌肉萎缩程度方法和评价神经束植入术的疗效。
1 材料与方法
1.1 失神经支配腓肠肌神经束植入动物模型的制作:家兔48只(广东省实验动物中心),体重2.5 0.5kg/只,不拘雌雄,随机分为3组,神经植入组、神经吻合组及对照组,每组16只。动物麻醉后,在放大10倍手术显微镜下,实验组于右侧梨状肌下缘寻找坐骨神经,沿坐骨神经寻找其胫神经分支,将其进入腓肠肌的分支干进入肌肉表面切断,然后将按神经束神经干分割成数支。神经植入组用10-0号显微缝合线根据肌内神经的分布情况选择性植入分别植入腓肠肌肌肉组织内;神经吻合组对坐骨神经发出支配腓肠肌分支后约1cm切断,用10-0号显微缝合线进行端-端吻合;对照组则于神经切断后并切除进入腓肠肌分支1-2mm,阻止神经的自然生长。分别于术后 2、4、6、8、12、16、20 及 24周处死取两组右小腿腓肠肌作实验观察。
1.2 肌肉湿重测定:将各时期处死家兔自股骨内外髁起点至跟骨结节止点完整取下腓肠肌,20℃用万分之一天平称其体重。
1.3 肌肉收缩功能的测定:家兔麻醉后,固定、游离右侧腓肠肌,保留血供,切断腓肠肌远端肌腿并用丝线将肌腿直接与肌肉张力换能器水平相连,肌肉周围不断滴注37℃温盐水,局部烤灯保湿,用特制细铜丝双极电极距入肌点2mm处直接刺激支配神经,刺激频率为1Hz和40Hz,波宽20ms,作张力-长度曲线,记录到最合适收缩长度后,分别记录肌肉单收缩力和最大强直收缩力。
1.4 乙酰胆碱酯酶染色观察:将各时期动物取材标本解剖显微镜下分离出肌束,行胆碱酯酶染色4℃下60min(染色孵育液配制:0.1moL顺丁烯二酸溶液(pH6.0)6.5mL内依次加入碘化乙酰硫代胆碱5mg,0.1moL枸橼酸钠溶液0.5mL,20nmoL硫酸铜溶液1.5mL,蒸馏水2mL,5nmoL铁氰化钾溶液1mL,蔗糖1g)染色后直接压片光学显微镜下观察,应用计算机图像分析系统,对各组取材乙酰胆碱酯酶含量进行测定,每个实验动物取3张切片,400倍光镜下随机选取20个运动终板,检测乙酰胆碱酯酶染色的纵断面光镜切片酶的灰度值(酶含量的灰度值为实际含量的倒数,数值越小,含量越高)。
1.5 统计学处理:实验数据采用SPSS 13.0统计软件,进行统计学分析,结果用s表示,两组间比较用t检验。
2 结果
术后不同时间点不同组间肌湿质量结果见表1,随着时间延长,神经植入组间肌湿质量逐渐增加,神经吻合组肌湿质量呈缓慢上升趋势。对照组肌湿质量呈缓慢下降趋势。神经植入组在第12周时肌湿质量开始大于神经吻合组(P>0.05)。术后不同时间点不同组间单肌收缩力的变化见表2,随着时间延长,神经植入组单肌收缩力逐渐增加,到16周时,神经植入组与对照组单肌收缩力已经没有差别。术后不同时间点不同组间肌肉收缩力的变化见表3,随着时间的延长,神经植入组单肌收缩力明显增加。术后不同时间点不同组间乙酰胆碱酯酶含量的变化见表4,在16周前,胆碱酯酶含量的变化不是很明显,16周后,植入组胆碱酯酶含量明显增加。
表1 术后不同时间点不同组间肌湿质量变化分析(s,n=16)
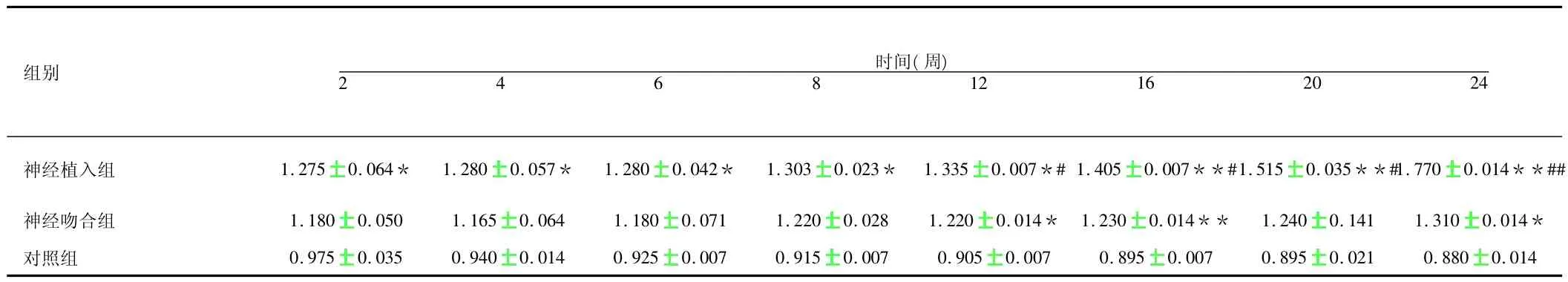
表1 术后不同时间点不同组间肌湿质量变化分析(s,n=16)
注:与对照组相比,**P <0.01,*P <0.05;神经植入组与神经吻合组相比,##P <0.01,#P <0.05
组别时间(周)2 4 6 8 1216 20 24神经植入组 1.275 0.064* 1.280 0.057* 1.280 0.042* 1.303 0.023* 1.335 0.007*#1.405 0.007**#1.515 0.035**#1.770 0.014**##神经吻合组 1.180 0.050 1.165 0.064 1.180 0.071 1.220 0.028 1.220 0.014* 1.230 0.014** 1.240 0.141 1.310 0.014*对照组 0.975 0.035 0.940 0.014 0.925 0.007 0.915 0.007 0.905 0.007 0.895 0.007 0.895 0.021 0.8800.014
表2 术后不同时间点不同组间肌肉单收缩力的变化(s,n=16)

表2 术后不同时间点不同组间肌肉单收缩力的变化(s,n=16)
注:与对照组相比,**P<0.01,*P<0.05;神经植入组与神经吻合组相比,#P <0.05
组别时间(周)2 4 6 8 1216 20 24神经植入组 44.5 0.7# 51.0 1.4# 54.5 0.7*# 61.0 1.4*# 65.5 0.7**# 71.0 1.7** 71.0 3.4** 79.0 1.4**神经吻合组 67.5 0.7* 70.0 2.8* 72.5 1.7** 74.0 1.4** 75.5 2.7** 75.5 3.7** 75.5 1.7** 75.5 0.7**对照组 41.5 2.1 46.5 0.7 48.5 0.7 50.5 0.7 47.5 0.7 45.5 0.7 45.5 0.7 44.70.6
3 讨论
周围神经损伤后骨骼肌萎缩及运动终板退变的防治一直是周围神经外科研究领域的难题。骨骼肌及运动终板的状态决定着神经功能的恢复情况。
Sunderland[3]发现肌细胞正常形态结构维持需靠一些神经营养因子的作用,失神经支配后最大变化是这些神经营养因子丢失导致的肌肉形态结构、生理生化及新陈代谢等方面改变。而失神经支配肌肉在形态学上首先表现为肌细胞浆丢失及直径减少。骨骼肌失神经支配后组织形态学改变:周围神经损伤后,骨骼肌因失去神经营养及废用而发生萎缩。随着失神经营养时间的延长,这种萎缩会逐渐加重,其质量也会较前逐渐减轻,腓肠肌肌湿质量恢复率的高低取决于该肌重获坐骨神经再生纤维支配的间隔时间的长短和能与其运动终板有效连接的再生神经纤维的多少,所以腓肠肌(湿质量)恢复率可作为衡量坐骨神经再生效果的一项重要指标。在本研究中,神经植入组腓肠肌肌湿质量在手术后第2周就明显重于对照组(P<0.05),且随着时间延长,神经植入组腓肠肌肌湿质量增重明显,这种差异愈发明显。神经吻合组肌湿质量呈缓慢上升趋势,在12周时,与神经植入组比较,差异开始具有统计学意义,神经植入组重于吻合组(P<0.05)。从而表明神经植入对神经功能的恢复及神经再生的效果优于神经吻合。而对照组因失神经支配后,骨骼肌因失去神经营养及费用而发生萎缩,所以质量较前逐渐减轻。
神经植入组与吻合组肌肉单肌收缩力与强直收缩力在术后均不断增强,但植入组增加更快,这说明神经植入能明显改善肌肉的收缩性能。
在正常生理状态下,运动神经元通过运动终板与骨骼肌纤维建立联系,支配骨骼肌完成各种生理功能。神经损伤后,近端轴突逆行溃编,神经元受损乃至死亡;远端轴突及运动终板发生变形改变。骨骼肌纤维也因失去了神经营养而发生变形以及酶活性和分布的改变。远端轴突发生waller变形,导致运动终板乙酰胆碱酯酶活性下降。
神经再生时,运动终板乙酰胆碱酯酶活性恢复正常。乙酰胆碱酯酶主要来源于运动神经元胞体,通过轴突快速运输到达神经终末,乙酰胆碱酯酶活性的强弱反映运动神经元的功能状态[4]。终板区乙酰胆碱酯酶含量多少亦可能反映终板退变及再生情况[5]。在本研究中,神经植入组及吻合组乙酰胆碱酯酶均呈上升趋势,在第20周时,植入组乙酰胆碱酯酶含量明显高于对照组(P<0.05)。而对照乙酰胆碱酯酶含量变化不明显。乙酰胆碱酯酶对乙酰胆碱有特异性水解作用,主要分布于运动终板处的突触前膜及后膜,神经发放的冲动通过运动终板将乙酰胆碱传递给肌肉,从而引起肌肉收缩。终板区乙酰胆碱酯酶含量的多少能够反映出运动神经元的功能状态和运动终板退变和再生的情况[6]。本实验中,神经植入组在术后16周前,胆碱酯酶含量没有明显变化,16周后明显升高,Hu等认为运动终板和胶原纤维的消失是影响去神经支配晚期疗效的主要因素,从而表明神经植入晚期疗效明显。
表3 术后不同时间点不同组间肌肉强直收缩力的变化(s,n=16)

表3 术后不同时间点不同组间肌肉强直收缩力的变化(s,n=16)
注:与对照组相比,**P<0.01,*P<0.05;神经植入组与神经吻合组相比,#P <0.05
组别时间(周)2 4 6 8 1216 20 24神经植入组 241.5 2.12#** 252.2 1.45#** 270.5 2.76**#341.0 1.45***#445.5 10.7** 471.0 11.4** 481.0 12.6** 479.0 16.4**神经吻合组 427.0 31.11** 429.0 12.87** 432.5 12.77** 434.0 1.4** 455.5 0.7** 475.5 10.7** 475.5 10.7** 478.5 20.7**对照组 150.5 7.77 146.5 6.74 148.5 7.78 146.5 6.74 137.5 6.32 135.5 8.76 125.5 8.77 124.69.65
表4 术后不同时间点不同组间乙酰胆碱酯酶活性含量的变化(s,n=16)

表4 术后不同时间点不同组间乙酰胆碱酯酶活性含量的变化(s,n=16)
所测数据为酶含量的灰度值-实际含量的倒数,数值越小,含量越高注:与对照组相比,**P<0.01,*P<0.05;神经植入组与神经吻合组相比,#P <0.05
组别时间(周)2 4 6 8 1216 20 24神经植入组 121.5 12.12 122.2 11.45 130.5 12.76 141.0 11.45 145.5 10.7 171.0 11.4* 281.0 12.6**#289.0 16.4**#神经吻合组 127.0 31.11 129.0 12.87** 132.5 12.77** 134.0 11.4 155.5 20.7 175.5 30.7* 175.5 20.7* 178.5 10.7*对照组 120.5 17.77 126.5 16.74 128.5 17.78 146.5 6.74 137.5 16.32 135.5 18.76 125.5 18.76 129.619.65
[1]Siemionow,M.and A.Sari.A contemporary overview of peripheral nerve research from the Cleveland clinic microsurgery laboratory[J].Neurol Res,2004,26(2):218 -225.
[2]Myckatyn,T.M.and S.E.Mackinnon.A review of research endeavors to optimize peripheral nerve reconstruction[J].Neurol Res,2004.26(2):124 -138.
[3]Sunderland S.Factors influencing the development and se-verity of the changes in denervated muscle.In:Nerve injury and repair[M].Churchill living - stone,London,1991.247-257.
[4]殷琦,陆裕朴,褚晓朝,等.晚期周围神经损伤治疗临床及实验研究[J].中华骨科杂志,1995,15(9):596 -599.
[5]许小珊,沈菊英.运动终板及其神经末梢的染色方法[J].中国人民解放军军事医学科学院院刊,1980,9:105.
[6]殷琪,陆裕朴,胡蕴玉,等.肌肉失神经支配后运动终板早晚期退变实验研究[J].中国修复重建外科杂志,1995,9(1):16 -8.
