生长激素受体外显子3缺失多态性在矮小儿童与正常儿童中的分布比较
2011-07-21崔敬茹郑荣秀刘戈力杨箐岩梁东春
崔敬茹 郑荣秀 刘戈力 杨箐岩 梁东春
随着社会经济的飞速发展,人们对身高的关注度越来越强,重组人生长激素(recombinant human growth hormone,rhGH)治疗矮小症也逐渐为人们所接受[1]。生长激素受体(growth hormone receptor,GHR)是生长激素(growth hormone,GH)发挥作用的中介,GHR基因的多态性可能导致其在不同个体中的表达水平或功能上的差异。有研究表明外显子3缺失的基因多态性可以导致GHR对GH反应性的不一致,从而导致不同个体对GH治疗反应的不一致[2],不同种族中GHR基因多态性分布不同[3]。本研究旨在了解矮小症儿童和正常儿童GHR基因外显子3缺失多态性的分布差异,为今后探讨其是否与矮小症的发病有关,并结合临床指标建立可靠的GH治疗预测模式奠定基础。
1 对象与方法
1.1 研究对象 自 2009年9月—2010年6月于天津医科大学总医院小儿内分泌科就诊的矮小症患儿中选出满足如下条件的143例作为试验组:(1)身高处于同年龄、同性别正常健康儿童生长曲线第3个百分位数以下或低于2个标准差(SD),符合矮身材标准。(2)生长缓慢,生长速率<4 cm/年。(3)骨龄落后(2.5±0.4)岁。(4)头颅磁共振结果显示下丘脑-垂体区无异常。其中生长激素缺乏症(growth hormone defi⁃ciency,GHD)58 例,小于胎龄儿(small for gestational age,SGA)40例,特发性矮小(idopathic short stature,ISS)45例,平均年龄(9.0±2.6)岁。收集同期在我院进行健康体检的儿童,选取身高处于同年龄、同性别健康儿童生长曲线均值±1SD范围的170例作为对照组,平均年龄(9.5±1.8)岁。每位自愿者取静脉血3 mL,并签订知情同意书。乙二胺四乙酸(EDTA)抗凝,-20℃保存备用。
1.2 方法
1.2.1 DNA的提取 D NA提取采用天津润泰科技发展有限公司生产的小量血液DNA提取试剂盒(产品代码:GD2311-01)提取血液基因组DNA。紫外分光光度计,测定其光密度值。
1.2.2 目的基因扩增及PCR产物 GHR外显子3缺失多态性的检测参见文献[4]中方法。PCR上游引物为G1:5′-TGT GCTGGTCTGTTGGTCTG-3′;下 游 2 条 引 物 分 别 为 G 2:5′-AGTCGTTCCTGGGACAGAGA-3;′ G 3 : 5′-CCTGGATTAA CACTTTGCAGACTC-3′。PCR反应体系如下:10×PCR buffer 2.5 μL,Taq 聚合酶1 μL,上下游引物(20 μmol/L)各1 μL,模板DNA 2 μL(含基因组DNA 50 ng),dNTP(10 mmol/L)2 μL,加三蒸水14.5 μL至总体积25 μL。经94℃预变性5 min,94℃变性30 s,65℃条件下退火30 s,72℃延伸90 s,循环35次,最后72℃延长7 min。PCR扩增产物经1%琼脂糖凝胶电泳分离,溴化乙锭染色,紫外灯下判断结果。3种基因型fl/fl(无外显子3缺失的纯合子),fl/d3(有一条染色体缺失外显子3的杂合子)以及d3/d3(2条染色体都缺失外显子3的纯合子)的条带。
1.3 统计学处理 根 据电泳结果条带分布的不同计算各基因型频数,通过公式(p+q=1,2 pq=杂合型基因频率)计算各等位基因频率。Hardy-Weinberg平衡公式计算各基因型的理论值(fl/fl:样本总数×p2;fl/d3:样本总数×2 pq;d3/d3:样本总数×q2),χ2检验检测Hardy-Weinberg平衡吻合度。采用SPSS 16.0统计软件包进行数据分析,计数资料采用例(%)表示,2组GHR基因型频率与等位基因频率的分布差异、不同国家和地区间基因型频率和等位基因频率的分布差异及组间频率差异分析采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PCR电泳结果 fl/fl为935 bp一条带,fl/d3为935 bp和532 bp两条带,d3/d3为532 bp一条带,见图1。

2.2 Hardy-Weinberg平衡 结果显示,本研究所选择人群群体代表性较好,能够反映出2组人群一般情况(P>0.05),见表1。

表1 2组GHR基因外显子3缺失多态性基因型实际值与理论值
2.3 2组儿童GHR基因多态性分布情况 2组基因型及等位基因频率分布差异均有统计学意义(均P<0.05),见表2。

表2 2组GHR基因外显子3缺失多态性基因型分布
2.4 GHR基因型在不同国家和地区间的分布比较 将文献[3,5-7]中报道的其他地区的GHR基因型与本研究中正常儿童和矮小儿童基因型的分布进行比较,本研究(天津)、邱旭升等(江苏)和Audi等(西班牙)研究报道的fl/fl、fl/d3、d3/d3的频数分布及fl和d3等位基因频率差别均有统计学意义(P<0.01),见表3。本研究与Binder等(德国)和Audi等研究中的SGA患儿基因型分布差异无统计学意义(P>0.05),见表4。本研究与Jorge等(巴西)研究的GHD患儿基因型分布差异亦无统计学意义(P>0.05),见表5。
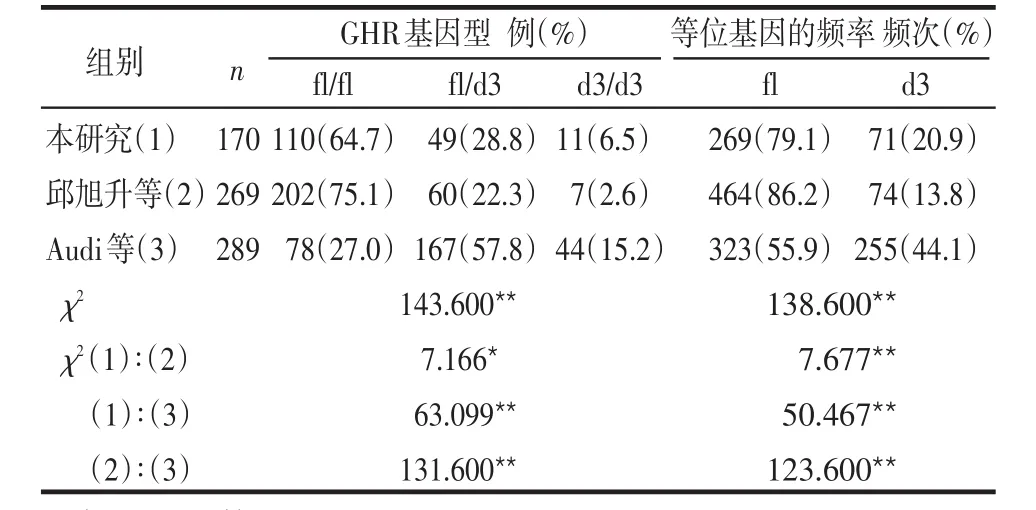
表3 不同地区正常人群GHR基因外显子3缺失多态性基因型分布比较
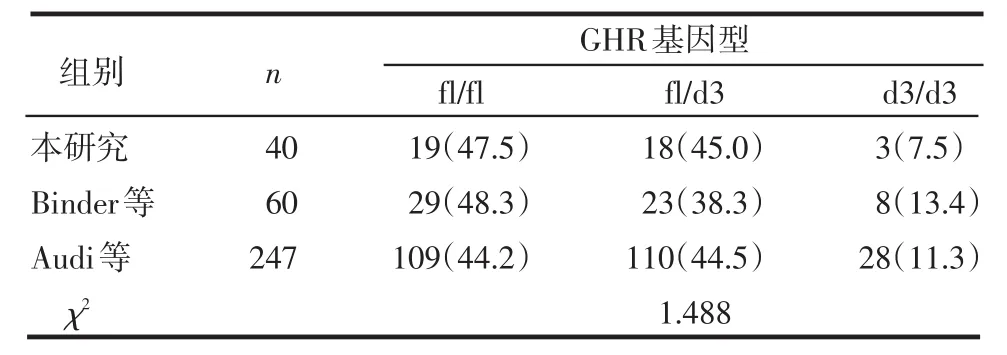
表4 不同地区SGA的GHR基因外显子3缺失多态性基因型分布比较 例(%)
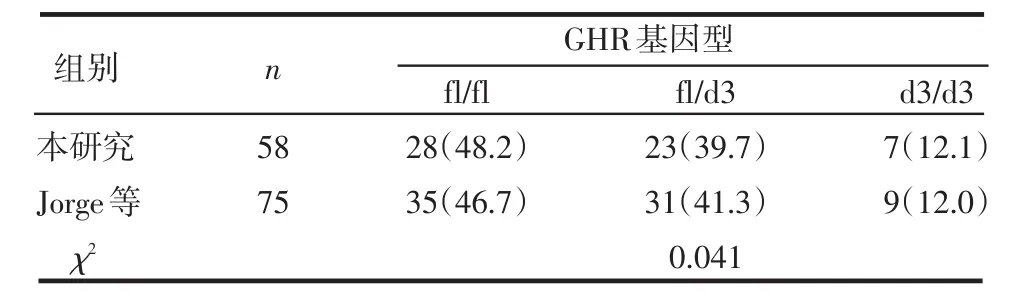
表5 不同地区GHD的GHR基因外显子3缺失多态性基因型分布比较 例(%)
3 讨论
3.1 GHR基因及其基因的多态性 人GHR基因位于第5号染色体的短臂上,编码一种含有620个氨基酸的单跨膜蛋白。该基因由10个外显子组成,外显子1是非编码区,外显子2编码信号肽,外显子3~7编码细胞外结构域,外显子8编码跨膜结构域,外显子9和10编码细胞内结构域。GHR基因的外显子3、6和10在人群中存在着多态性,并可能导致GHR在不同个体的表达水平或功能上的差异,进而影响GH生物学作用的发挥。发生在GHR外显子6和10上的多态性为单核苷酸多态性,而编码细胞外结构域外显子3的多态性则是由外显子3的保留(fl)或缺失(d3)构成的。
3.2 GHR外显子3缺失多态性与rhGH治疗矮小症疗效的相关性 近年来,rhGH已广泛应用于儿科临床,其治疗矮小症已取得了肯定的疗效[7],但接受治疗的个体间却存在着一定的疗效差异。虽然许多因素可以影响rhGH治疗效果,如开始治疗时的年龄、身高、体质量、骨龄、GH激发试验的峰值、rhGH的剂量、注射频率、疗程等,但所有这些因素只能部分解释rhGH治疗的个体差异,提示内在的遗传因素可能存在一定作用。在可能影响rhGH治疗反应性的基因中,GHR基因为重要的候选基因,其外显子3缺失多态性与rhGH治疗矮小症疗效相关性的研究越来越多。虽然Carrascosa等[8]研究显示GHR外显子3多态性与rhGH治疗效果没有相关性,但多数如Jorge等[5]、Binder等[6]和 Audi等[7]研究结果均显示基因型为fl/d3和d3/d3的矮小症患者rhGH的治疗效果明显优于基因型fl/fl的患者。此外,一项来自包括法国、新西兰、英国和德国的240例SGA患儿的大规模跨国研究表明GHR外显子3多态性与患儿对rh⁃GH治疗的反应有关[9]。由此推测GHR外显子3缺失的患者可能对外源性GH治疗更敏感。邱旭升等[3]及Audi等[7]报道的正常人群中d3等位基因频率分别为0.138、0.441,而国内目前尚鲜见GHR基因外显子3缺失多态性在矮小症儿童和正常儿童的分布情况的报道。
3.3 不同人群GHR外显子3缺失多态性的基因型和等位基因频率分布 本研究显示试验组GHR 3种基因型fl/fl、fl/d3、d3/d3的分布频数分别为71、58、14例,对照组分别为110、49、11例,前者基因型为fl/d3和d3/d3的比例明显高于后者,且d3等位基因频率亦高于后者,而本研究与Binder、Audi、Jorge等分别研究的德国人、西班牙人、巴西人中SGA和GHD患儿GHR基因型的分布差异均无统计学意义,推测GHR外显子3的缺失可能与矮小症的发病有一定关系。此外,本研究(天津)与邱旭升等(江苏)和Audi等(西班牙)研究的正常人群中GHR基因外显子3缺失多态性分布也不相同,这可以在一定程度上解释不同地区和种族的人身高、体质量、骨骼发育等人体测量学的差异和不同种族间生长激素治疗矮小症患者疗效的不同。
综上所述,本研究得到了GHR基因外显子3缺失多态性在矮小症儿童和正常儿童中的分布情况,为进一步了解GH药物遗传学及矮小症的发病机制以及将来根据基因型进行rhGH治疗个体化,改善rhGH治疗效果提供了依据。
[1]黄乐,包美珍,赵彦.国产生长激素治疗生长激素缺乏症的疗效观察[J].天津医药,1999,27(9):526-528.
[2]Dos Santos C,Essioux L,Teinturier C,et al.A common polymor⁃phism of the growth hormone receptor is associated with increased responsiveness to GH[J].Nat Genet,2004,36(7):720-724.
[3]邱旭升,邱勇,孙旭.江苏汉族人生长激素受体基因多态性研究[J].南京大学学报·自然科学版,2007,43(2):145-151.
[4]Pantel J,Machinis K,Sobrier ML,et al.Species-specific alternative splice mimicry at the growth hormone receptor locus revealed by the lineage of retroelements during primate evolution[J].Biol Chem,2000,275(25):18664-18669.
[5]Jorge AA,Marchisotti FG,Montenegro LR,et al.Growth hormone(GH)pharmacogenetics:influence of GH receptor exon 3 retention or deletion on first-year response and final height in patients with severe GH deficiency[J].J Clin Endocrinol Metab,2006,91(3):1076-1080.
[6]Binder G,Baur F,Schweizer R,et al.The d3-growth hormone(GH)receptor polymorphism is associated with increased responsiveness to GH in Turner syndrome and short small-for-gestational-age chil⁃dren[J].J Clin Endocrinol Metab,2006,91(2):659-664.
[7]Audi L,Esteban C,Carrascosa A,et al.Exon 3-deleted/full length growth hormone receptor polymorphism genotype frequencies in Spanish short small-for-gestational-age(SGA)children and adoles⁃cents(n=247)and in an adult control population(n=289)show in⁃creased fl/fl in short SGA[J].J Clin Endocrinol Metab,2006,91(12):5038-5043.
[8]Carrascosa A,Esteban C,Espadero R,et al.The d3/fl-growth hor⁃mone(GH)receptor polymorphism does not influence the effect of GH treatment(66 mg/kg per day)or the spontaneous growth in short non-GH-deficientsmall-for-gestational-age children:results from a two-year controlled prospective study in 170 Spanish patients[J].J Clin Endocrinol Metab,2006,91(9):3281-3286.
[9]Tauber M,Ester W,Auriol F,et al.GH responsiveness in a large multinational cohort of SGA children with short stature(NESTEGG)is related to the exon 3 GHR polymorphism[J].Clin Endocrinology,2007,67(3):457-461.
