异丙酚抑制长效酰胺类局麻药致大鼠中毒惊厥作用的比较*
2011-07-21乔玉敏王春平张志强
韩 倩 张 山 乔玉敏 王春平 张志强
局麻药所致的中枢神经系统(CNS)毒性惊厥为临床上常见的并发症,严重威胁着患者生命。大脑海马是与惊厥的发生和发展关系最为密切的区域之一,也是多种神经毒性和损伤最为敏感的区域之一[1]。全身静脉麻醉药异丙酚起效迅速,用药安全,并能迅速控制惊厥,缩短惊厥发作的持续时间[2]。本研究应用左旋布比卡因、罗哌卡因及布比卡因致大鼠中毒惊厥模型,观察不同局麻药引起惊厥及异丙酚处理后海马CA1区c-fos阳性细胞数、NO含量以及一氧化氮合酶(NOS)活性表达的差异,旨在比较异丙酚抑制这3种局麻药所致惊厥的作用。
1 材料与方法
1.1 研究对象 清 洁级成年Wistar大鼠64只,雄性,平均体质量(250±20)g,购自河北医科大学实验动物中心。随机均分为4组:对照组(C组)、左旋布比卡因组(L组)、罗哌卡因组(R组)及布比卡因组(B组),再按同源配对设计将每组再均分为实验(EG)组即C(EG)组、L(EG)组、R(EG)组以及B(EG)组;异丙酚处理(PG)组即C(PG)组、L(PG)组、R(PG)组以及B(PG)组,每组8只。
1.2 主要药品与试剂 丙 泊酚注射液(进口药品注册证号:H20070378,费森尤斯卡比医药有限公司,瑞典),0.75%盐酸左旋布比卡因注射液(批号:H20020570,江苏恒瑞医药股份有限公司),0.75%盐酸罗哌卡因注射液(进口药品注册证号:H20020253,阿斯利康医药有限公司,瑞典);一抗KIT-9901、酶标羊抗鼠/兔IgG聚合物(福州迈新生物科技有限公司),NO测定试剂盒和NOS测定试剂盒(南京建成生物工程研究所)。
1.3 实验方法 实 验开始前1 d所有鼠尾静脉放置24号套管针。L组、R组及B组的实验组分别经尾静脉泵入0.75%左旋布比卡因、0.75%罗哌卡因以及0.75%布比卡因,速度均为2 mg·kg-1·min-1,PG组在出现惊厥反应后静脉注射2 mg/kg异丙酚。EG组以3 mL/h的速度泵入生理盐水。惊厥发生2 h后所有大鼠处死、取脑,一侧的海马CA1区组织采用即用型非生物素免疫组化法(eliVision plus)观察c-fos每400倍视野的细胞数即为阳性细胞数(cells/HP)。计算出各组的EG亚组和PG亚组的差值D与EG组的比值K(K=D/EG),K值增大表明处理组作用显著。另一侧的海马CA1区组织放在冷冻管中,于液氮中冻存。按照试剂盒说明测定NO含量和NOS活性。Racine分级法判断大鼠惊厥的程度:以大鼠出现Ⅳ级或Ⅴ级(全身不自主或不协调的抽搐)时为判定终止惊厥的标准,观察大鼠的行为并记录惊厥发作的潜伏期和发作程度。
1.4 观察指标 观 察并比较各组惊厥发生的时间及局麻药致惊厥的剂量,海马CA1区c-fos阳性细胞数的表达、NO水平及NOS活性表达,比较各组上述3项指标的K值。
1.5 统计学处理 采 用SPSS 13.0统计软件进行分析,计量数据以均数±标准差(±s)表示,多组间均数比较采用方差分析、进一步组间两两比较用LSD-t法,各组内亚组间比较采用t检验,P<0.01为差异有统计学意义。
2 结果
2.1 各组惊厥情况 除C组外各组均有惊厥发生。各实验组从泵入局麻药到出现惊厥的时间分别为:L组平均(10.63±4.81)min;R组平均(12.63±7.84)min;B组平均(7.75±3.92)min,各组局麻药致惊厥剂量分别为(21.26±9.62)、(25.26±15.68)及(15.50±7.838)mg/kg。惊厥持续时间约为30~60 s,能自行停止。各异丙酚处理组在给予异丙酚后很快抑制惊厥。
2.2 各组c-fos阳性细胞数的表达、NO含量和NOS活性表达比较 L(EG)、R(EG)和B(EG)组海马CA1区c-fos阳性细胞数、NO含量以及NOS活性表达较C(EG)组均显著增加,差异有统计学意义(P<0.001)。L(PG)、R(PG)和B(PG)组海马CA1区c-fos阳性细胞数、NO含量以及NOS活性较各组内相对应的L(EG)、R(EG)和B(EG)组的表达均明显减少,差异有统计学意义(P<0.001),见表1。
表1 各组海马CA1区c-fos阳性细胞数的表达、NO含量和NOS活性的表达 (±s)

表1 各组海马CA1区c-fos阳性细胞数的表达、NO含量和NOS活性的表达 (±s)
*P<0.05,**P<0.01
L(EG)(1)L(PG)(2)R(EG)(3)R(PG)(4)B(EG)(5)B(PG)(6)C(EG)(7)C(PG)(8)F P(1)∶(7)(3)∶(7)(5)∶(7)(1)∶(2)(3)∶(4)(5)∶(6)88888888 c-fos计数(cells/HP)105.31±13.570 73.970±8.331 115.750±11.450 79.838±7.882 198.625±22.791 99.038±11.828 14.575±4.4701 12.800±1.813 200.303**<0.001<0.001<0.001<0.001<0.001<0.001 NO含量(μmol/g)9.620±1.126 7.586±1.057 9.620±1.417 7.667±1.235 14.420±1.960 9.386±1.109 3.116±0.318 2.910±0.238 80.550**<0.001<0.001<0.001<0.001 0.002<0.001 NOS活性(×103U/g)0.332±0.045 0.248±0.034 0.326±0.068 0.250±0.047 0.822±0.092 0.477±0.062 0.104±0.045 0.104±0.026 115.224**<0.001<0.001<0.001<0.007<0.004<0.001组别 n
2.3 各组K值比较 L组与R组c-fos阳性细胞数K值、NO含量K值及NOS活性K值较B组均明显减小,差异有统计学意义(P<0.001)。L组与R组c-fos阳性细胞数K值、NO含量K值以及NOS活性K值比较,差异均无统计学意义(P>0.05),见表2。
3 讨论
异丙酚是临床常用的静脉麻醉药,临床及动物实验表明其单独及复合其他麻醉药均可抑制伤害性刺激引起的运动反应[2-3]。目前异丙酚抗惊厥作用机制尚不明确,推测可能与丙泊酚减少兴奋性氨基酸释放、抑制钙超载、降低NOS活性和抑制NO合成等有关[4]。本研究显示,各异丙酚处理组在给予异丙酚后很快抑制惊厥,且多在15 s内,头面部及四肢抽搐甚至角弓反张消失,呼吸急促转为平稳而无呼吸抑制,整体处于安静状态,甚至有些大鼠在15 s静脉注射异丙酚过程中即抑制惊厥,且异丙酚抑制各组惊厥发生的表现没有明显区别,表明2 mg·kg-1的异丙酚用量(诱导剂量)通常是安全的,对于局麻药中毒惊厥的抑制作用完善、可靠。
c-fos基因在海马CA1区组织受到轻微刺激时就能表达,在对海马CA1区功能的分子水平的研究中起到至关重要的作用,惊厥发作时,在海马CA1区见到较多的c-fos表达,2~4 h时达高峰期,8 h后降至正常[5]。在研究方法上,由于c-fos阳性细胞数对于不同刺激选择性差,易受其他非实验因素如光线、气味和应激的反应等的干扰,因此,除严格控制合适的实验条件外,对于如何排除无关因素的干扰以求得结果的正确性显得至关重要。本研究结果显示,L(EG)组、R(EG)组和B(EG)组的海马CA1区c-fos阳性细胞数较C(EG)组均显著增多,差异有统计学意义,表明实验组惊厥模型成功。
有研究显示异丙酚可抑制数个不同脑区NOS的活性,减少NO与环磷酸鸟苷(cGMP)的生成,提示NO在异丙酚的作用机制中可能发挥重要作用[6]。但这些实验均以翻正反射的消失作为产生麻醉状态的指标,只能表明NO与异丙酚的睡眠作用有关,未能进一步探讨其与异丙酚抗伤害作用的关系。Dillane等[7]研究表明异丙酚具有抗N-甲基-D-天冬氨酸受体(NMDA)作用,提示异丙酚可能是通过阻碍NMDA受体的激活、减少钙离子内流的方式进一步导致NOS活性降低和NO合成减少。
本研究结果显示,L(PG)、R(PG)和B(PG)组海马CA1区c-fos阳性细胞数、NO含量和NOS活性较各组内对应的L(EG)、R(EG)和B(EG)组均明显降低,表明异丙酚均能抑制这3种局麻药致惊厥引起的NO含量和NOS活性的增加,但L组与R组K值较B组NO含量和NOS活性K值明显减小,考虑可能是异丙酚抑制的B组惊厥引起的NO含量和NOS活性变化强于L组和R组所致,但L组与R组K值相差不大,考虑可能是由于异丙酚抑制L组和R组惊厥引起的NO含量和NOS活性变化的作用相当。
表2 3组K值比较 ( ±s)
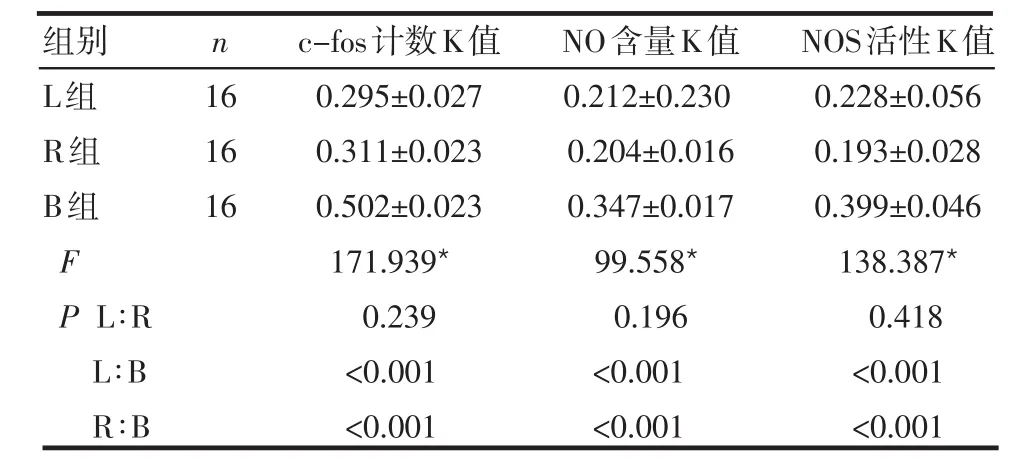
表2 3组K值比较 ( ±s)
*P<0.05,**P<0.01
组别L组R组B组F P L∶R L∶B R∶B n 16 16 16 c-fos计数K值0.295±0.027 0.311±0.023 0.502±0.023 171.939*0.239<0.001<0.001 NO含量K值0.212±0.230 0.204±0.016 0.347±0.017 99.558*0.196<0.001<0.001 NOS活性K值0.228±0.056 0.193±0.028 0.399±0.046 138.387*0.418<0.001<0.001
[1]Mulroy MF,Hejtmanek MR.Prevention of local anesthetic systemic toxicity[J].Reg Anesth Pain Med,2010,35(2):177-180.
[2]王强,徐礼鲜,陈绍洋,等.丙泊酚对布比卡因中枢及心脏毒性的治疗作用[J].临床麻醉学杂志,2009,25(10):881-883.
[3]Weinberg GL.Treatment of local anesthetic systemic toxicity(LAST)[J].Reg Anesth Pain Med,2010,35(2):188-193.
[4]Voss LJ,Sleigh JW,Barnard JP,et al.The howling cortex:seizures and general anesthetic drugs[J].Anesth Analg,2008,107(5):1689-1703.
[5]Morgan JI,Cohen DR,Hempstead JL,et al.Mapping patterns of c-fos expression in the central nervous system after seizure[J].Sci⁃ence,1987,237(4811):192-197.
[6]王钧,胡兴国,曾因明,等.异丙酚和氯胺酮对大鼠大脑皮层、小脑和脑干NOS活性和NO产量的影响[J].徐州医学院学报,1997,17(5):441-444.
[7]Dillane D,Finucane BT.Local anesthetic systemic toxicity[J].Can J Anaesth,2010,57(4):368-380.
