β-磷酸三钙表面吸附P-15多肽对细胞相容性的影响*
2011-07-21沈文文
赵 军 沈文文 樊 洪
外伤、炎症及肿瘤等常会造成口腔颌面部的骨质缺损,严重影响患者的生存质量,因此骨缺损修复的研究很有意义。β-磷酸三钙(β-tricalcium phosphate,β-TCP)等人工合成的骨替代材料表面常常缺乏细胞与细胞之间、细胞与基质之间信息交流的机制而影响了细胞的黏附,并进一步影响细胞的增殖与分化。P-15多肽是Ⅰ型胶原中含有细胞结合位点的15个氨基酸序列的人工合成肽,参与成骨性细胞的黏附、增殖与分化等生物学行为。本研究旨在观察β-TCP吸附P-15多肽后对细胞生长的影响,为进一步体内研究提供依据。
1 材料与方法
1.1 材料 β-TCP购自武汉华威生物材料工程有限公司,气孔率为40%~70%,气孔孔径为10~1000μm,平均380μm,抗压强度大于1.5×103kPa;P-15多肽冻干粉(GTPGPQGIAGQRGVV)由南京金思特科技有限公司合成,纯度大于90%。
1.2 主要试剂与仪器 DMEM培养液、胎牛血清(美国Gibco公司),Cell Counting Kit-8试剂盒(日本同仁化学研究所),碱性磷酸酶试剂盒(南京建成生物工程有限公司),BCATMpro⁃tein assay kit(Thermo Scientific),RIPA裂解液(上海碧云天生物技术有限公司),TJJ-1300超净台(北京半导体设备一厂),NAPCO细胞培养箱(美国Fisher公司),48孔培养板(Gibco),酶标仪(Thermo Labsysytems)。
1.3 方法
1.3.1 β-TCP/P-15复合材料的制备 将β-TCP修整成 5.0 mm×5.0mm×1.5mm大小,蒸馏水加压反复冲洗,高压蒸汽消毒备用。将P-15多肽溶解于PBS中,质量浓度为100 mg/L[1],过滤除菌。然后将β-TCP放到P-15溶液中,轻微震荡以确保P-15充分吸附到β-TCP中,室温条件下放置24 h,再用PBS冲洗去除未吸附的P-15,干燥后室温条件下储存在防潮的容器中。
1.3.2 成肌细胞的培养与刺激诱导 复苏由南开大学医学院分子遗传实验室提供并冻存的鼠成肌细胞系C2C12,待细胞正常生长后向培养基中分别加入100 μg/L和200 μg/L的骨形成蛋白 2(bone morphogenetic protein 2,BMP2)刺激C2C12细胞向成骨细胞转化。刺激液为含5%胎牛血清的DMEM培养液,培养4 d后测定碱性磷酸酶活性的变化。100 μg/L组、200 μg/L组及未刺激组的碱性磷酸酶活性分别为(1.98±0.07)U/g、(4.46±0.05)U/g及(0.53±0.02)U/g,后续实验使用200 μg/L的BMP2刺激的C2C12细胞。
1.3.3 细胞与修复材料体外培养 将β-TCP/P-15(β-TCP/P-15组)与β-TCP(β-TCP组)分别浸泡在培养液中,24 h后取出,置于48孔板中,分别加入诱导培养的1.2×106/mL的C2C12细胞悬液10 μL,3~4 h后加培养液至500 μL,置于CO2孵育箱内、37℃及5%CO2的饱和湿度条件下培养6 d。
1.3.4 细胞增殖情况的测定 β-TCP/P-15组于培养后的2、4及6 d,吸弃剩余培养基后,于培养孔中重新加入180 μL新培养基和18 μL CCK-8试剂,于细胞培养箱中孵育1~4 h,每孔均取出110 μL培养基转到96孔板中,用酶标仪选择波长450 nm测定其光密度(OD)值,每个时间点测4孔,第1个时间点测定后下2个时间点重新选取含有材料的培养孔进行测定。同时以刺激诱导的细胞培养于β-TCP上生长作为对照组,在相同时间点上进行检测。
1.3.5 蛋白质含量和碱性磷酸酶活性的检测 β-TCP/P-15组分别于培养后的2、4、6 d各取8块材料,分别用于蛋白质含量和碱性磷酸酶活性的检测,每组每个时点4块,消化收集细胞,PBS洗2遍,加入RIPA裂解液50 μL,冰上放置15 min,每5 min震荡1次,12 000 r/min离心20 min,取上清液。(1)BCA法测定蛋白质含量:每个时点取4块材料,按上述方法操作后,取上清液,测出各孔OD570的大小,根据标准曲线计算蛋白含量,同时以刺激诱导的细胞培养于β-TCP上生长作为对照组。(2)碱性磷酸酶活性的检测:β-TCP/P-15组按上述操作,取上清液30 μL,加入标本测定管中,按碱性磷酸酶试剂盒说明进行检测。碱性磷酸酶活性=(OD标本/OD标准)×酚的含量/蛋白质的含量。同时以刺激诱导的细胞培养于β-TCP上生长作为对照组,并比较2组中细胞在相同时间点的碱性磷酸酶活性的差异。
1.4 统计学分析 采 用SPSS 17.0软件进行分析,计量数据以均数±标准差(±s)表示,组间比较采用2独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组材料对细胞增殖的影响 β-TCP组与β-TCP/P-15组的细胞增殖情况随时间的延长而呈增加趋势,β-TCP/P-15组较β-TCP组各相同时点细胞增殖明显上升,差异有统计学意义(P<0.05),见表1。
表1 CCK8法测定2组细胞增殖情况的比较(n=4,OD值±s)

表1 CCK8法测定2组细胞增殖情况的比较(n=4,OD值±s)
*P<0.05;表2、3同
组别β-TCP β-TCP/P-15 t 2 d 1.141 3±0.083 9 1.391 5±0.060 2 4.844*4 d 1.568 5±0.048 9 1.871 0±0.462 0 8.994*6 d 2.123 8±0.061 6 2.364 8±0.074 6 4.980*
2.2 2组细胞蛋白含量的比较 2组细胞与材料复合培养的细胞蛋白含量随时间的延长而呈增加趋势,β-TCP/P-15组较β-TCP组各相同时点蛋白含量明显上升,差异均有统计学意义(P<0.05),见表2。
表2 BCA法测定2组细胞蛋白含量的比较(n=4,g/L±s)

表2 BCA法测定2组细胞蛋白含量的比较(n=4,g/L±s)
组别β-TCP β-TCP/P-15 t 2 d 0.620 0±0.042 4 0.820 0±0.077 5 4.529*4 d 1.000 0±0.021 2 1.360 0±0.033 7 15.123*6 d 1.480 0±0.108 0 1.847 5±0.094 3 5.126*
2.3 2组碱性磷酸酶活性的比较 在细胞与材料复合培养2 d时2组材料均未检测出碱性磷酸酶的活性;培养4、6 d后β-TCP/P-15组较β-TCP组各相同时点碱性磷酸酶的活性明显升高,差异均有统计学意义(P<0.05),见表3。
3 讨论
碱性磷酸酶是细胞向成骨细胞分化的标志之一,其活性水平代表了成骨细胞的分化程度,BMP2能够诱导鼠成肌细胞系C2C12向成骨细胞方向转化[2]。本研究结果显示,刺激后C2C12碱性磷酸酶的活性明显高于未刺激的C2C12碱性磷酸酶的活性,表明C2C12已向成骨细胞转化。
Ⅰ型胶原可促进成骨细胞的黏附、增殖与分化,这些功能与其分子结构中含有特定的氨基酸序列有关。Bhatnagar等[3]检测了Ⅰ型胶原的结构且在a1链中证实了有一段强力的细胞黏附性区域,此区域的序列为GTPGPQGIAGQRGVV(P-15)。然而在胶原分子的多链结构中,大部分结合位点未暴露而影响了细胞的黏附,采用克隆的方法将Ⅰ型胶原结合位点上这15个特殊氨基酸序列复制合成出来,得到的则是一种生物仿生材料[1]。P-15修饰材料后,可提高材料的生物活性,促进细胞的黏附与增殖,并且可促进细胞的分化能力。Emecen等[4]研究发现P-15与羟基磷灰石复合后能促进牙周膜纤维细胞的增殖及其细胞生长因子mRNA的表达。周炳荣等[5]合成了一种更短的多肽,含有6个氨基酸序列(P-6),其来源于P-15肽,并单独用含有不同浓度P-6的培养液培养骨髓间质干细胞,结果表明P-6能促进细胞的增殖。Neiva等[6]在临床试验中也证实了P-15是一种很好的仿生材料。
β-TCP为人工骨材料,比羟基磷灰石具有更好的骨传导性和生物降解性[7],但其骨诱导能力较弱,形成的骨量很少[8];并且材料表面亲水性较差,对细胞的吸附力较弱,材料内部不能获得足够的细胞浓度,需要在其表面复合细胞膜受体所能识别的特异性蛋白质,以促进细胞与材料的结合。本研究将P-15复合到β-TCP表面,选用CCK-8试剂盒检测细胞增殖情况,相对于传统的MTT法,其线性范围更宽,灵敏度更高,且结果显示P-15修饰后的材料在各个时间点均促进了细胞的增殖,表明β-TCP吸附P-15后,其表面性能得到改善,细胞易与材料结合,细胞复合后蛋白含量的测定结果与CCK8结果较一致,β-TCP经P-15修饰后细胞内的蛋白含量升高。另外,4、6 d时β-TCP/P-15组的碱性磷酸酶活性均高于β-TCP组,表明材料复合P-15后促进了细胞的分化,但在2个时点细胞碱性磷酸酶的活性均低于刚诱导完的C2C12的活性,考虑可能是诱导后的C2C12细胞还不稳定所致。
综上,β-TCP吸附P-15后的生物相容性得到了一定的提高,但改变P-15的浓度对生物相容性是否有一定的影响尚有待于进一步的研究。
表3 2组细胞内碱性磷酸酶的活性 (n=4,U/g±s)
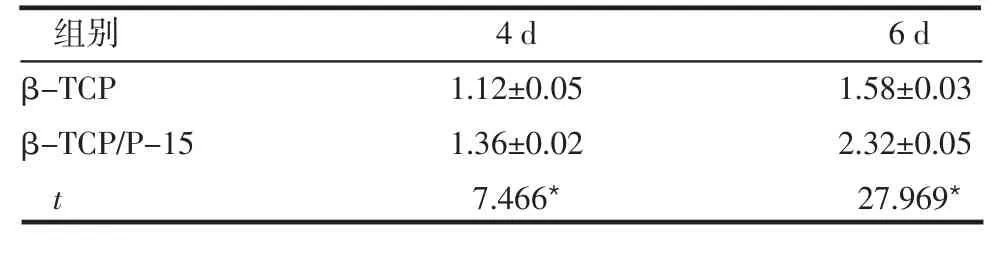
表3 2组细胞内碱性磷酸酶的活性 (n=4,U/g±s)
组别β-TCP β-TCP/P-15 t 4 d 1.12±0.05 1.36±0.02 7.466*6 d 1.58±0.03 2.32±0.05 27.969*
[1]Bhatnagar RS,Qian JJ,Wedrychowska A,et a1.Design of biomimet⁃ic habitats for tissue engineering with P-15,a synthetic peptide ana⁃logue of collagen[J].Tissue Eng,1999,24(5):53-65.
[2]翟春利,闫继东,杨爽,等.表达外源rhBMP2的CHO细胞株稳定性分析[J].生物工程学报,2008,24(5):862-866.
[3]Bhatnagar RS,Qian JJ,Gough CA.The role in cell binding of a be⁃ta-bend within the triple helical region in collagen alpha 1(I)chain:structural and biological evidence for conformational tautomerism on fiber surface[J].J Biomol Struct Dyn,1997,14(5):547-560.
[4]Emecen P,Akman AC,Hakki SS,et a1.ABM/P-15 modulates pro⁃liferation and mRNA synthesis of growth factors of periodontal liga⁃ment cells[J].Acta Odontol Scand,2009,67(2):65-73.
[5]周炳荣,华子春,胡勤刚,等.P-6对人骨髓间充质干细胞黏附和增殖特性的影响[J].口腔医学研究,2004,20(1):19-21.
[6]Neiva RF,Tsao YP,Eber R.Effects of a putty-form hydroxyapatite matrix combined with the synthetic cell-binding peptide P-15 on alveolar ridge preservation[J].J Periodontol,2008,79(2):291-299.
[7]Fujita R,Yokoyama A,Nodasaka Y,et a1.Ultrastructure of ceram⁃ic-bone interface using hydroxyapatite and beta-tricalcium phos⁃phate ceramics and replacement mechanism of beta-tricalcium phosphate in bone[J].Tissue Cell,2003,35(6):427-440.
[8]Takabata M,Kotani Y,Abumi K,et a1.An investigational study on the healing process of anterior spinal arthrodesis using a bioactive ceramic spacer and the change in load-sharing cf spinalins lrumen⁃tation[J].Spine,2005,30(8):195-203.
