胃癌手术前后外周血CD4+CD25+调节性T细胞的变化及临床意义
2011-07-13邱宇杰侯计平李富新李卫东
邱宇杰,侯计平,李富新,李卫东
(1.天津医科大学总医院普通外科,天津普通外科研究所,天津300052;2.天津市宝坻区人民医院普通外科,天津 301800)
世界范围内最常见恶性肿瘤中胃癌排第4名[1]。根据流行病学调查表明,日本、美国的胃癌发病率今年呈持续下降趋势,但我国仍属于胃癌高发国家。目前,胃癌的治疗以手术为主,但由于胃癌诊断时病期已偏晚,外科治疗的疗效不够满意。大量研究已表明恶性肿瘤的发生、发展与多种因素有关,其中包括机体的免疫功能失衡,在此状态下,肿瘤细胞逃避免疫细胞监控,发生免疫逃逸,最终导致肿瘤发生[2]。肿瘤的免疫内环境在肿瘤的形成发展过程中起到关键性作用。因此阐明肿瘤的发生、发展及预后与机体的免疫功能状态的关系,可利于建立新的治疗方法[3]。本研究目的旨在探索胃癌CD4+CD25+调节性T细胞(Treg)的变化特征及其与临床指标之间的关系,为新的治疗方法提供实验依据。
1 资料与方法
1.1 对象 在取得患者知情同意后,以天津医科大学总医院普外科2007年10月至2009年4月期间初治行手术切除治疗的胃癌患者共38例作为研究对象,其中男性26例,女性12例,年龄43~85岁,中位年龄为56.00岁,平均年龄(60.13±11.50)岁。收集每一例病人的临床资料,所有切除标本术后均得到病理学证实。同期随机收集在我院进行体检的健康者20例作为正常对照组,其中男性13例,女性7例,年龄40~78岁,中位年龄54.00岁,平均年龄(58.50±11.02)岁,并且所有受检者外周血中生化和免疫指标均正常。两组间性别和年龄经统计学分析无显著性差异(P>0.05),具有可比性。
1.2 材料 鼠抗人CD4-FITC/CD8-PE/CD3-Per-CP、CD4-PerCP、CD25-FITC 单克隆抗体、红细胞裂解液均为Becton Dickinson公司产品;4%多聚甲醛为武汉博士德生物工程有限公司产品。
1.3 免疫功能检测 抽取胃癌组术前3 d、术后14 d以及正常对照组外周血,所有受试者外周血标本均在清晨空腹下抽取,血液标本均在抽血后6 h之内处理。血标本以CD4-PerCP、CD25-FITC单克隆抗体及CD4-FITC、CD8-PE、CD3-perCP单克隆抗体分别对CD4+CD25+调节性T细胞及CD3+CD4+CD8+T细胞亚群进行标记并进行流式细胞学检测。所有受试者未进行过影响机体免疫状态的任何干预,包括放射治疗、化疗以及生物治疗。
1.4 统计学处理 实验结果应用SPSS15.0统计分析软件包处理。两独立样本非参数检验应用Mann-Whitney Test,两相关样本非参数检验应用Wilcoxon one-sample方法,完全随机设计多组样本非参数检验比较应用Kruskal-Wallis Test,描述两样本相关性应用Spearman’s秩相关检验。检验水准α为0.05。
2 结果
2.1 胃癌患者外周血Treg、CD4+T细胞、CD8+T细胞的表达
2.1.1 胃癌患者外周血Treg的表达 胃癌患者术前外周血Treg比例显著高于正常对照组,差异具有统计学意义;手术后外周血Treg比例与正常对照组比较,差异无统计学意义(表1)。胃癌患者术前外周血Treg比例显著高于术后比例,差异具有统计学意义(表 2)。

表1 胃癌患者手术前、后与对照组外周血Treg、CD4+T及CD8+T细胞比例的比较*Tab 1 Comparisons of Treg,CD4+T cell and CD8+T cell between gastric cancer patients of pre-and post-operation and control
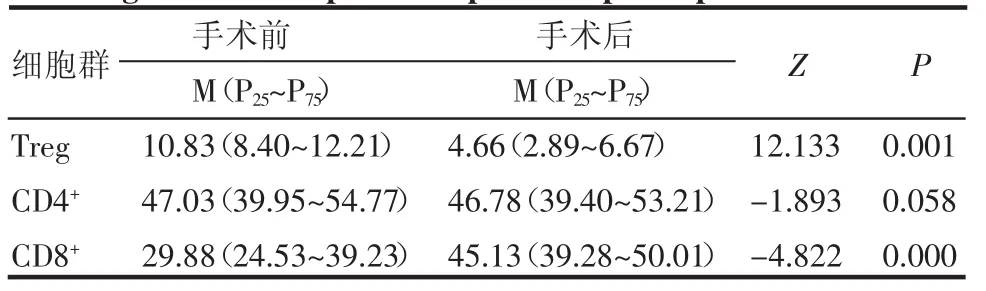
表2 胃癌患者手术后与手术前外周血Treg、CD4+T及CD8+T细胞比例的比较*Tab 2 Comparisons of Treg,CD4+T cell and CD8+T cell between gastric cancer patient of pre-and post-operation
2.1.2 胃癌患者外周血CD4+T细胞的表达 胃癌患者术前外周血CD4+T细胞比例与正常对照组相比,两者之间差异无统计学意义;胃癌患者术后外周血CD4+T细胞比例与对照组比较,两者之间差异无统计学意义(表1)。胃癌患者术后外周血CD4+T细胞比例与术前比较,两者之间差异无统计学意义(表 2)。
2.1.3 胃癌患者外周血CD8+T细胞的表达 胃癌患者术前外周血CD8+T细胞比例明显低于正常对照组,差异具有统计学意义;胃癌患者术后外周血CD8+T细胞比例与正常对照组比较,两者之间无统计学差异(表1)。胃癌患者术后外周血CD8+T细胞比例明显高于术前,差异具有统计学意义(表2)。
2.2 相关性分析
2.2.1 胃癌患者术前外周血Treg比例在不同淋巴结转移情况和TNM分期之间差异具有统计学意义(P<0.05)(表3),其与淋巴结转移和TNM分期呈正相关,相关系数分别为 0.521、0.533,P值均为0.001,与肿瘤浸润深度、远处转移、肿瘤分化程度及病理类型均无相关性(P>0.05)。Ⅲ、Ⅳ期胃癌患者外周血中Treg比例显著高于Ⅰ期,差异具有统计学意义(P<0.008),Ⅳ期胃癌患者外周血中Treg比例亦显著高于Ⅱ期,差异具有统计学意义(P<0.008),其它各分期之间胃癌患者外周血中Treg比例差异无统计学意义(P>0.008)。
2.2.2 胃癌术前术后外周血中Treg比例下降程度与浸润深度、淋巴结转移、远处转移、TNM分期、分化程度、病理分型以及手术方式均无相关性(P>0.05)。
2.2.3 胃癌患者术前、术后外周血CD8+T细胞比例与Treg比例呈负相关(表4)。

表3 有无淋巴结转移、不同TNM分期之间胃癌患者术前外周血中Treg比例的比较Tab 3 Comparisons of Treg between different status of lymph node metastasis and TNM staging of gastric cancer patients

表4 胃癌患者手术前、后外周血Treg、CD8+T细胞比例的关系*Tab 4 Relationship between Treg and CD8+T cell of gastric cancerpatients of pre-operation and post-operation
3 讨论
1995年,Sakaguchi等[4]首次分离获得CD4+CD25+调节性T细胞亚群。随着分子生物学的飞速发展,Treg作用机制逐渐被阐明,其调节功能在机体免疫稳态维持、移植耐受、肿瘤免疫、过敏反应及微生物感染等方面均得到了证实。正常状态下,Treg调节正在进行的免疫反应和Treg的数量,预防自身免疫功能失调。其数量和功能的增高或减低,必然相应地导致免疫抑制(例如肿瘤或感染)或自身免疫(例如多发性硬化症)[5]。大量的研究已表明恶性肿瘤的发生、发展与多种因素有关,其中包括机体的免疫功能失衡。近年研究发现,Treg在多种肿瘤患者的外周血和肿瘤组织中均有增高,提示肿瘤细胞可以产生一系列逃避抗肿瘤反应的机制,肿瘤患者体内Treg数量的增高即是抑制肿瘤免疫的机制之一,体外的试验也表明Treg能够抑制CD8+T细胞的增殖,提示该类细胞可能为肿瘤细胞的生长提供一个良好的环境,促进肿瘤的发展。在此状态下,肿瘤细胞逃避免疫细胞监控,发生免疫逃逸,最终导致肿瘤发生[2]。
Treg在机体内维持一定的比例,在健康人外周血中能够监测到Treg,其比例可在一定程度上反映机体的免疫状态。本文正常对照组结果为(4.56±3.03)%,该比例指的是其群细胞与T淋巴细胞的比例,和文献报道相一致,可以作为深入研究的对照基础。Anna等[6]研究了42例不同上皮细胞来源的恶性肿瘤患者及健康人外周血的CD4+CD25+Treg分布情况,结果发现肿瘤患者外周血的CD4+CD25+Treg均有升高,而健康对照组未见升高。Shah等[7]研究了40例宫颈癌标本,CD4+CD25+Treg的高表达即意味着明显下降的生存率。本文结果经统计学分析表明,胃癌患者术前外周血中Treg比例显著高于对照组(P<0.01),而术后外周血中Treg与对照组无显著差异;淋巴结转移阳性胃癌患者术前外周血中Treg比例高于淋巴结转移阴性患者(P<0.01)。胃癌患者外周血中Treg比例与淋巴结转移呈正相关;各TNM分期之间胃癌患者术前外周血中Treg比例有显著差异(P<0.05),进一步行各TNM分期之间两两比较发现,Ⅲ期、Ⅳ期胃癌患者术前外周血中Treg比例均较Ⅰ期显著增加(P<0.008),Ⅳ期胃癌患者术前外周血中Treg比例亦显著高于Ⅱ期(P<0.008),表明Treg比例的增高使机体产生肿瘤免疫耐受,抑制机体的抗肿瘤免疫,最终导致肿瘤的发生。Treg比例在一定程度上反映疾病的进展情况,甚至能作为检测疾病进展的免疫学指标。
本文结果显示胃癌患者术前外周血中CD4+T细胞比例与对照组无显著差异(P>0.05),说明CD4+T细胞不是影响肿瘤免疫的主要因素,而是其亚群Treg细胞参与肿瘤的免疫耐受,影响肿瘤的发生、发展。另一方面,胃癌患者术前外周血中CD8+T细胞比例明显降低,且胃癌患者术前外周血CD8+T细胞比例与Treg比例呈负相关,术后外周血CD8+T细胞比例与Treg比例亦呈负相关,即随着Treg比例的升高,CD8+T细胞比例下降。CD8+T细胞是主要的肿瘤免疫作用细胞之一,而肿瘤患者的这种细胞往往功能低下数量减少。提示Treg通过抑制CD8+T细胞的增殖以及抑制CD8+T细胞对癌细胞的细胞毒性作用,从而能够促进癌细胞的生长和进展。Li等[8]利用抗CD25抗体去除小鼠体内的Treg,实验结果显示Treg数量减少达到90%以上时可诱导抗肿瘤反应的一系列过程,其中包括肿瘤特异性CD8+T细胞的激活以及浸润肿瘤的CD8+T细胞数量的增多。
本文结果显示胃癌患者外周血中Treg比例及其变化在不同肿瘤浸润深度、远处转移、分化程度及病理类型间无显著差异,这一结果说明以上情况不是影响胃癌患者Treg比例的主要因素。胃癌术前术后外周血中CD4+CD25+Treg比例差值在不同浸润深度、淋巴结转移、远处转移、TNM分期之间的差异无统计学意义。另外,根治性手术胃癌患者术前术后外周血中CD4+CD25+Treg比例差值与姑息性手术比较,差异亦无统计学意义(P>0.05)。这提示无论肿瘤分期、分化程度、组织类型、原发灶深度及淋巴结转移情况如何,能否行根治性手术,只要去除肿瘤本身,就可以使外周血中CD4+CD25+Treg比例下降。这也从另一方面阐明切除肿瘤有助于CD4+CD25+Treg比例下降,从而改善机体的抗肿瘤免疫能力。
本文结果提示Treg可能通过抑制CD8+T细胞的增殖及功能,促进肿瘤细胞的生长和发展,这可能是肿瘤患者免疫功能受到抑制的机制之一。去除肿瘤本身,Treg比例显著降低,可以改善机体的抗肿瘤免疫能力,也说明了肿瘤本身在Treg细胞生成、增殖及聚集过程中起着重要作用。实验结果显示Treg与肿瘤的侵袭、淋巴结转移有关,提示Treg在一定程度上可作为检测疾病进展的免疫学指标。
[1]Conroy H,Marshall NA,Mills KH.TLR ligand suppression or enhancement of Treg cells?A double-edged sword in immunity to tumours[J].Oncogene,2008,27(2):168
[2]Ho PP,Steinman L.The aryl hydrocarbon receptor:a regulator of Th17 and Treg cell development in disease[J].Cell Res,2008,18(6):605
[3]Kamangar F,Dores GM,Anderson WF.Pattern of cancer incidence,mortality,and prevalence across five continents:Defining priorities to reduce cancer Disparities in Different Geographic Regions of the World[J].J Clin Oncol,2006,24(14):2137
[4]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of selftolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151
[5]Cools N,Ponsaerts P,Van Tendeloo VF,et a1.Regulatory T cells and human disease[J].Clin Dev Immunol,2007,2007:89195
[6]Anna MW,Dominik W,Michael S,et al.Increase of regulatory T cells in the peripheral blood of cancer patients[J].Clin Cancer Res,2003,9(2):606
[7]Shah W,Yan X,Jing L,et al.A reversed CD4/CD8 ratio of tumorinfiltrating lymphocytes and a high percentage of CD4(+)FOXP3(+)regulatory T cells are significantly associated with clinical outcome insquamouscellcarcinomaofthecervix[J].CellMolImmunol,2010,8(1):59
[8]Li X,Kostareli E,Suffner J,et al.Efficient Treg depletion induces T-cell infiltration and rejection of large tumors[J].Eur Immunol,2010,40(12):3325
