锂-空气电池的研究进展
2011-07-05蒲薇华邓长生
高 勇,王 诚,蒲薇华,邓长生
(1.中国地质大学材料科学与化学工程学院,湖北武汉 430074;2.清华大学核能与新能源技术研究院,北京 100084)
锂-空气电池的理论比容量和比能量高(11 140Wh/kg,将O2计算在内也有5 200 Wh/kg),对环境友好,是目前备受关注的能量转换体系。锂-空气电池的正极活性物质O2可以直接从周围空气中获得,因此理论比能量高于目前很多常规的电源体系,是目前高性能锂离子电池的10倍多,与汽油-氧气体系的11 860 Wh/kg接近[1-3]。
K.M.Abraham等[1]制作了聚合物电解质体系的锂-空气电池,获得了1 400 mAh/g的放电比容量(0.1 mA/cm2),引起了广泛的关注。P.G.Bruce[2]验证了式(1)所示反应的可逆性,并采用有机系电解质,以MnO2为催化剂组装了锂-空气电池。电池以70 mA/g的电流循环50次后,仍保持了600 mAh/g(碳粉)的放电比容量。

T.Kuboki等[3]使用憎水型离子液体电解质,获得了高达5 360 mAh/g(碳)的放电比容量(0.01 mA/cm2)。PolyPlus电池公司提出了两种电解质共存的锂-空气电池体系[4],即Li/有机系电解质/锂离子导体/水性电解质/空气电极,组装的Li/有机系电解质/锂铝钛的磷酸盐(LATP)/KOH溶液/空气电极电池体系,实现了500 h连续放电,电池的放电(0.5 mA/cm2)比容量达 50 000 mAh/g(碳+粘结剂+催化剂)。
锂-空气电池的理论比容量和比能量很高,但是实际得到的比容量和比能量远低于理论值。本文作者介绍了锂-空气电池各部件对电池性能的影响及目前的一些研究情况。
1 负极锂的研究
要想实现锂-空气电池在周围环境中工作,必须保证金属 Li不与来自空气中的 H2O、CO2及 O2发生副反应,因此对金属Li的保护是制作负极材料的关键。与其他金属-空气电池一样,掺杂或合金化可用于保护金属Li。这些措施虽然能提高锂在工作中的安全性能,但降低了电池的输出性能,总体效果不理想[5]。J.Zhang等[6]从外部入手,在正极空气侧覆盖一层氧选择性膜,允许O2通过而阻止H2O进入,组装的电池在周围空气中稳定地工作了21 d。
水性电解质中,憎水的锂离子导体膜LATP系列[Li1+xAlxTi2-x(PO4)3、Li1+x+yAlxTi2-xSiyP3-yO12]可用于保护金属锂[7],但 LATP与金属锂直接接触,会生成绝缘相,使界面阻抗急剧增加,因此常在两者之间加入一些锂离子导体作为缓冲层。缓冲层与金属锂之间的接触阻抗是整个锂-空气电池阻抗的主要部分,必须寻找合适的方法减小该阻抗。憎水的LATP在碱性和强酸性环境中容易分解。无论是非水性还是水性电解质体系锂-空气电池,负极金属锂的保护都是一个难题,而且在充电过程中,负极和电解质界面上的电流分布不均匀,会形成锂枝晶,最终导致负极和正极之间的短路,缩短二次电池的使用寿命。缓解枝晶形成的常用方法是使金属锂与液体电解质隔开,如在金属锂表面涂一层锂离子导电的保护层,即让其具有一层固体电解质相界面(SEI)膜,减缓枝晶的形成,LATP就具有类似的作用[5];另一种方法是用固体电解质取代液体电解质,使用离子液体也能缓解锂枝晶的形成。M.Armand等[8]提出,可采用复杂的 LiX2-盐或使用单极导电性的电解质,解决枝晶问题。
2 正极的研究进展
2.1 多孔空气电极的研究
水性电解质的使用极大地“释放”了空气电极,而对于非水电解质体系锂-空气电池,放电容量与正极材料的孔隙率和孔容有关[9]。氧在正极的还原反应是在电解质、正极孔洞表面及氧气构成的三相界面上进行的,三相界面的总面积越大,能够容纳的放电产物就越多,就越能提高锂-空气电池的放电容量和持续放电能力。
J.Xiao等[9]比较了各种商业炭黑(BP2000、Calgon、Denka及KB)的性能,发现KB能在电解质中膨胀,形成更多的三相界面,以容纳更多的放电产物。S.D.Beattie等[10]以泡沫镍为基体,将KB和PVDF均匀分散至泡沫镍基体中,获得了很好的多孔结构,组装的电池的比容量(0.1 mA/cm2)可达5 813 mAh/g(碳)。G.Q.Zhang等[11]使用单壁碳纳米管/碳纳米纤维材料制作正极,在0.1 mA/cm2的放电电流密度下获得了2 540 mAh/g的比容量。X.Yang等[12]采用高孔体积分数的介孔泡沫碳材料制作的正极,获得了高于一些商业炭黑40%的放电容量。
一些数学模型的建立,为后续的材料选择和各部件结构设计提供了参考。R.E.Williford等[13]通过对正极结构的设计,提出“对偶孔”和“多重延时释放催化”的概念,期望获得持续高能量输出的锂-空气电池。S.S.Sandhu等[14-15]通过构建数学模型,研究了有机系电解质体系锂-空气电池各部件的结构和参数设计对电池比容量、能量密度及功率密度的影响,指出催化剂不均匀分布及电解质部分湿润空气电极的结构,有利于提高放电容量。
2.2 催化剂的研究
在水性电解质体系中,O2在正极还原成OH-,需要克服高的活化能,催化剂的使用必不可少。常用的贵金属催化剂(如Pt、Au等)在水性电解质中有很好的催化活性[16],一些其他廉价的催化剂也有不错的效果[4]。在非水电解质中,氧在正极还原成O2-或O22-,放电产物Li2O2的产生不需要O—O键的断裂[8],式(1)所示反应在没有催化剂时也能较容易地进行,放电电压约为2.6 V,但生成的Li2O2有很强的离子键,在没有催化剂存在时,充电电压约为4.5 V,当电池中有粘结剂或有机系电解质被氧化,引入 CO2,导致产生Li2CO3时,充电电压甚至高达4.8 V[17-18],因此催化剂的使用很有必要,它能在充电过程中促进Li2O2和Li2CO3的分解,提高循环效率。
非水电解质体系锂-空气电池常用的催化剂有金属(如Pt、Au和Pd等)及金属的氧化物(如MnO2、Fe2O3和CO3O4等)。A.Debart等[18]研究了各种催化剂对锂-空气电池性能的影响,发现催化剂对电池放电电压的影响不大,对放电容量、充电电压和循环性能有很大的影响。MnO2系列催化剂的催化活性较高、成本较低,以α-MnO2纳米丝为催化剂,获得了 3 000 mAh/g(碳)的放电(70 mA/g)比容量,充电电压为4.0 V时循环10次,具有很好的稳定性。A.K.Thapa等[17]将Pd/MnO2-PTFE涂覆在乙炔黑表面作为正极,缓解了Li2CO3的形成,可将充电电压降低到3.7 V,循环20次,获得了稳定的放电容量。Y.Lu等[19]发现:Pt和Au复合的纳米颗粒具有很好的双重催化作用,即对氧的还原和析出的催化活性很高,放电电压为 2.7 V,充电电压为3.5 V,充放电效率达77%。
3 电解质的研究进展
3.1 有机系电解质
有机系电解质是目前锂-空气电池中研究最多的非水电解质体系。有机系电解质常用的溶剂有碳酸酯类、醚类和烷烃类。醚类电解质在锂-空气电池中具有出色的稳定性和快速放电能力,黏性低于相同氧溶解度的碳酸酯类电解质[20]。有机系电解质的性质对锂-空气电池性能的影响见表1[21-23]。

表1 有机系电解质对锂-空气电池性能的影响Table 1 The effects of organic electrolyte on the performance of the lithium-air batteries
人们对氧在有机系电解质中的还原和析出反应机理进行了较多的研究。J.S.Hummelshøj等[24]结合密度泛函理论(DFT)计算,提出了如下的反应机制:
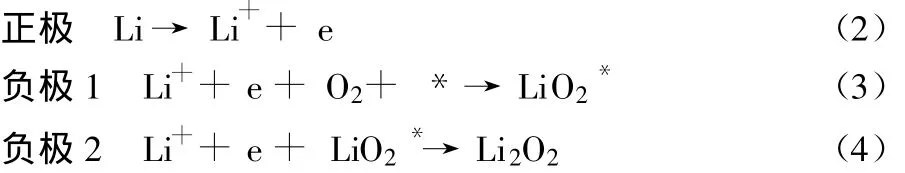
式(3)、(4)中,*表示 Li2O2表面放电产物生长的区域,LiO2*为锂空位。研究指出,Li2O2的绝缘性是充电和放电过程中极化的主要来源,而锂空位的存在为正极的电子传导提供了途径。
C.O.Laoire等[25]研究发现:氧的还原和随后的析出受电解质中溶剂和导电盐的影响很大。用K+或四丁基铵离子(TBA+)盐掺杂Li+盐作为复合导电盐,可部分溶解放电产物,且部分有机溶剂可与 Li+以配合物[Li+(solvent)n…O2-]的形式存在,高供电子数的溶剂能提高[Li+(solvent)n…O2-]配合物的稳定性,增加放电产物的可溶性。W.Xu等[26]以冠醚作为添加剂加到电解质中,发现12冠4和15冠5能与Li+络合,形成能溶解于有机溶剂的络合离子,不仅提高了电解质的电导率,而且有助于放电产物的溶解。
3.2 离子液体
离子液体具有许多优异的性能,如:通过阴阳离子的设计,可制备憎水型的离子液体,以缓解来自空气中的H2O与金属Li的反应;热稳定性高,可防止电解质在工作过程中挥发造成的电池容量下降。这些性能,使其具有成为锂-空气电池电解液的潜力。
离子液体用作锂-空气电池电解液,有不错的效果。P.C.Howlett等[27]研究发现:含有 Li(Tf)2N的离子液体[BMP](Tf)2N(1-丁基-1甲基吡唑双三氟甲磺酸酰亚胺)用作锂电池电解液,金属Li的腐蚀得到抑制,电池具有较低的自放电速率,且循环过程中抑制了锂的枝晶形式沉积,循环效率超过了99%。T.Kuboki等[3]研究了离子液体作为电解质溶剂,对锂-空气电池性能的影响。离子液体的使用提供了高的离子电导率,能防止Li与H2O的反应。以离子液体1-乙基-3-甲基咪唑双三氟甲磺酸酰亚胺(EMITFSI)为电解质溶剂的电池,正极碳材料(以酞菁钴为催化剂)具有高达5 360 mAh/g(碳)的放电比容量(0.01 mA/cm2)。
离子液体最大的缺点是黏度太高,导致锂离子电导率相对较低。即使是离子液体,也难以避免会吸收空气中痕量的水,对金属Li造成威胁,且离子液体作为电解质使用时,必须加入锂盐以提高电解质的锂离子导电性。锂盐的高度吸湿性,也是离子液体用作电解质的一个问题。
3.3 固体电解质
与其他电解质相比,固体电解质增加了电池的稳定性,扩宽了电池的操作温度,使电池更加安全,且具有更长的使用寿命和保存时间的潜力。
使用固体电解质组装全固体的锂-空气电池,突出的问题是固体电解质的锂离子电导率低,电池的内阻大,且金属锂与固体电解质之间的接触阻抗也显著影响着电池的性能。J.Kumar等[28]研究了聚合物陶瓷膜在锂-空气电池中的应用,发现Li2O和BN在聚合物中的掺杂可加快负极的电荷传递,提高聚合物的 Li+导电能力。B.Kumar等[29]以干燥的聚环氧乙烯(PEO)、LiN(SO2CF2CF3)盐、Li2O和 BN混合制得聚合物陶瓷,以锂铝锗的磷酸盐(LAGP)作为固体电解质隔膜,按Li/PC/LAGP/PC/碳-GC的结构复合正极,组装了全固体的锂-空气电池,具有良好的热稳定性和循环性能,但电池的容量不高,尤其是低温下接触阻抗的增加,导致电池的输出性能更差。
3.4 水性电解质
水性电解质中没有正极孔洞堵塞的问题,且氧在水性电解质中溶解度和扩散速率较高,为高倍率放电提供了支持。在水性电解质中使用的LATP膜在碱性环境中不稳定,且在电池操作温度下,LiOH在水中的溶解度为12.8 g,深度放电会有LiOH固体析出,是该体系的不足之处。
S.Hasegawa等[7]研究了LATP膜在水性电解质中的稳定性,发现LATP在强酸性和碱性溶液中均不稳定,在中性和弱酸性环境下较稳定。即使 LATP能在中性溶液中稳定存在,但电池在工作过程中产生的OH-将不断补充到电解质中,电解质的碱性将不断增强,相同的问题仍会存在。一个机械式循环可充[4]的想法能解决这一问题,但这一操作不仅会增加成本,而且对于便携式电源不适用。Y.Shimonishi等[30]发现:LATP浸润在LiAc饱和的HAc水溶液中十分稳定。以HAc水溶液为电解液,电池放电产物为LiAc和H2O,溶液能保持pH值基本不变,而乙酸溶液在较高的电位下具有很好的电化学稳定性,是很有希望的水性电解质。T.Zhang等[31]以LiAc饱和的HAc水溶液为电解质,组装Li/PEO18LiTFSI/LTAP/HAc-H2O-LiAc/空气电极体系的电池,在1 mA/cm2的电流密度下放电,锂的溶解/沉积极化很小,并具有较好的电化学可充性。
水性电解质体系的锂-空气电池减轻了正极的负担,且充放电过程的低极化为获得高能量转换效率提供了保证,但电化学可充性不好,放电时消耗电解质,电解质的含量控制和补充麻烦,实际的总放电容量将低于非水电解质体系。
4 结语
锂-空气电池具有高的理论比容量和比能量,而且对环境友好,有成为下一代电源体系的潜力。然而其产业化道路还十分遥远,以下是针对目前研究中暴露出来的问题以及后续研究的一些建议:
研究新的材料和材料制备方法。研究抗氧化的电解质和正极材料,防止电池内部材料造成的放电产物碳酸盐化。研究性价比更高的催化剂,减小充放电过程中的过电位,提高电池的功率密度、充放电循环效率以及电池寿命。发展纳米结构的空气电极,优化反应物的传输通道,为放电产物的沉积提供合适的空间。
研究O2在各种电解质中的还原和析出的本质。对于非水电解质体系,在优化正极结构、增加正极可容纳的放电产物的同时,优化电解质组成,增加放电产物的溶解,提高氧在其中的溶解度和扩散速率,提高高倍率放电性能。对于水性电解质体系,防止电解质的挥发,增加电解质的利用率。
发展合适的氧选择性材料和其他恰当的保护措施来防止空气中H2O、CO2进入电池体系对金属锂和放电产物造成危害,增强电池的环境适应能力,保证电池整体的使用寿命。采取恰当的方法缓解或者抑制充电过程的锂枝晶化。
致谢:对清华大学核能与新能源技术研究院何向明教授的支持表示感谢。
[1]Abraham K M,Jiang Z.A polymer electrolyte-based rechargeable lithium/oxygen battery[J].J Electrochem Soc,1996,143(1):1-5.
[2]Bruce P G.Energy storage beyond the horizon:rechargeable lithium batteries[J].Solid State Ionics,2008,179(21-26):752-760.
[3]Kuboki T,Okuyama T,Ohsaki T,et al.Lithium-air batteries using hydrophobic room temperature ionic liquid electrolyte[J].J Power Sources,2005,146(1-2):766-769.
[4]Wang Y,Zhou H.A lithium-air battery with a potential to continuously reduce O2from air for delivering energy[J].J Power Sources,2010,195(1):358-361.
[5]Girishkumar G,McCloskey B,Luntz A C,et al.Lithium-air battery:Promise and challenges[J].Journal of Physical Chemistry Letters,2010,1(14):2 204-2 219.
[6]Zhang J,Xu W,Li X H,et al.Air dehydration membranes for nonaqueous lithium-air batteries[J].J Electrochem Soc,2010,157(8):A940-A946.
[7]Hasegawa S,Imanishi N,Zhang T,et al.Study on lithium-air secondary batteries-stability of NASICON-type lithium ion conducting glass-ceramics with water[J].J Power Sources,2009,189(1):371-377.
[8]Armand M,Tarascon J M.Building better batteries[J].Nature,2008,451(7 179):652-657.
[9]Xiao J,Wang D,Xu W,et al.Optimization of air electrode for Liair batteries[J].J Electrochem Soc,2010,157(4):A487-A492.
[10]Beattie S D,Manolescu D M,Blair S L.High-capacity lithium-air cathodes[J].J Electrochem Soc,2009,156(1):A44-A47.
[11]Zhang G Q,Zheng J P,Liang R,et al.Lithium-air batteries using SWNT-CNF buckypapers as air electrodes[J].J Electrochem Soc,2010,157(8):A953-A956.
[12]Yang X,He P,Xia Y.Preparation of mesocellular carbon foam and its application for lithium/oxygen battery[J].Electrochem Commun,2009,11(6):1 127-1 130.
[13]Williford R E,Zhang J.Air electrode design for sustained high power operation of Li-air batteries[J].J Power Sources,2009,194(2):1 164-1 170.
[14]Sandhu S S,Fellner J P,Brutchen G W.Diffusion-limited model for a lithium-air battery with an organic electroly te[J].J Power Sources,2007,164(1):365-371.
[15]Andrei P,Zheng J P,Hendrickson M,et al.Some possible approaches for improving the energy density of Li-air batteries[J].J Electrochem Soc,2010,157(12):A1 287-A1 295.
[16]Lu Y,Gasteiger H A,Crumlin E,et al.Electrocatalytic activity studies of select metal surfaces and implications in Li-air batteries[J].J Electrochem Soc,2010,159(9):A1 016-A1 025.
[17]Thapa A K,Saimen K,Ishihara T.Pd-MnO2air electrode catalyst for rechargeable lithium/air battery[J].Electrochem Solid-State Lett,2010,13(11):A165-A167.
[18]Debart A,Bao J,Armstrong G,et al.An O2cathode for rechargeable lithium batteries:the effect of a catalyst[J].J Power Sources,2007,174(2):1 177-1 182.
[19]Lu Y,Xu Z,Gasteiger H A,et al.Platinum-gold nanoparticles:a highly active bifunctional electrocatalyst for rechargeable lithiumair batteries[J].J Am Chem Soc,2010,132(25):12 170-12 171.
[20]Read J.Ether-based electrolytes for the lithium-oxygen organic electrolyte battery[J].J Electrochem Soc,2006,153(1):A90-A100.
[21]Goodenough J B,Kim Y.Challenges for rechargeable Li batteries[J].Chem Mater,2010,22(3):587-603.
[22]Read J.Characterization of the lithium-oxygen organic electrolyte battery[J].J Electrochem Soc,2002,149(9):A1 190-A1 195.
[23]Xu W,Xiao J,Wang D,et al.Effects of nonaqueous electrolytes on the performance of lithium-air batteries[J].J Electrochem Soc,2010,157(2):A219-A224.
[24]Hummelshø j J S,Blomqvist J,Datta S,et al.Communications:elementary oxygen electrode reactions in the aprotic Li-air battery[J].J Chem Phys,2010,132(7):071101.
[25]Laoire C O,Mukerjee S,Abraham K M.Influence of nonaqueous solvents on the electrochemistry of oxygen in the rechargeable lithium-air battery[J].J Phys Chem C,2010,114(19):9 178-9 186.
[26]Xu W,Xiao J,Wang D,et al.Crown ethers in nonaqueous electrolytes for lithium-air batteries[J].Electrochem Solid-State Lett,2010,13(4):A48-A51.
[27]Howlett P C,MacFarlane D R,Hollenkamp A F.High lithium metal cycling efficiency in a room-temperature ionic liquid[J].Electrochem Solid-State Lett,2004,7(5):A97-A101.
[28]Kumar J,Kumar B.Development of membranes and a study of their interfaces for rechargeable lithium-air battery[J].J Power Sources,2009,194(2):1 113-1 119.
[29]Kumar B,Kumar J,Robert L,et al.A solid-state,rechargeable,long cycle life lithium-air battery[J].J Electrochem Soc,2010,157(1):A50-A54.
[30]Shimonishi Y,Zhang T,Johnsonb P,et al.A study on lithium-air secondary batteries-stability of NASICON-type glass ceramics in acid solutions[J].J Power Sources,2010,195(18):6 187-6 191.
[31]Zhang T,Imanishi N,Shimonishi Y,et al.A novel high energy density rechargeable lithium-air battery[J].Chem Commun,2010,46(10):1 661-1 663.
