自动化“点击合成”正电子标记肽类细胞凋亡显像剂18F-Pen-peptide
2011-06-30张锦明张晓军张宝石孙志军田嘉禾
张锦明 张晓军 张宝石 刘 健 王 卉 孙志军 田嘉禾
1(解放军总医院 核医学科 北京 100853)
2(解放军总医院第一附属医院 胸心外科 北京 100048)
正电子核素18F标记的肽、蛋白质、寡核苷酸等是用途较广的分子显像剂,用于肿瘤诊断及疗效评价[1,2]。18F标记这些生物小分子需特殊的联接剂,如 4-18F-氟苯甲醛、2-18F-氟丙酸、N-琥珀酰亚胺2-[18F]氟苯甲酸酯[3–5],采用这些中间体标记,生物分子反应步聚多、时间长、条件较为苛刻,易发生副反应,限制了18F标记的生物分子应用。采用温和反应,保护生物分子活性,减少副反应,快速、高效的标记方法对18F标记尤其重要。
Sharpless等[6]提出了“点击化学”,其核心是炔与叠氮反应形成杂原子链接单元(C-X-C)的新合成方法,具有条件温和、反应速度较快、立体选择性高等特点;在亚铜催化下,末端炔与叠氮化合物在常温下发生反应,生成稳定化合物。2006年,Marik等[7]用“点击化学”合成了小分子肽。此后,Hausner等[8]用“点击化学”合成了许多适于 PET成像的化合物,并比较了不同链接剂标记含20个氨基酸的肽(A20FMDV2)时的生物学分布,他们发现:用 2-18F-氟丙酸、N-琥珀酰亚胺 2-[18F]氟苯甲酸酯(18F-SFB)或 5-18F-戊炔标记的相同的 A20FMDV2时,三种标记物体内动力学有所差异,其中肿瘤摄取点击合成的肽更高、更特异。
我们对国产18F多功能合成器[9]的管线作了部分调整,以细胞凋亡Caspase3的肽类抑制剂为研究对象,前体中含Caspase3抑制剂的核心结构DEVD和叠氮,通过 5-18F-戊炔与叠氮前体反应,全自动点击合成18F-Pen-peptide,并经凋亡细胞初步证实。
1 材料与方法
1.1 仪器与试剂
Sumitomo HM-20S加速器,日本住友;PET-MF-2V-IT-1型多功能合成模块(配备 Alltech 626双泵和 UVSI 200全波长紫外检测器,Grace Alltima C-18(10´250) HPLC 柱),派特(北京)科技有限公司;BioScan-3000放射性薄层扫描仪和Bio-Scan Hot-Cell四路放射性探测仪,美国BioScan公司。HPLC系统配Waters 双515泵、2487紫外检测器、Bio-Scan FlowCount,美国Waters公司;流式细胞仪,美国BD公司;LC/MS/MS,API2000,美国ABI公司。
1.2 合成方法
合成分二步进行:1) 以5-OTs-戊炔为前体,在乙腈溶液中与干燥的18F/K2.2.2反应,生成 5-18F-戊炔,再与乙腈共蒸馏得纯的 5-18F-戊炔; 2) 在Cu(I)/抗坏血酸钠/TBTA体系中,在亚铜催化下、5-18F-戊炔与叠氮短肽在室温下点击反应15 min,经半制备HPLC柱梯度分离,收集主要产品,再经固相萃取得到产品,合成线路见图1。

图1 18F-Pen-peptide合成线路图Fig.1 Scheme of 18F-Pen-peptide synthesis.
2 实验内容
2.1 PET-MF-2V-IT-1型多功能合成模块的改造及准备
原有的多功能模块不适合自动化点击化学合成,需将第一反应管RV1的排气管V9阀排气口接到V10阀上,以便将生成的气态中间体通入到第二反应管RV2;同时将RV2更换成细管,方便少量溶液在 RV2内反应;在 RV2的底部放置 Bio-Scan Hot-Cell放射性探头,便于探测由RV1传输的放射性(图 2)。在 V0阀之间安装 QMA,用以捕获18F离子,在V22和V23之间安装Sep-Pak C-18柱。在1号瓶中加入1 mL乙腈溶解的20 mg K2CO3/7.5 mg K2.2.2;2号瓶中加入2 mL无水乙腈;3号瓶中加入0.5 mL无水乙腈溶解的20 mg 6-OTs-戊炔;4–6号瓶不用;7号瓶加入4 mL 0.2%(V/V)甲酸水溶液;8号瓶加入0.3 mL 0.1 mol/L硫酸铜溶液;9号瓶入装 0.3 mL 50%(V/V)乙醇与乙腈混合液溶解的 11 mg的TBTA;将20 mg的抗坏血酸钠和4 mg的叠氮短肽前体置于第二反应管内;固相萃取瓶13号瓶内装100 mL水;11号瓶装20 ml水;12号瓶内装1.5 mL的USP级无水乙醇;在V23产品出口处安装无菌滤膜和收集瓶。
2.2 自动化点击合成18F-Pen-Peptide
由派特(北京)科技有限公司提供的LibEditor的流程库编辑软件编写自动化合成程序,控制每个开关及加热的温度和时间,由上位机控制自动运行。过程如下:
(1) 加速器生产的18F–通过管线到QMA柱上被捕获,同时将氧-18水分离;
(2) 1号瓶的K2CO3/K2.2.2乙腈溶液将QMA上的18F–离子淋洗入第一反应管,通氮气并115°C加热共沸除水至干;
(3) 2号瓶中的无水乙腈加入第一反应管,重复共沸除水;
(4) 3号瓶中的前体加入干燥的第一反应管,110°C加热,密闭反应3 min;
(5) 8号瓶内的硫酸铜溶液加到第二应管,以溶解管内叠氮前体和抗坏血酸钠,将 9号瓶内的 0.3 mL乙醇与乙腈混合液溶解TBTA加到第二反应管内,通气混匀至透明;
(6) 再次加热第一反应管到 110°C,并通入氮气,将V9、V10、V16和V14打开,第一反应管内生成的 5-18F-戊炔由氮气载带入第二反应管,由Bio-Scan Hot-Cell放射性探测仪测量管内放射性,待放射性达到平衡后,并闭模块,在室温下静置15 min。
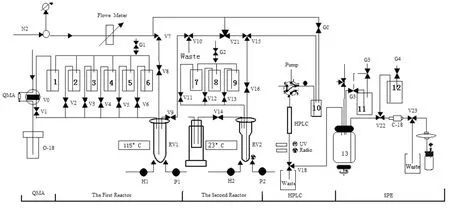
图2 多功能模块自动化点击合成18F-Pen-peptide示意图Fig.2 Schematics of the automated click chemistry synthesis of 18F-Pen-peptide on PET-MF-2V-IT-1.
(7) 启动 HPLC纯化程序,将第二反应管内的产品转移到 10号中转瓶,用 7号瓶内 4 mL 0.2%(V/V)甲酸水清洗反应瓶,并转移到10号瓶。打开G0将10号瓶内液体装载到LOOP环中,启动纯化;首先用 0.2%(V/V)甲酸作流动相,流速为 6 mL/min,第 5、10、15、20 min后改为5%(V/V)、10%(V/V)、15%(V/V)、18%(V/V)乙腈含 0.2%(V/V)甲酸;流速不变,第30–35 min出现产品峰,打开V18,将产品收集到固相萃取瓶13号内。
(8) 启动固相萃取程序,先将 HPLC收集液与100 mL水混匀,将混合液压出,产品被Sep-Pak C-18小柱吸附,用11号瓶内水清洗C-18柱,最后用1.5 mL USP乙醇将产品从C-18柱上淋下进入收集瓶,用生理盐水稀释。
2.3 化学纯度和放射化学纯度的测量
放射化学纯度用 HPLC测量,流动相为18%(V/V)乙腈含0.2%(V/V)甲酸,分析柱为:Grace Alltima C-18,5 μm,10 mm´250 mm,流速为 1 mL/min,紫外波长210 nm,用LC/MS/MS分析产品的比活度和产品中K2.2.2的含量[10]。
2.4 A549肺腺癌细胞经化疗后凋亡及对18F-Pen-Peptide摄取
常规方法在多孔板培养A549肺腺癌细胞中,分成化疗组和对照组,前者系在培养板上每孔内加入卡铂注射液100 μL(25 mg/mL),混匀后置入温箱中继续培养。24 h后培养板每孔中加入18F-Pen-peptide 50 kBq/100 μL,置入温箱中 60 min,测量A549肺腺癌细胞对18F-Pen-peptide的摄取率。
用流式细胞术Annexin V法定量检测平行对照组和化疗组细胞凋亡,应用Annexin V-fluos试剂盒进行 Annexin V-FITc(异硫氰酸荧光素)及碘化丙啶(PI)标记,用流式细胞仪检测磷脂酰丝氨酸(PS)外翻,计算凋亡率。
3 结果和讨论
3.1 18F-Pen-Peptide的点击合成
可用于18F标记的炔类很多,Marik等[7]比较了三种氟标记炔的沸点,其中 5-18F-氟戊炔的沸点为76°C,与乙腈相近,较易蒸出,本研究选用 5-18F-氟戊炔作链接剂。步骤如下:
第一步,在无水条件下经K2.2.2催化,氟离子亲核取代 6-OTs-戊炔上的甲苯磺酰基,生成 5-18F-氟戊炔。加热并通入氮气,将 5-18F-氟戊炔从 RV1蒸发到RV2中。因合成5-18F-氟戊炔时放射性活度高,无法直接测量从氟-18离子转化成5-18F-氟戊炔的效率,从 RV2外置的放射性探头估算,蒸馏到RV2的5-18F-氟戊炔合成效率约为51%。
全自动点击合成的关键是自动合成 5-18F-氟戊炔,普通多功能合成模块可合成 5-18F-氟戊炔,但不能将之蒸出。因其管线插到反应管底,以确保转移全部液体。本模块向反应管通入氮气和向外输送液体为同一管线,将排气管线通过V9接到V10上,通过V10的开闭,将RV1内气体排到空气中或排到RV2,达到除乙腈或蒸发5-18F-氟戊炔的目的。
第二步,在亚铜催化下,5-18F-氟戊炔与叠氮短肽前体发生点击反应,如直接用亚铜就需氮气保护,以防亚铜的氧化。本研究采用抗坏血酸钠还原硫酸铜的方法,将硫酸铜溶液和抗坏血酸钠分开放置,在5-18F-氟戊炔蒸馏前2 min混和,再加入TBTA后通入5-18F-氟戊炔,标记效率近99%(图3),只有在Rt=27 min处有一小杂质峰。

图3 半制备分离纯化18F-Pen-peptide的放射性HPLC图Fig.3 Semi-HPLC radio-chromatogram of purified18F-Pen-peptide.
经HPLC分离后,采用本模块配备的固相萃取程序,实现了全自动点击合成。以74–92.5 GBq的氟-18离子为原料,经HPLC纯化和固相萃取,最终合成得到14.8–22.2 GBq的产品,其放射性活度足以满足临床 PET/CT显像;合成效率为(21.0±4.5)%(n=6,未校正);所用时间为70 min,主要消耗在点击合成(15 min)和HPLC纯化(35 min),但该结果明显优于原来以18F-SFB合成18F-FB-RGD的结果[11](合成效率33.6%,不作校正为16.8%,耗时110 min)。
文献[12]采用一锅法点击合成了几个小分子化合物,即生成的18F-炔不从反应管内蒸出,直接在同一反应管内加入硫酸铜溶液、抗坏血酸钠、TBTA叠氮前体,最终合成效率在10%–30%。如果能采用一锅法点击合成生物分子,则采用普通的F-18多功能合成模块均可合成,目前未见文献报道类似工作,本研究也未作该方面的尝试。
3.2 18F-Pen-Peptide的质量控制
图4的HPLC分析表明,18F-Pen-peptide的放化纯度大于 99%,同时共进的标准品(19F-Penpeptide)的UV保留时间表明,放射性峰与标准品在HPLC上的保留时间相同,证实放射性物质为18F-Pen-peptide。其 LC/MS/MS测量发现放射性峰处有一1153.6质量峰,同时有一强的1175.6质量峰;1153.6是19F-Pen-peptide的m/e的质量峰,而1175.6则为络合了一个钠离子的峰。
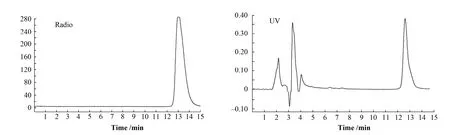
图4 纯化后的18F-Pen-peptide与标准品混进样的HPLC放射性和UV谱Fig.4 UV & radio-chromatogram HPLC of 18F-Pen-peptide with standards.
采用 LC/MS/MS测量标记物中的19F-Penpeptide的含量,并与标准曲线比对,测得产品的比活度为 870 GBq/μmol。
采用LC/MS/MS测量产品中K2.2.2含量,低于LC/MS/MS的测量灵敏度(10 ng/mL),原因是采用蒸发法制备 5-18F-氟戊炔,在 RV2中几乎不含K2.2.2,再经HPLC纯化,则K.2.2.2含量很低。
3.3 A549肺腺癌细胞经化疗后凋亡及对18F-Pen-peptide摄取
正常A549肺癌细胞与18F-Pen-peptide混合60 min后基本不摄取放射性,摄取率为(0.06±0.01)%,此时细胞凋亡率为(1.02±0.31)%;而经卡铂化疗的肿瘤细胞对放射性的摄取值为(0.86±0.04)%,细胞凋亡率为(10.23±2.43)%。可见化疗后肿瘤细胞凋亡增加,对18F-Pen-peptide放射性摄取也增加。
18F-Pen-peptide是含有DEVD核心的小分子肽,含DEVD的肽为细胞凋亡Caspase3的抑制剂,因此18F-Pen-peptide能与高表达Casepase3的凋亡细胞结合,放射性摄取值间接表达了细胞Caspase3的活性,从而表达了细胞凋亡的程度,18F-Pen-peptide与细胞凋亡的关系及动物 MicroPET显像将在其他文章中进一步报告。
4 结语
在修改后的 PET-MF-2V-IT-1型双管多功能合成模块上,以 5-OTs-戊炔为前体亲核反应制备了5-18F-氟戊炔,加热将之蒸馏到 RV2中,在亚铜催化下与叠氮前体发生点击反应生成18F-Pen-peptide,最后经HPLC纯化和固相萃取得到放化纯度高、比活度较高的凋亡显像剂18F-Pen-peptide,总合成效率为(21.0±4.5)% (n=6,未校正),最终产品的放化纯度为99%,比活度为870 GBq/μmol,合成时间为70 min。经A549细胞摄取表明,未化疗的肿瘤细胞基本不摄取放射性,卡铂化疗24 h后肿瘤细胞明显摄取放射性,凋亡增加,放射性摄取也增加。18F-Pen-peptide是有潜在临床应用价值的正电子肽类细胞凋亡显像剂。
致谢感谢西门子公司分子影像部的张健教授为本研究提供了关键试剂。感谢北京派特科技有限公司的胡晓平工程师为模块的修改提供了技术支持。
1 Zijlstra S, Gunawan J, Burchert W. Synthesis and evaluation of18F labeled recombinant annexin-V derivative for indentification and quantification of apoptotic cells with PET[J]. Appl Radiat Isot, 2003, 58(2):201–207
2 Wester H J, Hamacher K, Stocklin G. A comparative study of N.C.A Fluorine-18 labeling of protein via acylation and photochemical conjugation. Nucl Med Biol,1996, 23(3): 365–372
3 Speranza A, Ortosecco G, Castaldi E,et al. Fully automated synthesis procedure of 4-[18F]fluorobenzaldehyde by commercial synthesizer:Amino-oxi peptide labelling prosthetic group[J]. Appl Radiat Isot, 2009, 67(9): 1664–1669
4 刘晓飞, 张锦明, 田嘉禾, 等. 自动化合成 N-琥珀酰亚胺-4-[18F]氟苯甲酸酯[J]. 核化学与放射化学, 2008,30(1): 29–33 LIU Xiaofei, ZHANG Jinming, TIAN Jiahe,et al.Automatic synthesis of N-succinimidyl-4-[18F]fluorobenzoate [J]. J Nucl Radiochem, 2008, 30(1):29–33
5 Marik J, Hausner S H, Fix L A,et al. Solid-phase synthesis of 2-[18F]fluoropropionyl peptides[J].Bioconjugate Chem, 2006, 17: 1017–1021
6 Kolb H C, Finn M G, Sharpless K B. Click chemistry:diverse chemical function from a few good reactions[J].Angew Chem Int Ed, 2001, 40(11): 2004–2021
7 Marik J, Sutcliffe J L. Click for PET: rapid preparation of[18F]fluoropeptides using CuIcatalyzed 1,3-dipolar cycloaddition[J]. Tetrahedron Lett, 2006, 47(37):6681–6684
8 Hausner S H, Marik J, Gagnon M K,et al. In vivo positron emission tomography (PET) imaging with an specic peptide radiolabeled using18F-"Click" chemistry:evaluation and comparison with the corresponding 4-[18F]fluorobenzoyl- and 2-[18F]fluoropropionylpeptides[J]. J Med Chem, 2008, 51(19): 5901–5904
9 张锦明, 张晓军, 李云刚, 等. 双管18F多功能合成模块的研究[J]. 中华核医学杂志, 2010, 50(6): 410–413 ZHANG Jinming, ZHANG Xiaojun, LI Yungang,et al.Research on multifunxtional18F–synthesis module with two vessels. Chin J Nucl Med, 2010, 50(6): 410–413
10 张晓军, 李云刚, 刘健, 等. 液质联用法测定常用 F-18药物中Kryptofix 2.2.2的含量[J]. 同位素, 2011, 24(3):188–192 ZHANG Xiaojun, ZHANG Jinming, LIU Jian,et al.Measurement of Kryptofix 2.2.2 in F-18 radiopharmaceuticals by LC/MS/MS[J]. Isotope, 2011,24(3): 188–192
11 刘晓飞, 张锦明, 刘长滨, 等.18F-FB-RGD的自动化制备及其生物学评价[J]. 中华核医学杂志, 2011, 31(1):50–53 LIU Xiaofei, ZHANG Jinming, LIU Changbin,et al.Automatic synthesis of18F-FB-RGD and evaluation of its biodistribution[J]. Chin J Nucl Med, 2011, 31(1): 50–53
12 Sirion U, Kim H J, Lee J H,et al. An efficient F-18 labeling method for PET study: Huisgen 1,3-dipolar cycloaddition of bioactive substances and F-18-labeled compounds[J]. Tetrahedron Letters, 2007, 48(24):3953–3957
