血钠浓度对急性ST段抬高心肌梗死预后判断的意义
2011-06-30杨云仙廉滋爱
杨云仙,廉滋爱
低钠血症是常见的电解质紊乱,在心力衰竭中普遍存在,与心力衰竭不良预后相关,而低钠血症在急性ST段抬高型心肌梗死(ASTEM I)后的发生及对预后的影响尚不清楚。本研究分析了我院住院治疗的120例ASTEM I患者血清钠离子浓度与心肌酶、左心功能及住院病死率的关系,探讨低钠血症与ASTEM I临床预后的关系。
1 资料与方法
1.1 一般资料 我院2008年10月—2010年12月收治的ASTEM I患者120例,年龄42岁~85岁(60.5岁±8.9岁),均符合中华医学会心血管病学分会制定的诊断标准。发病在24 h内,除溶栓外均常规应用抗凝、抗血小板、他汀类药物,未曾用利尿药。所有患者均进行血清钠离子浓度、心肌酶、超声心动图检查,根据血钠浓度最低值分为3组,血钠大致正常组(正常组)Na+>130 mmol/L 50例;轻度低钠组(轻度组)Na+120 mmol/L~130 mmol/L 56例;重度低钠组(重度组)Na+<120 mmol/L 14例。
1.2 方法
1.2.1 血清钠、心肌酶测定 患者入院即刻、24 h、48 h取静脉血,常规方法测定血清钠离子浓度,取最低值进行比较分析。入院后8 h、24 h抽取静脉血,常规方法测定心肌酶学,取肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)最高值作为峰值进行分析。
1.2.2 超声心动图(UCG)检查 采用彩色多普勒血流仪,探头频率为2.5 MH z~3.5 MH z,于入院后24 h内行床旁检查,心尖四腔心切面测量左室舒张末内径(LVEDd)和左室射血分数(LVEF)等指标。
1.2.3 住院事件发生率 包括病死率、心源性休克、心力衰竭、心律失常的发生率。
1.3 统计学处理 应用SPSS 13.0统计软件。计量资料以均数±标准差(±s)表示,采用方差分析,计数资料采用 χ2检验。
2 结 果
2.1 3组各检测指标比较 重度组住院期间LVEF、CK、CK-MB、住院事件发生率均高于正常组和轻度组,差异有统计学意义(P<0.05);正常组与轻度组间差异无统计学意义(P>0.05)。详见表1。
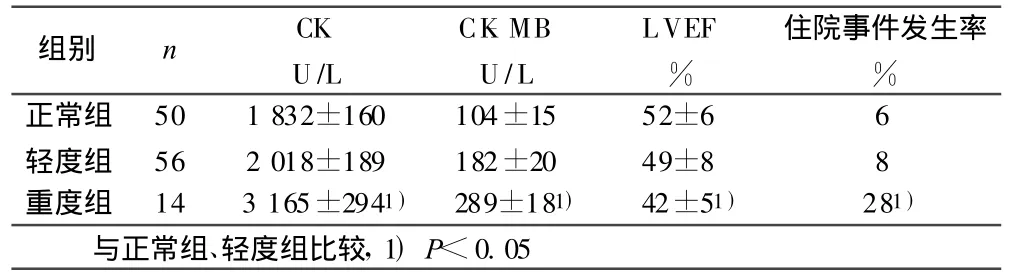
表1 3组各检测指标比较
2.2 死亡组与存活组血钠浓度比较 120例中死亡5例,检测其血钠浓度为(118±6)mmo l/L,存活115例,检测其血钠浓度为(132±4)mmol/L。死亡组血钠浓度明显低于存活组(P<0.05)。
3 讨 论
血清钠是血浆渗透压的主要组成部分,是细胞新陈代谢的基本条件,低钠血症是临床常见的电解质紊乱,急慢性心力衰竭时较普遍,并且是病情较重和预后不良的预测指标,近期在心肌梗死中报道较多,越来越引起重视。本研究结果也显示,低钠血症在ASTEM I急性期是比较常见的,文献报道占66.6%[1]。本研究发现血清钠离子浓度的高低与心肌坏死标志物、梗死面积及住院事件发生率密切相关,血清钠离子浓度越低,其心肌坏死标志物水平越高,梗死面积越大,住院事件发生率越高,同时心功能也有降低的趋势。随病情的好转血清钠离子浓度逐渐上升。对于导致低钠血症的原因及其因果关系,国内外文献尚无统一结论。有研究认为,急性心肌梗死(AM I)时存在与心力衰竭类似的神经内分泌的改变,可促进儿茶酚胺和心房利钠肽的释放及肾素-血管紧张素-醛固酮系统的激活,使细胞膜通透性增强,从而使钠离子排出增加、血钠降低;心肌缺血致钠泵活性受到抑制,也会引起低钠血症的发生,AM I后由于冠脉灌注不足、糖酵解增加引起代谢性酸中毒、内源性洋地黄因子增加及缺血再灌注产生大量氧自由基等原因,引起钠泵的进一步损伤[2],使维持的机制遭到破坏导致低钠血症。
冠状动脉血管闭塞后,心肌缺血坏死再灌注损伤,局部心肌细胞内外钠离子失平衡,心肌细胞内钠离子可增加至正常的2倍~5倍[3]。心肌细胞内钠离子浓度增高使心肌细胞内处于高渗状态,心肌细胞肿胀、坏死,心肌酶释放[4],肿胀的心肌细胞压迫心肌微血管,加重缺血缺氧,同时内皮功能受损导致无复流[5],使梗死范围扩大,进一步加剧心肌重构、心肌收缩及舒张功能进一步下降。AM I后心功能下降后又会导致神经内分泌系统激活,更进一步加重了低钠血症。同时发现严重的低钠血症很难纠正,其事件发生率很高,故应对低钠血症给予足够的关注。在临床基础方面还要做进一步研究,探讨此现象的发生机制,以便提出有效的干预措施,改善患者的预后。
[1] 王岚峰,李珍琴,汤清,等.急性心肌梗死低钠血症的预后价值[J].中华心血管病杂志,2006,34(3):243-246.
[2] Dhaila NS,Panagia V,Singal PK,et al.Alteration in heart membrane calcium transport during the development of ischemia reperfusion injury[J].J Mol Cell Cardiol,1998,20(Suppl 2):3-13.
[3] Wu CK,Lima JA.Noninvasive imaging of myocardial viability:Current techniques and future developments[J].Circ Res,2003,93:146.
[4] Jansen M A,Van Emous JG,Nederhoff MG,et al.Assessment of myocardial viability by intracellular 23Na mag netic resonance imaging[J].Circulation,2004,110:3457-3464.
[5] Kim RJ,Rudd BM,Chen EL,et al.Relationship of elevated 23Na magnetic resonance image intensity to infarct size after acute reperfused myocardial infarction[J].Circulation,1999,100:185-192.
