丙酮酸乙酯对新生大鼠缺血缺氧性脑损伤中 MM P-9表达的影响
2011-06-22顾镜月王凤娟
顾镜月,王凤娟
(1.佳木斯大学附属第一医院儿内一科,黑龙江 佳木斯 154003;2.佳木斯大学在读研究生,黑龙江 佳木斯 154007)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是围生期最常见的疾病,它不仅威胁新生儿的生命,而且有严重的神经系统后遗症[1]。血脑屏障破坏引起的血管源性脑水肿是 HIE最常见的病理改变。基质金属蛋白酶9(matrix metalloproteinase-9MM P-9)是蛋白水解酶家族之一,可以降解血脑屏障的基本结构-基膜,与血脑屏障的损伤导致血管源性脑水肿关系密切[2]。其活性主要受内源性基质金属蛋白酶抑制剂的抑制,但由于基质金属蛋白酶具有高度保守的同源序列,其特异性抑制剂人工重组很困难,因此寻找一种安全可靠的基质金属蛋白酶抑制剂可能为治疗 HIE提供一个方向。丙酮酸乙酯是一种安全、稳定的脂溶性丙酮酸衍生物,近几年研究表明[3]在多种疾病动物模型中有抗炎抗氧化等器官保护作用 ,但其对 MMP-9在新生大鼠脑损伤的影响目前国内尚无报道。本实验利用新生大鼠缺氧缺血性脑损伤模型,应用免疫组化法观察 MMP-9阳性细胞数,探讨丙酮酸乙酯对 MM P-9表达的影响及脑保护作用。
1 材料与方法
1.1 材料
1.1.1 动物
7日龄清洁级 Wistar大鼠(12.5g~ 16g)90只由佳木斯大学动物实验中心提供,不分雌雄随机分为三组:阴性对照组;缺血缺氧组 (HIBD组);丙酮酸乙酯治疗组(EP组),每组再分为 6h、24h、48h、72h、5d,5个亚组。
1.1.2 主要试剂
混合气体(O:8%,N:92%)购于佳木斯市金鼎氧气厂,丙酮酸乙酯购于 Sigma公司,MM P-9浓缩型兔多克隆亲和纯化抗体购于武汉博士德生物工程有限公司,SABC(兔IgG)-AP kit试剂盒购于武汉博士德生物工程有限公司,PBS购于北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 脑缺血缺氧模型制备
参照 Rice[4]方法,将新生 7日龄清洁级 Wistar大鼠乙醚麻醉后,做永久性左侧颈总动脉结扎,术后放回母鼠处恢复2h。然后,放入缺氧舱内封闭氧舱,通入缺氧混合气体(O:8%,N:92%)2h。HIBD组于缺血缺氧后10min腹腔注射生理盐水1.5mL。EP组大鼠于缺血缺氧后10min腹腔注射丙酮酸乙酯溶液(50mg/kg)[5]。
1.2.2 取材及切片制作
两组大鼠分别在缺血缺氧后的不同时间点灌注处死、断头取脑。取出的大脑放置于4%多聚甲醛内固定,4℃冰箱内保存。将固定好的大脑标本进行修块,梯度酒精脱水,二甲苯透明,液体石蜡包埋。用石蜡切片机做连续冠状切片。
1.2.3 HE染色
石蜡切片经脱蜡→水化→苏木精染色→流水冲洗→盐酸酒精分色→蓝化→伊红染色→梯度酒精脱水→二甲苯透明→中性树胶封片。
1.2.4 免疫组化染色
按照 SABC-AP免疫组化染色试剂盒说明操作,一抗为浓缩型兔多克隆亲和纯化 MM P-9抗体(稀释度1:100).阳性细胞着色表现为胞浆 /胞膜染成棕褐色,采用阳性细胞计数法,每张切片在400倍物镜下随机选取不重复的6个视野,计数 MMP-9阳性细胞数,取平均值为该张片子的阳性细胞数。
1.3 统计学处理
采用 SPSS17.0统计软件处理数据,以均数±标准差表示,多组间比较采用方差分析 ,均数间两两比较采用 t检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 HE染色脑组织病理改变
对照组脑结构完整,细胞形态正常层次分明;HIBD组细胞肿胀,神经元排列紊乱,核固缩、裂解,胞浆淡染,可见坏死液化灶及点状出血;EP组细胞水肿较 HIBD组减轻,未见坏死灶 (图 1)。
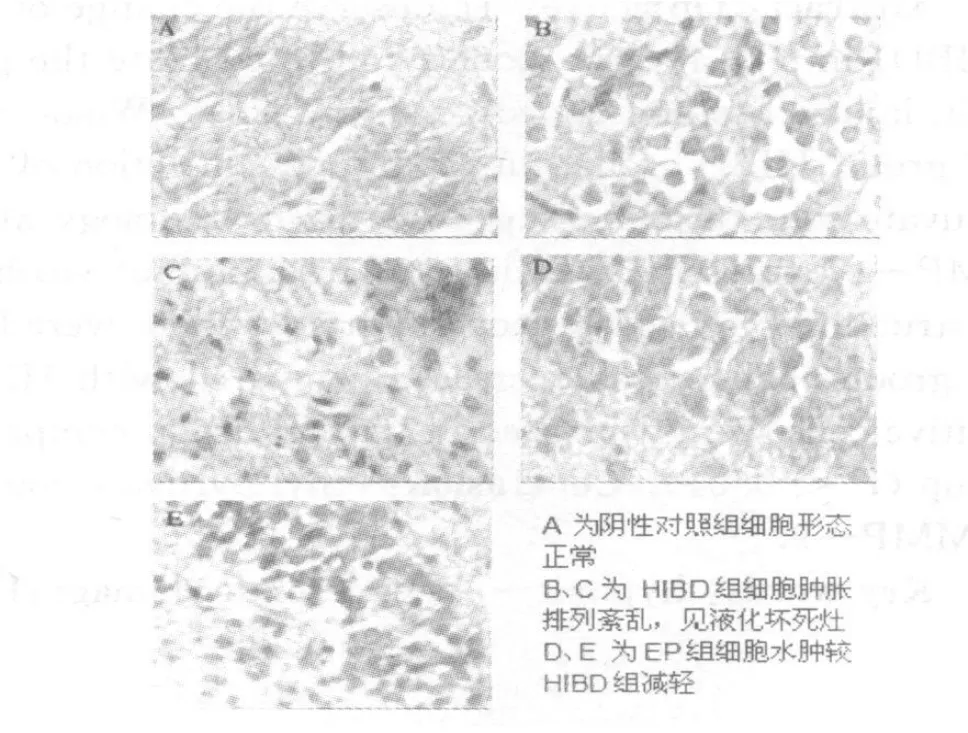
图1 脑组织 HE染色(×40)
2.2 MM P-9免疫组化结果
对照组 MM P-9微量表达,HIBD组 MM P-9阳性细胞呈胞质深染棕褐色,主要分布在大脑皮质椎体细胞,海马颗粒细胞层,纹状体 ,胶质细胞,神经原,血管内皮细胞。EP组MM P-9阳性细胞数较 HIBD组减少,但仍高于对照组 (表1)。
表1 各组 MM P-9阳性细胞数(±s,n=6)

表1 各组 MM P-9阳性细胞数(±s,n=6)
@与假手术组比较,P<0.01,* 与 HIBD组比较,P <0.05。
处理时间(h) 阴性对照 HIBD组 EP组62.05± 0.1010.10± 2.49@ 7.50± 2.04@*242.00± 0.1928.75± 2.29@ 14.50± 3.83@*482.05± 0.1026.70± 2.85@ 11.85± 2.56@*722.01± 0.1218.05± 2.35@ 11.75± 3.81@*1202.05± 0.1016.05± 3.25@ 9.70± 2.18@*
3 讨论
血脑屏障破坏引起的血管源性脑水肿[6]是缺血缺氧性脑损伤常见的病理过程,严重时形成脑疝导致死亡。基膜是血脑屏障的重要结构基础,主要由Ⅳ型胶原、层连蛋白、内肌动蛋白、纤维连接蛋白等细胞外基质蛋白组成。MM P-9能够切割细胞外基质的大多数组分,降解血脑屏障的基本结构基膜,与血脑屏障的损伤导致血管源性脑水肿关系密切。近年来研究发现,体外血脑屏障缺氧缺血[7]及大鼠脑缺血再灌注[8]均可导致 MM P-9表达增加。而 MM P-9基因敲除小鼠局部脑缺血后 BBB的损伤明显低于野生型小鼠[9]。本实验通过结扎7日龄新生鼠左侧颈总动脉及缺氧处理后,免疫组化法检测 MM P-9的表达,结果6h MM P-9阳性细胞数增多,24~ 48h最多,3d减少。与以上实验基本一致。因此,MM P-9可能是治疗缺血缺氧性脑病的一个靶点。体内MM P-9的活性受到多个水平的调节,其中内源性基质金属蛋白酶抑制剂与 MMP-9处于动态平衡维持正常生理功能。但由于 MM Ps具有高度保守的同源序列其特异性抑制剂人工重组很困难,目前人工合成的 MM Ps抑制剂因存在特异性低,毒副作用大应用受到限制。EP是一种安全、稳定的脂溶性丙酮酸酯化物,以往研究表明其具有很强的抗炎抗氧化作用。本实验研究发现 HIBD组脑细胞肿胀排列紊乱,部分核固缩裂解,可见坏死灶及点状出血。免疫组化法 MMP-9阳性细胞数强阳性表达,而腹腔注射丙酮酸乙酯后脑细胞水肿较对 HIBD组减轻未见坏死灶,MMP-9阳性细胞数较HIBD组减少,提示丙酮酸乙酯可以降低 MM P-9表达,减轻脑损伤,为临床治疗提供进一步的理论依据。
[1] Boichot C,Walker PM,Durand C,et al.Term neonate prognoses after perinatal asphyxia: contributions of MR imaging,M R spectrosco py,relaxation times,and apparent diffusion coefficients[J].Radiology,2006,239(3):839-848
[2] Zoppo GJ,Milner R,Mabuchi T,et al.Microglial activation and matrix protease generation during focal cerebral is chemia[J].Stroke,2007,38:646-651
[3] Fink M P,Mdfccm.Ethyl pyruvate:A novel anti-inflammatory agent[J].Critical Care Medicine,2003,31(1Suppl):51-56
[4] Rice JE,Vannucci RC,Brierlegey JB.The influence of immaturity on hypoxic-ischemic brain damage in the rat[J].Ann Neurol,1983,9:131-141
[5] 申红霞.丙酮酸乙醋对新生大鼠脑缺血缺氧损伤保护作用及其机制研究 [D].复旦大学,2008
[6] KlatzoI.Presidentaladdress.Neuropathological aspects of brain edema[J].Neuropathol Exp Neurol,1967,26(1):1-14
[7] 王卫东,黄虹,邹浩元,等.缺氧缺血对体外血脑屏障通透性的影响及其机制的研究 [J].实用医学杂志,2008,24(4):515-518
[8] 刘晓勇,张世明.大鼠脑缺血再灌注后 MM P- 9的表达及人工合成 E-选择素的干预作用[J].中国临床神经科学,2010,18(2):119-125
[9] AsahiM, AsahiK, Jung JC, etal. Rolefor matrix metalloproteinase 9 after focal cerebral ischemia:effects of gene knockout and enzyme inhibition with BB-94[J].J Cereb Blood Flow Metab,2000,20:1681-1689
