杜仲内生真菌的分离鉴定及其对异甜菊醇的生物转化研究
2011-06-22陈峻青王伊文冯成亮蔡进吉民
陈峻青,王伊文,冯成亮,蔡进,吉民
(1.东南大学化学化工学院制药工程系,江苏南京 211189;2.解放军302医院 药学部,北京 100039)
异甜菊醇属四环二萜类化合物,为来源于植物甜菊的天然甜味剂甜菊苷的酸水解产物。药理研究表明,异甜菊醇可抑制DNA聚合酶 polα活性,预防肿瘤细胞生长[1-2];可降低心肌细胞ATP水平,发挥抗心肌缺血作用[3-4];可降低细胞内钙离子浓度,使血管舒张,降低血压[5-6];可抑制单糖转运,减少葡萄糖生成[7-10]。由于其广泛的药理活性和极好的研究价值,对异甜菊醇的结构修饰和活性研究受到了较多的关注。生物转化是利用生物体系 包括真菌 细菌 植物离体培养细胞、组织或器官和动物细胞等)或其产生的酶制剂对外源性化合物进行结构修饰的生物化学过程。异甜菊醇的二萜骨架是研究生物转化反应的合适底物,利用合适的菌种,可在异甜菊醇碳架的非活性部位进行多种类型的区域选择性和立体选择性反应[11-12],但已发现的能够对异甜菊醇进行生物转化的菌株种类较少,且其生物转化反应类型单一。
植物内生菌[13]是指那些其全部或部分生活史在健康植物的各种组织或细胞内部度过的菌(包括放线菌),其存在不引起明显的宿主感染症状,是一个庞大的特殊微生物类群。内生菌具备许多显著又新颖的特性,并能分泌多种胞外酶以维护自身的生存状态,这些特定的酶类在一定条件下可被开发利用。目前国内外研究者们对内生菌的研究多集中于内生菌群体特征、次生代谢物中活性物质的分离提取及次生代谢产物的产生机理等,对植物内生菌用于外源性底物生物转化的报道很少。本研究从植物杜仲的根、茎、叶中分离内生真菌并进行初步鉴定,对获得的52株内生真菌进行了异甜菊醇转化活性的筛选研究,以期发现更多的异甜菊醇生物转化类型和转化菌株,并获取更多种类的药理活性物质。
1 材料与方法
1.1 材料
1.1.1 实验仪器和试剂 主要仪器:DHZ-D冷冻恒温振荡器(太仓实验设备厂),SW-CJ-1FD洁净工作台(苏州安泰空气技术有限公司),SHP-300F生化培养箱(上海三发科学仪器有限公司),EX20生物显微镜(宁波舜宇仪器有限公司),LDZX-50KB高压灭菌器(上海申安医疗器械厂),FA1004电子分析天平(上海恒平科学仪器有限公司)。
主要试剂:葡萄糖、乙酸乙酯、丙酮、石油醚、硫酸、乙醇、氯仿、甲醇、琼脂(分析纯,国药集团化学试剂有限公司),硫酸链霉素(华北制药股份有限公司),甜菊苷(95%,南京泽朗医药科技有限公司),异甜菊醇(自制,并经 IR,1HNMR,13CNMR,MS及元素分析确证),马铃薯(市售)。
1.1.2 杜仲样品 杜仲,取自南京老山,无其他病虫害。取材部位为根、茎和叶。
1.1.3 培养基 分离培养基(抗生素培养基):硫酸链霉素200 mg,琼脂20 g,水1 000 ml。菌种纯化及保藏均采用马铃薯葡萄糖琼脂(PDA)固体培养基:马铃薯200 g,葡萄糖 20 g,琼脂 20 g,水 1 000 ml。
1.2 内生真菌的分离纯化
取杜仲多年生根、茎,刮去外表皮后,剥下根皮、枝皮 用无菌水冲洗后剪成 的小块 置于75% 乙醇消毒 2 min,再用 2.5%次氯酸钠消毒10 min,最后用75%乙醇消毒1 min,无菌水冲洗3~4次,接入PDA平板培养基,28℃培养3~7 d。叶片冲洗后剪为0.5 cm×0.5 cm大小,作与根皮、茎皮相同的处理,接至PDA平板培养基,于28℃恒温培养。取切口处新长出的菌丝,及时转接至PDA培养基28℃恒温培养,并根据菌落形态、颜色差异及长出时间的不同,分别挑取各平板上菌落边缘的菌丝接于新的平板上进行分离培养。采用菌丝顶端纯化法逐步纯化,对菌株编号后,转至PDA斜面培养基,于28℃培养箱中培养4~5 d,然后放入4℃冰箱保存[14]。
1.3 内生真菌的分离鉴定
采用形态学法,根据内生真菌主要的群体形态特点(包括菌落大小、颜色、表面特征、质地)和个体形态特点(包括菌丝子实体和孢子形态),对其进行鉴定和分类[15-16]。
1.4 内生真菌的生物转化活性研究
1.4.1 内生真菌的培养 将分离获得的内生真菌分别接入PDA固体培养基中,于生化培养箱(28℃)中培养4 d备用。
1.4.2 异甜菊醇的制备及预处理 于500 ml三颈瓶中加入40 g(0.049 7 mol)甜菊苷,400 ml 10%硫酸,40 ml乙醇,在95℃下机械搅拌反应7 h。待冷,抽滤得黄色固体,乙醇重结晶,得白色固体12 g,收率76%。取0.1 g自制异甜菊醇溶于10 ml DMSO,紫外灯照射灭菌后,冰箱保存备用。
1.4.3 生物转化筛选实验 供筛选的杜仲内生真菌分别经平面PDA培养4 d后,用打孔器制成直径5 mm的菌饼,转接到装有20 ml发酵液的100 ml三角瓶中,28 ℃、150 r·min-1震荡培养 2 d 后,加入 0.2 ml底物溶液,使异甜菊醇的终浓度为0.1 mg·ml-1。并设3个对照:对照1(转化菌株+丙酮+培养基)、对照2(底物+培养基)和对照3(纯培养基+丙酮),以排除菌株自身的代谢产物、溶剂和培养基残留成分的干扰,考察转化液中是否存在非微生物引起的底物分解产物,并排除培养基成分和有机溶剂的影响。继续培养5 d,得发酵液[11-12,17-18]。
发酵液用等体积的乙酸乙酯萃取3次,菌丝体用丙酮浸泡,过滤并合并有机相,减压浓缩除去溶剂,TLC(薄层色谱法)检测底物转化情况[11-12,17]。
2 结 果
2.1 杜仲内生真菌的种群组成及不同部位的分布
从杜仲的根、茎、叶中分离得到52株内生真菌,经形态学方法观察 分属目科属表其中镰孢霉属最多,为9株,占17.31%;其次是交链孢霉属,为8 株,占15.38%;茎点菌属,为 7 株,占 13.46%;刺孢壳属为 株 占 这 属为杜仲的内生真菌优势属,占总数的57.69%。可见,杜仲内生真菌在种类组成上具有多样性。

表1 杜仲内生真菌的构成情况Tab 1 The composing of endophytic fungi in Eucommia ulmoides
杜仲植物内生真菌在不同的部位分布不相同(表2)。从表1及表2还可以看出,不同部位杜仲内生真菌的分布并不平均。从杜仲茎中分离出14株内生真菌,占总菌株的26.92%,属于7个属;根中分离出16株内生真菌,占总菌株的30.77%,属于5个属;叶中分离出22株内生真菌,占总菌株的42.31%,属于4个属,其中镰孢霉属为优势属,占总菌株的17.31%。

表2 内生真菌在杜仲植物中的分布Tab 2 The distribution in number and species of endophytic fungi in Eucommia ulmoides
2.2 杜仲内生真菌生物转化活性筛选结果
分离得到的52株杜仲内生真菌中,有4株内生真菌对异甜菊醇具有转化迹象(表3),分别为交链孢霉Alternaria sp.EL3、瘤座霉 Tubercularia sp.ER3、镰孢霉Fusarium sp.EL7及青霉Penicillium sp.ES2。其中交链孢霉Alternaria sp.和瘤座霉Tubercularia sp.对异甜菊醇的生物转化此前未见文献报道。
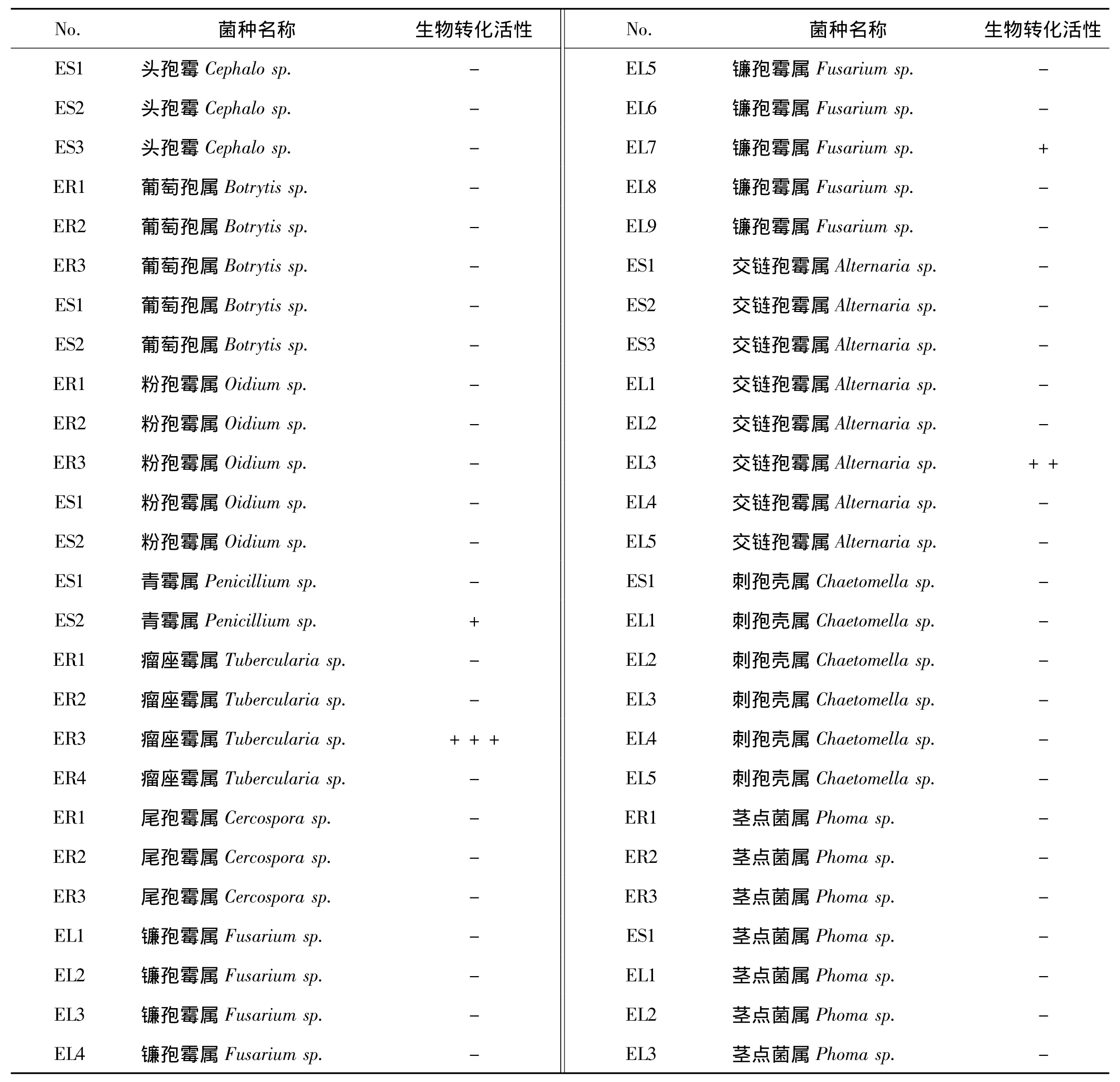
表 杜仲内生真菌对异甜菊醇的生物转化活性筛选Tab 3 Screening of biotransformation of isosteviol by endophytic fungi in Eucommia ulmoides
3 结 论
本研究从杜仲的根、茎、叶中分离到了52株内生真菌,经初步鉴定,分属于2纲,2目,4科,10属。其中茎部有14株(占总菌株的26.92%),属于7个属(占10个属的70%);根部有16株(30.77%),属于5个属(50%);叶部有22株(42.31%),属于4个属(40%)。
杜仲内生真菌对异甜菊醇的生物转化活性筛选结果显示,52株内生真菌中有4株能够对异甜菊醇进行生物转化,且交链孢霉Alternaria sp.和瘤座霉Tubercularia sp.对异甜菊醇的生物转化之前没有报道,说明内生真菌对异甜菊醇的生物转化具有较好的研究前景。对于内生真菌对异甜菊醇的生物转化产物的情况,我们还将继续深入研究。
[1]MIZUSHINA Y,AKIHIS T,UKIYA M,et al.Structural analysis of isosteviol and related compounds as DNA polymerase and DNA topoisomerase inhibitors[J].Life Sci,2005,77(17):2127-2140.
[2]TAKASAKI M,KONOSHIMA T,KOZUKA M,et al.Chemopreventive effects of stevioside and related compounds[J].Bioorg Med Chem,2009,17(2):600-605.
[3]赵蕾,许德义.ST-1抗豚鼠和兔心肌缺血再灌注损伤的血流动力学研究[J].东南大学学报:医学版,2004,23(6):384-387.
[4] XU D Y,ZHANG S J,DAVID FOSTER J R,et al.The effects of isosteviol against myocardium injury induced by ischaemia-reperfusion in the isolated guinea pig heart[J].Clin Exp Pharmacolo P,2007,34(5/6):488-493.
[5]WONG K L,CHANA P,YANG H Y,et al.Isosteviol acts on potassium channels to relax isolated aortic strips of Wistar rat[J].Life Sci,2004,74(19):2379-2387.
[6]LIU J C,KAO P F,HSIEH M H,et al.The antihypertensive effect of stevioside derivative isosteviol in spontaneously hypertensive rats[J].Acta Cardiol Sin,2001,17:133-140.
[7]ISHII E L,SCHWAB A J,BRACHT A.Inhibition of monosaccharide transport in the intact rat liver by stevioside[J].Biochem Pharmacol,1987,36(9):1417-1433.
[8]ISHII E L,BRACHT A.Glucose release by the liver under conditions of reduced activity of glucose 6-phosphatase[J].Braz J Med Biol Res,1987,20(6):837-843.
[9]NORDENTOFT I,JEPPESEN P B,HONG J,et al.Isosteviol increases insulin sensitivity and changes gene expression of key insulin regulatory genes and transcription factors in islets of the diabetic KKAy mouse[J].Diabetes Obes Metab,2008,10(10):939-949.
[10] MA J,MA Z,WANG J,et al.Isosteviol reduces plasma glucose levels in the intravenous glucose tolerance test in Zucker diabetic fatty rats[J].Diabetes Obes Metab,2007,9(4):597-599.
[11]AKIHISA T,HAMASAKI Y,TOKUDA H,et al.Microbial transformation of isosteviol and inhibitory effects on epsteinbarr virus activation of the transformation products[J].J Nat Prod,2004,67(3):407-410.
[12]CHANG S F,YANG L M,LO C H,et al.Microbial transformation of isosteviol and bioactivities against the glucocorticoid/androgen response elements[J].J Nat Prod,2008,71(1):87-92.
[13]邹文欣,谭仁祥.植物内生菌研究新进展[J].植物学报,2001,43(9):881-892.
[14]帖卫芳,胡鸢雷,祝建波,等.甘草内生真菌的分离及鉴定[J].生物技术通报,2010,(9):149-153.
[15]阿历索保罗C J,明斯C W,布莱克韦尔.菌物学概论[M].4 版.北京:中国农业出版社,2002.
[16]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979.
[17]de OLIVEIRA B H,STRAPASSON R A.Biotransformation of isosteviol by Fusarium verticilloides[J].Phytochemistry,1996,43(2):393-395.
[18]HSU F L,HOU C C,YANG L M,et al.Microbial transformations of isosteviol[J].J Nat Prod,2002,65(3):273-277.
