进展期胃癌根治术患者预后危险因素分析
2011-06-22陈千益欧敬民庄鹏远穆嘉盛忻卫平刘颖斌
陈千益,欧敬民,庄鹏远,穆嘉盛,忻卫平,刘颖斌
(1.上海市杨浦区老年医院普外科,上海 200090;2.上海交通大学医学院附属新华医院普外科,上海 200092)
大多数国家没有开展胃癌筛查,80%以上患者在确诊时已经处于中晚期。手术是治愈胃癌的主要手段,根治性切除是改善患者预后的关键因素。进展期胃癌即使接受根治性切除,术后复发转移的概率仍然较高。本研究回顾性分析675例行根治术的进展期胃癌患者资料,探讨临床病理因素及治疗措施对预后的影响,为提高外科治疗效果提供参考。
1 资料与方法
1.1 一般资料
选择1999年1月至2005年12月上海交通大学医学院附属新华医院胃肠外科数据库中资料完整接受根治性手术(D2或D3)的进展期胃癌患者675例,其中男436例,女239例,中位年龄63(28~84)岁。全部病例均排除远处转移及侵犯邻近脏器,术后均有明确的病理诊断。按照AJCC标准病检淋巴结数均在15个以上。肿瘤部位:胃上部217例,胃中部93例,胃下部365例;手术方式:近端胃大部分切除134例(D2109例、D325例),远端胃次全切除422例(D2338例、D384例),全胃切除119例(D286例、D333例);术后未接受化疗者134例,接受化疗者541例,均以氟尿嘧啶类药物(5-FU或卡培他滨)为基础进行3~6个周期的辅助化疗;在接受辅助化疗者中有67例在第2、3周期联合45Gy同步放疗。
1.2 病理学检查
浸润深度(T):T2426例(肌层235例、浆膜下层191例),T3249例(浆膜层);Borrmann分型:Ⅰ型86例,Ⅱ型246例,Ⅲ型255例,Ⅳ型88例;组织学类型:分化型腺癌321例(其中乳头状腺癌109例、高分化管状腺癌115例、中分化管状腺癌97例),低分化型腺癌250例(其中戒细胞癌137例、黏液腺癌113例),未分化癌104例;区域淋巴结(N):N0128例,N1395例,N2152例。按照2010年第七版《AJCC癌症分期手册》对675例患者进行TNM分期:ⅠB期82例,ⅡA期330例,ⅡB期170例,ⅢA期93例。常规术中切缘冰冻检查,切缘均为阴性(R0),其中A级(切缘1 cm内无癌细胞浸润)499例、B级(切缘1 cm内有癌细胞浸润)176例。
1.3 随访情况
有专职人员落实各项随访工作,采用门诊、电话及发信等方式对患者或家属进行随访,患者死亡随访即终止。所有存活患者术后随访时间均超过5年,记录的生存时间为手术时间至末次随访或死亡时间,或随访数据库截止的时间。
1.4 统计学处理
采用SPSS 16.0统计软件包对研究数据进行统计学分析。采用Kaplan-Meier单因素分析法对危险因素进行分析并绘制复发及生存曲线,比较采用Log-rank检验。采用Cox比例风险模型进行多因素预后分析。P<0.05为差异有统计学意义。
2 结 果
2.1 随访结果
截至2010年12月675例患者全部获得随访,术后1、3、5年的累积复发率分别为27.7%(187/675)、67.9%(458/675)和84.4%(570/675),中位复发时间为31.7个月(图1)。5年累积复发病例中,局部复发(残胃、吻合口、局部淋巴结)166例(29.1%),腹膜复发(腹壁、盆腔转移,可伴淋巴结转移)300例(52.6%),血源性复发(肝、肺转移,可伴腹壁盆腔种植、淋巴结转移)104例(18.3%)。中位随访时间为49.3(0.5~102)个月。全组患者1、3、5年总体生存率分别为 88.2%(595/675)、54.5%(368/675)和36.7%(248/675)(图2)。

图1 675例进展期胃癌患者根治术后复发曲线
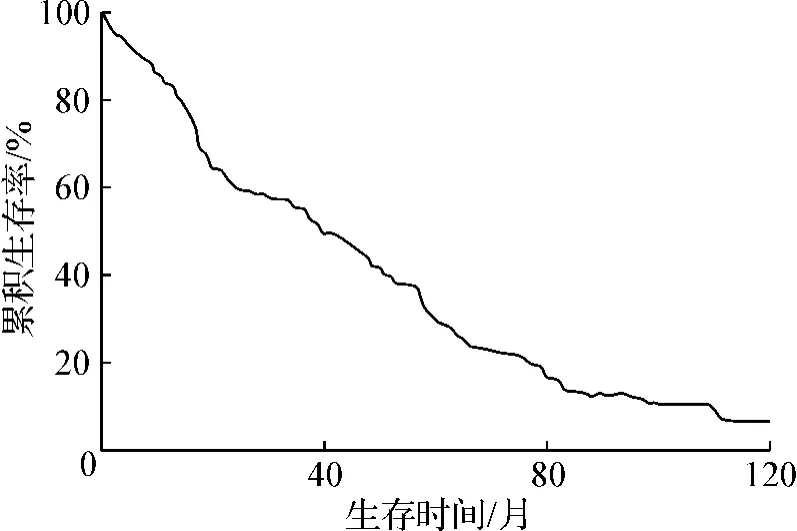
图2 675例进展期胃癌患者根治术后生存曲线
2.2 影响进展期胃癌根治术预后单因素分析
对临床资料进行单因素分析显示:性别、年龄与生存率无明显相关性(P>0.05),Borrmann分型、浸润深度、淋巴结转移、组织学类型、TNM分期、切缘情况及是否接受辅助性放化疗与进展期胃癌根治术预后密切相关(P<0.05)(表1)。

表1 患者临床病理资料及影响预后的单因素分析
2.3 影响患者预后的临床病理多因素分析
Cox比例风险模型分析:将肿瘤Borrmann分型、浸润深度、淋巴结转移、组织学类型、TNM分期、根治程度、切缘情况以及是否接受辅助性放化疗8项指标纳入Cox模型,以Enter法行多因素分析,结果发现组织学类型、TNM分期、切缘情况是影响进展期胃癌根治术患者预后的独立危险因素(P<0.05)(表2)。
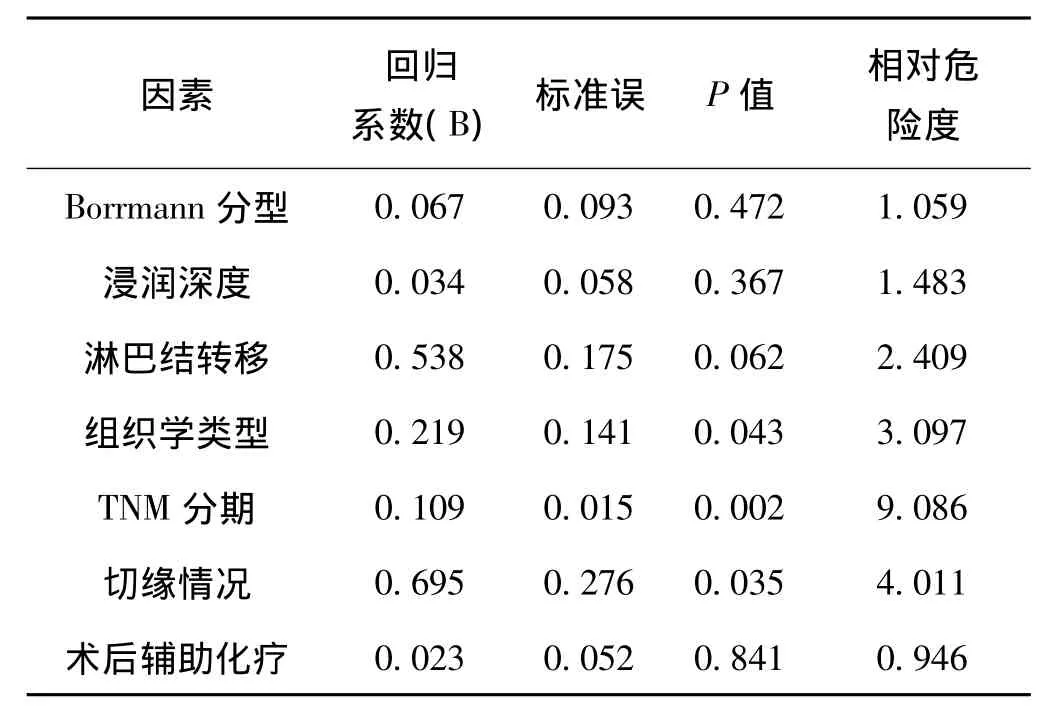
表2 675例进展期胃癌根治术后影响预后的Cox模型多因素分析(Enter法)
3 讨 论
手术是治疗胃癌的主要手段,根治性切除是改善患者预后的关键因素。但肿瘤存在易复发转移的生物学特性,进展期胃癌根治术后5年生存率为30% ~50%[1]。本组资料 1、3、5年患者总体生存率分别为88.2%、54.5%和36.7%。术后1、3、5年累积复发率分别为27.7%、67.9%、84.4%,低于吴亮亮等[2]报道的58.2%、89.4%、97.9%。本组平均复发时间为术后31.7个月,与Yoo等[3]报道相比术后复发时间平均推迟约10个月,分析原因可能与本组病例TNMⅠ、Ⅱ期比例大(占86%)、肿瘤分化程度高(分化型占47.6%)、根治程度高(D2或D3)、切缘均为阴性(切缘1 cm内无癌细胞浸润占73.9%)以及术后放化疗相关。
年龄、性别对胃癌预后的影响各家报道不一。本组单因素分析显示年龄和性别对胃癌根治术后5年生存率影响无明显差异(P>0.05)。近端胃癌与远端胃癌相比具有不同的临床病理学特点,No.10淋巴结转移率较高。黄昌明等[4]认为No.10淋巴结转移是影响患者预后的独立因素,但清扫No.10淋巴结是否需要联合脾切除目前仍存争议。本组患者No.10淋巴结转移率为17.6%,联合脾切除27例,术后5年生存率与脾未切除患者相似(P>0.05)。因此,我们认为常规或预防性脾切除并无必要,当脾脏或脾门处受累时可以考虑脾切除术。
Lipham等[5]报道胃癌的手术预后与肿瘤 Borrmann分型、TNM分期、组织学分型、肿瘤部位、淋巴结转移特点和淋巴结转移组别有关。本资料单因素分析表明Borrmann分型、浸润深度、淋巴结转移、组织学类型、TNM分期、切缘情况及是否接受辅助放化疗与进展期胃癌根治术预后相关(P<0.05)。BorrmannⅢ、Ⅳ型肿瘤侵袭边界不清、肿瘤浸润深度达到或超出浆膜层,淋巴及血性转移的比例较高,TNM分期较晚,预后差。本组资料显示同期BorrmannⅢ、Ⅳ型术后复发比例较Ⅰ、Ⅱ型高20%,死亡率高30%左右。
浸润深度是肿瘤分期中的一个重要评定指标,且与胃癌腹膜转移的发生显著相关[6]。Jovanovic等[7]研究发现浆膜是否受侵是影响患者预后的独立因素之一,浆膜受侵患者术后5年生存率为55.4%,明显低于未受侵者的88.4%。本组资料中浆膜受侵占38.5%,术后5年生存率明显低于浆膜未受侵犯患者(P<0.05)。本组资料中各组淋巴结转移率随着肿瘤的浸润深度增加而增加(P<0.05),提示肿瘤的预后与肿瘤的浸润深度和淋巴结转移度密切相关。多因素分析显示肿瘤的浸润深度不是影响胃癌根治术预后的独立因素,说明浸润深度的差异是影响胃癌根治术预后的协同因素,可能对胃癌根治术后复发的时间间隔有一定的影响。
胃癌的手术预后与淋巴结有无转移关系密切,Biffi等[8]认为淋巴结阴性的胃癌其临床病理学特性与早期胃癌相似,手术后预后较好,而有淋巴结转移的胃癌预后则较差。Kodera等[9]报道分化型胃癌淋巴结转移率为6.9%,而未分化型则为13.0%,两者相比差异有统计学意义。Tajima等[10]认为不管是黏膜癌还是黏膜下癌,低分化型肿瘤淋巴结的转移率要明显高于高分化类型肿瘤。本组资料中淋巴结转移率分化型为8.7%,低分化型为20.3%,而未分化型则为35.8%,术后复发率及生存率均有显著性差异(P<0.05)。多因素分析结果提示组织学分型(P=0.043,危险度=3.097)是术后独立危险因素。
肿瘤的TNM分期包含了肿瘤的浸润深度和淋巴结转移程度,TNM分期越晚则患者的预后越差[11],我们认为TNM分期可以从总体上反映肿瘤的生物学行为特性。多因素分析提示TNM分期是影响患者预后的独立因素(P=0.002,相对危险度=9.086),也是决定手术切除范围的主要依据。本组ⅠB、ⅡA、ⅡB和ⅢA期术后5年生存率分别为46.3%、40.8%、33.8%和18.9%,可以看出胃癌的早期诊治至关重要且直接决定患者预后,因此加强宣教对于胃癌患者整体生存率的提高具有重大意义。
手术切缘有无肿瘤侵犯决定术后局部复发率,本资料多因素分析显示切缘情况为患者预后独立危险因素(P=0.035,相对危险度=4.011)。我们体会是癌灶可能浸润至十二指肠或食管,若切缘不够,必要时可切除部分十二指肠或开胸切除部分食管。Roviello等[12]报道扩大根治并发症增多,而生存率并无提高。本组病例多为D2根治术,少数为D3扩大术,术后复发率及生存率无显著性差异(P>0.05)。因此,对进展期胃癌施行D2根治术,不仅可达到清扫淋巴结的目的,又避免了手术范围过大,能减少并发症、降低复发、减缓死亡风险[11]。
单纯外科手术无法达到生物学意义上的根治,术后复发转移的概率仍然较高,本组术后5年局部复发占29.1%,腹膜复发占52.6%,血源性复发占18.3%。因此,以手术为主的综合性治疗尤为重要。MAGIC试验[13]和 FFCD9703 试验[14]均已证实围手术期化疗可提高进展期胃癌患者的生存率。Macdonald等[15]研究了603例切缘阴性患者术后联合放化疗,结果显示中位生存期明显延长,3年无复发生存率和总生存率显著提高。本资料541例术后做过化疗,其中67例做过放疗,与未化疗者相比,中位复发时间延长(33 vs 21个月)、术后5年复发率降低(81.5%vs 96.3%)、生存率提高(42.5%vs 13.7%),单因素分析结果表明辅助性化疗可使术后生存率明显提高(P=0.024)。
综上分析,由于胃癌临床分期、肿瘤生物学行为不同,患者全身状态不一,术后复发转移及生存时间是因人而异、因病而异。因此,建立早期筛查模式尤为必要[16]。对于可切除的进展期胃癌联合D2根治术及综合辅助性放化疗可进一步提高外科治疗效果。
[1]季加孚.胃癌外科治疗研究现状与发展趋势[J].医学研究杂志,2008,37(1):4-6.
[2]吴亮亮,梁寒,王晓娜,等.胃癌根治术后早期复发转移的相关因素分析[J].中华外科杂志,2010,48(20):1542-1545.
[3]YOO C H,NOH S H,SHIN D W,et al.Recurrence following curative resection for gastric caroinoma[J].Br J Surg,2000,87(2):236-242.
[4]黄昌明,王家镔,卢辉山,等.联合脾切除治疗进展期胃上部癌的预后分析[J].中华外科杂志,2009,47(19):1483-1486.
[5]LIPHAM J C,DEMEESTER T R.Preoperative diagnosis of lymph node metastasis:a dream?[J].Gastric Cancer,2006,9(2):70-71.
[6]王昭,詹文华,何裕隆,等.胃癌患者肝转移和腹膜扩散的相关因素及其预后分析[J].中华胃肠外科杂志,2006,9(4):287-290.
[7] JOVANOVIC I,ALEMPIJEVIC T,MILOSAVLJEVIC T,et al.Clinicopathological characteristics of Barrett's carcinoma,cardia carcinoma type II and distal gastric carcinoma:influence of observed parameters on the five-year postoperative survival of patients[J].Srp Arh Celok Lek,2009,137(5-6):249-254.
[8]BIFFI R,BOTTERI E,CENCIARELLI S,et al.Impact on survival of the number of lymph nodes removed in patients with node-negative gastric cancer submitted to extended lymph node dissection[J].Eur J Surg Oncol,2011,37(4):305-311.
[9] KODERA Y,YAMAMURA Y,KANEMITSU Y,et al.Lymph node metastasis in cancer of the middle-third stomach:criteria for treatment with a pylorus-preserving gastrectomy[J].Surg Today,2001,31(3):196-203.
[10]TAJIMA Y,MURAKAMI M,YAMAZAKI K,et al.Risk factors for lymph node metastasis from gastric cancers with submucosal invasion[J].Ann Surg Oncol,2010,17(6):1597-604.
[11]METHASATE A,TRAKARNSANGA A,AKARAVIPUTH T,et al.Lymph node metastasis in gastric cancer:result of D2 dissection[J].J Med Assoc Thai,2010,93(3):310-317.
[12]ROVIELLO F,PEDRAZZANI C,MARRELLI D,et al.Super-extended(D3)lymphadenectomy in advanced gastric cancer[J].Eur J Surg Oncol,2010,36(5):439-446.
[13]CUNNINGHAM D,ALLUM W H,STENNING S P,et al.perioperative chemotherapy versus surgery alone for respectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11-20.
[14]BOIGE V,PIGNON J,SAINT-AUBERT B,et al.Final results of a randomized trial comparing preoperative 5-fluorouracii(F)/cisplatin(P)to surgery alone in adenocarcinoma of stomach and lower esophagus(ASLE):FNLCC ACCORD 07-ffcd 9703 trial[J].ASCO Annual Meeting Proceeding,PartⅠ ofⅡ 2007.Alexandria:American Society of Clinical Oncology,2007,18(6):11-23.
[15] MACDONALD J S,BENEDETTI J,SMALLEY S,et al.Chemoradiation of resected gastric cancer:a 10-year followup of the phaseⅢ trial INT0116(SWOG 9008)[J].ASCO MeetingAbstracts,2009,27(5):4515.
[16]徐海峰,欧希龙.症状性筛查在胃癌诊断工作中的意义分析[J].现代医学,2010,38(3):277-279.
