乳腺癌组织中ADAM8 mRNA 的表达及意义
2011-06-22单海琳李俊生邵清
单海琳,李俊生,邵清
(1.东南大学医学院附属江阴医院普外科,江苏江阴 214400;2.东南大学附属中大医院普外科,江苏南京 210009)
乳腺癌的发病率呈逐年上升趋势,经过血道和淋巴道转移是患者的主要死亡原因,但其分子机制尚未充分阐明。目前普遍认为乳腺癌的预后与病理分期、淋巴结转移、血管生成状况及治疗措施等密切相关。在肿瘤转移研究中,已认识到解整合素-金属蛋白酶(adisintegrin and metalloproteases,ADAMs)[1]在肿瘤浸润和转移中起重要作用,但在乳腺癌领域对解整合素金属蛋白酶8(ADAM8)研究相对较少。本实验采用聚合酶链反应(PCR)及实时荧光定量逆转录聚合酶链反应(QRT-PCR),联合检测乳腺癌组织中ADAM8的表达及其与乳腺癌临床病理参数的关系,探讨其在乳腺癌发生、发展过程中的意义。
1 资料与方法
1.1 一般资料
选择2003年6月至2009年7月东南大学医学院附属江阴医院手术切除、经HE染色及病理组织学证实,并经两位以上有经验的病理医师复查确诊为乳腺癌的标本39例,所有患者临床及病理资料齐全,术前均无放射治疗、化学治疗及免疫治疗史。所有标本在无坏死癌灶内取材。患者均为女性,年龄27~71岁,中位年龄46岁,平均(46.6±5.9)岁。按WHO肿瘤病理学及遗传学分类(2004年)行病理组织学分类及病理分级,病理类型均为浸润性导管癌。按国际抗癌联盟UICC提出的TNM分期(2003年):Ⅰ期10例,Ⅱ期23例,Ⅲ期6例。局部淋巴结转移状况:无转移21例,有转移18例。对照组为同期手术的19例乳腺正常组织标本,取自乳腺良性病变(如纤维腺瘤、乳腺腺病)的手术切缘,经病理确诊无显著病变。患者均为女性,年龄25~68岁,中位年龄43岁,平均(41.4±5.1)岁。两组年龄差异无统计学意义(P>0.05),具有可比性。所有标本均在离体后立即用预冷l‰DEPC洗涤后,置于经1‰DEPC浸泡处理、高温高压灭活的EP管内,-70℃液氮冷冻保存。
1.2 试剂与仪器
Trizol试剂(上海生工生物工程有限公司),UNIQ-10柱式Trizol总RNA抽提试剂盒(上海生工生物工程有限公司),ReverTra Ace qPCR RT Kit试剂盒(TOYOBO),普通PCR 试剂盒(TOYOBO),SYBR Green Realtime PCR Master Mix QPK-201试剂盒(TOYOBO),DNA Marker(TaKaRa),Mastercycler PCR仪(艾本德进口),Mastercycler ep realplex PCR仪 (艾本德进口)和紫外分光光度仪(Beckman)
1.3 引物设计与合成
根据基因库中ADAM8序列,用 Gene Tool软件设计特异引物,上下游引物跨越一个内含子以避免基因组污染影响结果。引物由上海生工生物工程有限公司设计,ADAM8:上游引物5'-GCGCACGGTACCTGCTG CCAGG-3',长 度 22 bp,下 游 引 物 5'-GGGACGGCA CAGCTCACCAGCC-3',长度 22 bp;β-actin:上游引物,长度 24 bp,下游引物5'-TGGGGTGGCTTTTAGGATGGCA-3',长度22 bp。
1.4 模板RNA提取
按照Trizol RNA提取试剂盒说明书的流程抽提标本中的总RNA。
1.5 逆转录(RT)反应
RT反应按照TOYOBO公司的ReverTra Ace qPCR RT试剂盒说明书进行操作。取提取的总RNA样品,每个样品取出7 μl进行逆转录实验。把 RNA在65℃条件下温浴5 min后,立即放于冰上冷却。按反应体系加入 5 × RT buffer 2 μl,RT Enzyme Mix 0.5 μl,Primer Mix 0.5 μl置PCR仪中。反应条件为37℃15 min,98℃ 5 min,4℃ 保温。所得产物置-20℃保存备用。
1.6 PCR 反应
PCR 扩增体系 25 μl:DEPC 水 17.5 μl,10 × Taq buffer 2.5 μl,MgCl22.0 μl,10 mol·L-1dNTP Mix 0.5 μl,上游引物 0.5 μl,下游引物 0.5 μl,Taq 酶(5 U·μl-1)0.5 μl,总 CDNA 1.0 μl。反应条件:预变性94 ℃ 3 min;94 ℃ 30 s,67.5 ℃ 30 s,72 ℃30 s,31个循环;72℃延伸10 min,4℃保温。
1.7 电泳
PCR产物经1%琼脂糖凝胶电泳,根据电泳条带的数量和分子质量大小判断产物的特异性。取9 μl产物与1 μl上样缓冲液混匀后上样于1%琼脂糖凝胶,110 V恒压电泳20 min,UVP成像系统观察。
1.8 QRT-PCR
采用SYBR Green I荧光染料QRT-PCR检测方法。每份标本设3个平行对照反应孔,以β-actin作为参照,ADAM8作为目的基因,与相应标准品一起扩增。ADAM8 mRNA的测定阳性定量标准品及待测样品均按以下反应体系和反应条件进行扩增。PCR扩增体系 50 μl:蒸馏水 16 μl,SYBR®Green Realtime PCR Master Mix 25 μl,上游引物 (10 μmol·L-1)2 μl,下游引物(10 μmol·L-1)2 μl,样品溶液 5 μl。循环条件(三步法):95 ℃ 20 s,95 ℃ 15 s,67.5 ℃ 20 s,72 ℃20 s,共40个循环。得到标本中ADAM8与β-actin的循环阈值(Ct),通过溶解曲线确定PCR产物的特异性。
1.9 标准曲线的制备
将1份ADAM8与β-actin cDNA标准品分别用灭菌双蒸水稀释至 10-1、10-2、10-3、10-4倍,与待测样品在同样反应体系和反应条件进行扩增。反应结束后,电脑自动分析荧光信号并将其转换为起始拷贝数及Ct值,由定量分析软件分别制作目的基因和内参照的标准曲线。
1.10 结果判定标准
采用QRT-PCR方法检测,以β-actin作为内参照,ADAM8作为目的基因。ADAM8mRNA减去β-actin的Ct值得到△Ct值,以正常乳腺组织△Ct值的平均数作为矫正数,计算 2-△△Ct值,以 2-△△Ct值为 RNA 表达量[2]。
1.11 统计学处理
采用SPSS 11.5统计软件,各组间的比较采用非参数统计中Mann-Whitney检验,P<0.05为差异有统计学意义。
2 结 果
2.1 方法的可靠性及准确性
2.1.1 ADAM8 cDNA扩增产物电泳 PCR产物行1%琼脂糖凝胶电泳,可观察到乳腺癌组织和良性乳腺组织中ADAM8 60 bp特异性扩增条带,条带清晰可见,无引物二聚体,无明显降解(图1)。

图1ADAM8cDNA扩增产物电泳Fig 1 ADAM8cDNA amplification products electrophoresis
2.1.2 扩增的特异性及定量的准确性 标准品cDNA经梯度稀释后进行PCR反应,制作标准曲线(图2)。得到的Ct值与起始模板浓度对数呈线性关系,证实了用Ct值进行定量的准确性。ADAM8线性方程为y=-3.267x+14.83,r2=0.998 9,扩增效率 1.023。β-actin线性方程为 y= -3.416x+15.605,r2=0.998 6,扩增效率1.079。r2均>0.998,扩增效率近似,反映定量准确,扩增效率良好。β-actin 4个浓度梯度的扩增曲线间距相等,表示梯度浓度稀释准确(图3、4)。扩增后进入溶解程序生成溶解曲线,溶解曲线显示锐利的单一锋,无其他非特异性锋,说明扩增产物均一,无非特异扩增及引物二聚体(图5、6)。

图2 ADAM8与β-actin标准曲线图Fig 2 Standard curve of ADAM8 and β-actin
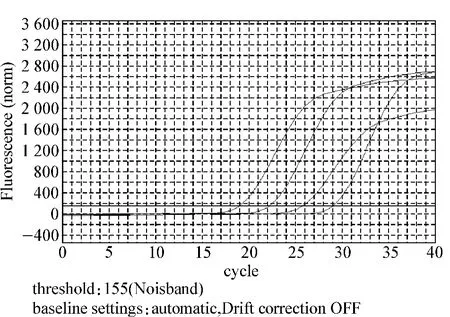
图3 β-actin扩增曲线Fig 3 Amplification curve of β-actin

图4ADAM8 mRNA的扩增曲线Fig 4 Amplification curve of ADAM8 mRNA in breast tissue

图5 β-actin溶解曲线图Fig 5 Melting curve of β-actin
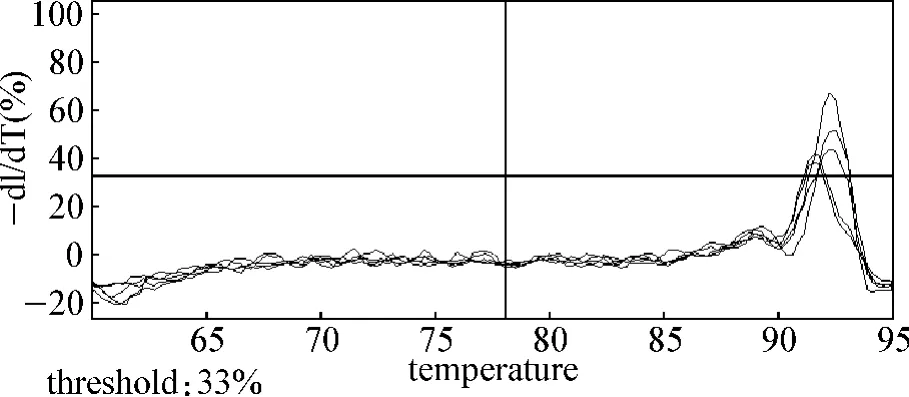
图6 ADAM8溶解曲线Fig 6 Melting curve of ADAM8 mRNA in breast tissue
2.2 ADAM8 mRNA在乳腺癌与良性乳腺组织中的表达
ADAM8 mRNA在乳腺癌和正常乳腺组织中均有表达,但ADAM8 mRNA在乳腺癌组织中的表达水平低于正常乳腺组织(P=0.015);而淋巴结转移组表达水平低于无转移组,Ⅰ+Ⅱa期表达水平低于Ⅱb+Ⅲ期,但表达差异均无统计学意义(P>0.05)。见表1。

表1 ADAM8 mRNA在乳腺癌及正常乳腺组织中的表达水平Tab 1 The expression of ADAM8 mRNA in breast cancer and normal breast tissues
3 讨 论
ADAMs为锚定于细胞膜的细胞表面蛋白质家族,是近年来发现的具有金属蛋白酶和整合素两种结构域的物质,迄今文献报道已有30多种[3],它们在调节细胞外基质(ECM)的重塑和细胞迁移中起着重要的作用[4],并参与表皮生长因子受体(EGFR)配体胞外功能区的脱落。
越来越多的研究表明ADAMs在乳腺癌发生和演化中起重要作用 目前研究发现28表达与乳腺癌相关。Rocks等[5]发现ADAM9的表达水平与他莫西芬治疗乳腺癌的效果相关,可以作为乳腺癌的治疗新靶点。国内有学者研究发现ADAM9还与结肠癌的疾病进展有关,并与肿瘤血管形成有相关性[6]。Kuefer等[7]在组织微阵列实验中发现 ADAM15蛋白在多种腺癌中表达增高,特别与乳腺癌的转移高度相关,其表达水平随乳腺癌的分级分期增高而增加。McGowan等[8]发现 ADAMl7 mRNA及蛋白水平在乳腺癌组织中表达量与淋巴结转移的数目呈正相关,其过表达可增加细胞侵袭和增殖,而靶向作用于ADAMl7,阻止转化生长因子-α(TGF-α)和双调蛋白的脱落,可恢复乳腺癌细胞的恶性表型。另外,体内外试验显示ADAM28选择性表达于人乳腺癌细胞,并且可通过增强IGF-l的生物利用度促进乳腺癌细胞增殖[9]。上述研究结果表明,多种ADAMs基因家族参与乳腺癌的发生、发展、凋亡及侵袭等多个过程。
据报道ADAM8在多种实体瘤组织中存在过度表达,常与肿瘤的转移有关[10],但ADAM8在乳腺癌中的表达国内外相关的文献报道并不多。本研究用SYBR GreenⅠ染料法初步检测36例乳腺癌及19例正常乳腺组织中ADAM8表达水平,结果提示乳腺癌组织及正常乳腺组织中均可检测到ADAM8 mRNA表达,但其在乳腺癌组织中表达下调,表达差异有统计学意义,此前尚未见到同类研究报道。我们进一步的研究发现,有淋巴结转移组的乳腺癌组织ADM8 mRNA表达水平低于无淋巴结转移组,随着肿瘤浸润的加深,ADM8 mRNA表达水平下降,但差异无统计学意义,可能与样本量较小有关,但亦暗示ADAM8在进展及转移乳腺癌中的表达存在一致性的下调,本研究首次表明ADM8 mRNA表达下调可能与乳腺癌的侵袭及转移有关。这与Alexe等[11]在乳腺癌亚型微阵列分层研究的结果一致,Alexe等发现从原位癌到浸润性乳腺癌进展的各个阶段,不同级别及亚型中肿瘤基因表达存在异质性,在浸润性及转移性乳腺癌组织中ADAM8表达下调,而 MMP11,ADAM12表达上调。另外Guaiquil等[12]采用氧诱导视网膜病变(OIR)模型和肿瘤细胞异体植入研究ADAM8对小鼠病理性血管再生的作用,发现在OIR模型中,乏ADAM8小鼠与野生型比较,视网膜病理性再生血管丛减少,异体植入肿瘤细胞增生较快。研究结果表明,抑制ADAM8的表达可用于促进有益血管再生,从而防止增殖性视网膜病变形成。现有研究提示ADAM8在不同肿瘤中的表达可能不同,如Ishikawa等[13]研究表明,ADAM8在肺癌中存在表达,免疫组化结果显示人ⅢB/Ⅳ期肺癌较Ⅰ~ⅢA期表达明显增高,通过基质胶侵袭分析提示转染了ADAM8 cDNA的肺癌细胞株NII-13T3和COS-7侵袭活性明显强于转染模拟噬菌体的细胞株,提示ADAM8的蛋白水解酶的活性有利于肿瘤细胞的侵袭和转移。吴国成等[14]在肺癌研究的报道类似,ADAM8在非小细胞肺癌的表达与淋巴结转移和TNM分期存在相关性,分期越高,淋巴结转移越明显,其表达越强。Wildeboer等[10]采用 RT-PCR 分析发现,ADAM8在原发性脑肿瘤中其mRNA表达明显增高,ADAM8表达水平和蛋白水解酶的活性与恶性胶质瘤细胞侵入活性的相关性,提示ADAM8在上述肿瘤转移上发挥重要作用。Valkovskaya等[15]用定量RT-PCR研究发现,胰腺导管腺癌中ADAM8 mRNA相对于正常胰腺组织表达明显增高,且高水平mRNA和高蛋白表达与存活时间呈负相关。沉默ADAM8基因表达能抑制其侵袭性,且细胞培养液上清的肿瘤细胞蛋白水解酶活性明显下降。本研究结果首次表明,ADAM8的表达缺失或者下调可能在乳腺癌的发生发展中起作用,提示ADAM8在不同肿瘤中的作用具有个体性,可能与ADAMs特别的剪切膜表面蛋白功能有关,它在细胞因子和生长因子作用过程中调节影响乳腺癌的发生、发展、侵袭、转移。ADAM8过表达促进在血管再生中发挥作用的几种膜蛋白胞外功能区的脱落(CD31的,Tie-2,Flk-1 和 Flt-1,EphrinB2,EphB4,VE-钙粘蛋白,KL-1,E-选择素和调节素-1beta2)[12]。因此,体内血管内皮细胞ADAM8表达失调可能潜在增加这些底物蛋白加工。但ADAMs家族在多个领域发挥重要作用,如细胞融合、细胞凋亡、迁移以及受精等过程,其具体机制是复杂的,而乳腺癌的侵袭和转移是一个多因素参与的复杂过程,因此ADAM8表达抑制对乳腺癌疾病进展的作用及其机制尚有待于更深入的研究。我们认为,进一步扩大样本,以及追踪患者病情的演变和预后,揭示ADAM8的表达水平与乳腺癌临床分期的确切关系,并进行功能实验研究,对于阐明该基因与乳腺癌发病的关系,以及对乳腺癌的诊断、预后判断和治疗可提供新的思路。
[1]WOLFSBERG T G,WHITE J M.ADAMs in fertilization and development[J].Developmental Biology,1996,180(2):389-401.
[2]KENNETH J L,THOMAS D S.Analysis of relative gene expression datausing real-timequantitativePCR and the 2-△△t[J].Methods,2001,25:402-408.
[3]MOCHIZUKI S,OKADA Y.ADAMs in cancer cell proliferation and progression[J].Cancer Sci,2007,98(5):621-628.
[4]SEALS D F,COURTNEIDGE S A.The ADAMs family of metalloproteases;multidomain proteins with multiple functions[J].Genes Dev,2003,17(1):7-30.
[5]ROCKS N,PAULISSEN G,QUESADA C F,et al.Expression of a disintegrin and metalloprotease(ADAM and ADAMTS)enzymes in human nonsmallcell lung carcinomas(NSCLC)[J].Br J Cancer,2006,94(5):724-730.
[6]施文,李俊生.结肠癌组织中ADAM9的表达及其与微血管密度的关系[J].东南大学学报:医学版,2009,28(4):274-278.
[7]KUEFER R ,DAY K C,KLEER C G,et al.ADAM15 disintegrin is associated with aggressive prostate and breast cancer disease[J].Neoplasia,2006,8(4):319-329.
[8]McGOWAN P M,RYAN B M,HILL A D,et al.ADAM-17 expression in breast cancer correlates with variables of tumor progression[J].Clin Cancer Res,2007,13(8):2335-2343.
[9]MITSUI Y,MOCHIZUKI S,KODAMA T,et al.ADAM28 is overexpressed in human breast carcinomas:implications for carcinoma cell proliferation through cleavage of insulin-like growth factor binding protein-3[J].Cancer Res,2006,66(20):9913-9920.
[10]WILDEBOER D,NAUS S,AMY-SANG Q X,et al.Metalloproteinase disintegrins ADAM8 and ADAM19 are highly regulated in human primary brain tumors and their expression levels and activities are associated with invasiveness[J].J Neuropathol Exp Neurol,2006,65(5):516-527.
[11]ALEXE G,DALGIN G S,SCANFELD D,et al.Breast cancer stratification from analysis of micro-array data of micro-disssected specimens[J].Genome Inform,2007,18:130-140.
[12]GUAIQUIL V H,SWENDEMAN S,ZHOU W,et al.ADAM8 is a negative regulator of retinal neovascularization and of the-ADAM8 growth of heterotopically injected tumor cells in mice[J].Mol Med,2010,88(5):497-505.
[13]ISHIKAWA N,DAIGO Y,YASUI W,et al.ADAM8 as a novel serological and histochemical marker for lung cancer[J].Clin Cancer Res,2004,10(24):8363-8370.
[14]吴国成,胡华成,施敏骅.ADAM8、EGFR在非小细胞肺癌中的表达及其相关性[J].癌症,2008,27(8):874-878.
[15]VALKOVSKAYA N,KAYED H,FELIX K,et al.ADAM8 expression is associated with increased invasiveness and reduced patient survival in pancreatic cancer[J].J Cell Mol Med,2007,11(5):1162-1174.
