丙泊酚联合地塞米松对早期脓毒症大鼠炎症因子的影响
2011-06-21雷贤英甘辞海孙双春周淑敏
雷贤英,甘辞海*,钟 庆,王 丽,孙双春,周淑敏,缑 剑
(1.泸州医学院附属医院ICU,四川 泸州 646000;2.简阳市人民医院,四川 简阳 641400;3.泸州医学院中心实验室,四川 泸州 646000)
脓毒症是由感染导致宿主过度炎症反应的一组临床表现和症状,是ICU危重患者首要的死亡原因之一。脓毒症时炎症介质大量触发级联式反应,持续激活网状内皮系统,最后导致机体各重要脏器损伤。本实验以丙泊酚联合地塞米松进行干预,研究其对早期脓毒症大鼠炎症因子的影响,以探索脓毒症治疗的新途径。
1 资料与方法
1.1 药物和主要试剂 脂多糖(LPS,购于Sigma公司,血清型O111和B4,均用5%葡萄糖溶液配制),丙泊酚(四川国瑞药业有限责任公司,20 ml:0.2 g,批号H20030115);地塞米松注射液(天津药业焦作有限公司,1 ml:5 mg,批号H41020036);肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和白细胞介素-10(IL-10)试剂盒(上海西唐生物有限公司)。
1.2 方法
1.2.1 实验动物及分组 健康雄性SD大鼠25只,无特定病原体级(SPF),体重200~250 g,购自泸州医学院动物实验中心。随机分为5组:正常对照组(N组)、LPS组(L组)、LPS+丙泊酚组(LP组)、LPS+地塞米松组(LD组)、LPS+丙泊酚+地塞米松组(LPD组),每组5只。
1.2.2 动物模型建立及用药 采用清醒经大鼠尾静脉穿刺置留置针的方法行尾静脉保留置管,肝素水封管后丝线固定以备给药。以大鼠尾静脉注射脂多糖法复制脓毒症大鼠模型,按照以下分组要求注射药物后处死大鼠:N组:注射0.9%生理盐水(NS)10 ml;L组:注射LPS 10 mg/kg(10 min以上注射完);LP组:注射LPS 10 mg/kg(10 min以上注射完)和丙泊酚5 mg/kg,继以丙泊酚5 mg·kg-1·h-1的速度使用微泵持续静脉泵注至1 h;LD组:注射LPS 10 mg/kg及地塞米松0.1 mg/kg;LPD组:注射LPS 10 mg/kg,地塞米松0.1 mg/kg和丙泊酚5 mg/kg,继以丙泊酚5 mg·kg-1·h-1的速度使用微泵持续静脉泵注至1 h。各组均于1 h后处死。
1.2.3 血清TNF-α、IL-1β、IL-6和IL-10检测 经腹主动脉取血,静置30 min后,离心取血清,-70℃保存待测,严格按照试剂盒的说明书进行实验步骤,监测TNF-α、IL-1β、IL-6和IL-10的浓度。
2 结 果
L组TNF-α、IL-1β和IL-6较对照组明显升高,IL-10则明显降低(P均<0.05);LD组、LP组、LDP组同L组比较,其结果显示TNF-α、IL-1β和IL-6均明显降低,IL-10 明显升高(P<0.05;P<0.05;P<0.05);LDP组同LP组、LD组比较,LDP组TNF-α、IL-1β和IL-6表达量明显下降,IL-10明显升高(P<0.05),见表1。
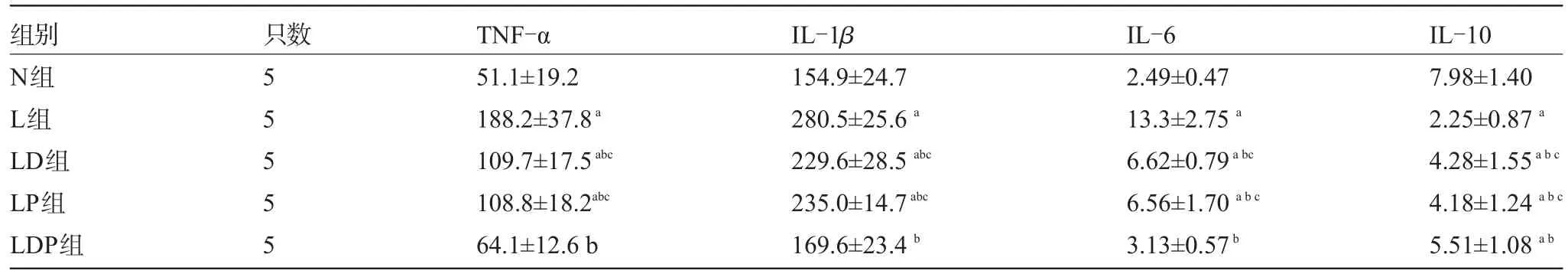
表1 五组大鼠血清TNF-α、IL-1β、IL-6、IL-10浓度的比较(pg/mL)
3 讨论
脓毒症时细胞因子的释放呈级联效应,或“瀑布效应”,组成非常复杂的调节网络,释放出大量炎症因子[1],其中促炎症细胞因子主要有TNF-a、IL-1β、IL-6、IL-8等,此外还有下调炎症反应的抗炎症细胞因子如IL-10等[2]。促炎和抗炎细胞因子二者相互制约,影响脓毒症时全身炎症反应综合征(SIRS)的发展。
当机体受到应激原刺激后,TNF-α和IL-1β是最早释放的炎症介质,这些细胞因子启动并释放了其他的细胞因子。其中TNF-α是机体应激反应产生最早的和最起核心作用的炎症介质,其具有早期迅速合成释放的特点[3]。TNF-α因为是SIRS发生时的前炎症介质,故TNF-α的含量改变可反映其他炎症因子的改变情况。本实验中丙泊酚和地塞米松联合用药能抑制TNF-α的释放,减少组织的炎症损伤,保护机体器官功能。血清中IL-6是一种迟发性细胞因子,可以作为细胞因子级联反应激活的一个标志,反映出宿主炎症反应与疾病严重程度间的关系,并且在脓毒血症中可以作为判断预后的一个指标[4]。IL-10是内源性抗炎介质,可由促炎性细胞因子(TNF-α、IL-6、IL-8)和内毒素诱导产生,能抑制免疫应答,抑制巨噬细胞抗原呈递,抑制多种基因转录,从而抑制多种炎性细胞的分泌功能以及炎症因子的生成,对LPS诱导的促炎性介质释放有明显抑制作用[5]。实验结果显示,脂多糖组IL-10明显降低,而地塞米松和丙泊酚组IL-10水平均显著升高,二者联合用药组更明显,推测其机制可能是通过影响细胞内传导通路影响IL-10的合成和分泌。
丙泊酚目前已经广泛应用于ICU脓毒症、严重创伤等危重病人的镇静治疗。国内外学者已经研究证实丙泊酚具有抗炎抗氧化作用[6-8]。Aniguchi等[6]发现丙泊酚可明显抑制内毒素所致的促炎性细胞因子IL-6、TNF产生,并能减轻中性粒细胞浸润,减轻酸血症,防止动物血压进一步下降。糖皮质激素(Glucocorticoid,GC)是由肾上腺皮质分泌的一种重要的类固醇激素,在细胞生长、发育、分化及自身稳态的调节和细胞存活能力等多方面起重要作用。有短期试验观察到,感染性休克患者小剂量地塞米松的应用会产生积极效应[9]。异丙酚与地塞米松联用于脓毒症的相关研究报道很少,仅在Tsao等[10]的一项研究中,对脓毒症所致休克、酸中毒以及多器官功能衰竭(MOSF)的发生率方面做了统计分析和大体观察,其实验结论证实丙泊酚联合地塞米松用于脓毒症时降低MOSF发生率,降低LPS大鼠死亡率,而且两者联用比单用一种药具有协同效应。本实验结果表明,丙泊酚联合地塞米松对早期脓毒症大鼠促炎症细胞因子TNF-a、IL-1β、IL-6的表达具有明显的下调作用,对抗炎因子IL-10的表达却有上调作用,且二者联合用药较单用药具有明显的协同作用。同时,本课题还研究了联合用药对处于炎症级联反应上游的TLR4/MD-2基因表达的影响,实验结果亦证实联合用药会下调TLR4/MD-2基因表达,这可能是丙泊酚联合地塞米松对早期脓毒症大鼠促炎症细胞因子TNF-a、IL-1β、IL-6的表达具有明显的下调作用,对抗炎因子IL-10的表达有上调作用的机理所致。
因此,对脓毒症患者除了传统的积极抗感染、纠正休克等治疗外,可考虑丙泊酚地塞米松的联合应用,在适度镇静的同时减轻炎症反应,从而有利于改善脓毒症患者的预后。
[1]Shimaoka M,Park EJ.Advances in understanding sepsis[J].Eue J Anaesthesiol,2008,25(42):146-153.
[2]丁 宁,姜 勇.巨噬细胞LPS相关模式识别受体的研究进展[J].中国病理生理杂志,2008,24(8):1650-1655.
[3]盛志勇,姚咏明.加强对脓毒症免疫功能障碍及其监测的研究[J].解放军医学杂志,2011,36(1):8-10.
[4]Remick DG,Bolgos G,Copeland S,et al.Role of interleukin-6 in mortality from and physiologic response to sepsis[J].Infect Immun,2005,73(5):2751-2757.
[5]太光平.白介素-10对感染性休克保护作用研究进展[J].国外医学:创伤与外科基本问题分册,2000,20:12-15.
[6]Aniguchi T,Yamamoto K,Ohmoto N,et a1.Effects of propofol on hemodynamic and inflammatory response to endotoxemia in rats[J].Ctit Care Med,2000,28:1101-1106.
[7]Aniguchi T,Kanakura H,Yamamoto K.Effects of posttreatment with propofol on mortality and cytokine responses to endotoxin-induced shock in rats[J].Crit Care Med,2002,30:904-907.
[8]罗 艳,于布为.异丙酚对系统性炎症反应综合征大鼠免疫因子的影响[J].中华麻醉学杂志,2002,22:615-618.
[9]Annane D,Sébille V,Charpentier C,et al.Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock[J].JAMA,2002,288:862-871.
[10]Tsao CM,Ho ST,Liaw WJ,et al.Combined effects of propofol and dexamethasone on rats with endotoxemia[J].Crit Care Med,2008,36(3):887-894.
