hTERT siRNA对宫颈癌Hela细胞增殖及化疗敏感性的影响
2011-06-14牛高丽温玉库
牛高丽,温玉库
(辽宁医学院附属第一医院,辽宁锦州121000)
宫颈癌是常见的妇科恶性肿瘤之一,全世界每年有250 000例妇女死于宫颈癌[1]。2010年12月~2011年6月,我们观察了靶向人端粒酶反转录酶(hTERT)siRNA对宫颈癌Hela细胞增殖及化疗敏感性的影响,旨在为宫颈癌的基因治疗提供依据。
1 材料与方法
1.1 材料 Hela细胞,RPMI1640培养基,胎牛血清,EntransterTM-R转染试剂盒,Trizol Reagent,cDNA合成及RT-PCR试剂盒,兔抗人hTERT单克隆抗体,兔抗人 β-actin单克隆抗体,HRP标记羊抗兔IgG 抗体,3-(4,5-二甲基-2 噻唑)-2,5-二苯基溴化四唑(MTT),胰蛋白酶,青/链霉素,顺铂,博来霉素,DMSO;hTERT化学合成siRNA序列参照文献设计,经广州锐博生物技术公司合成。正义链:5'-GGCACTGTTCAGCGTGCTCTT-3';反义链:3'-GAGCACGCTGAACAGTGCC-5';Control siRNA序列:正义链:5'-CCGTCGACGCGTACTTGGTTT-3';反义链:3'-CGGTCCAGAGCATCAACGG-5'[2]。
1.2 实验方法
1.2.1 细胞培养及转染 Hela细胞贴壁生长于含10%胎牛血清,1%青/链霉素的RPMI1640培养液中,于37℃、5%CO2培养箱中培养。取对数生长期细胞按1×106/孔接种于6孔培养板,待贴壁率达60%左右时将细胞分为 hTERT siRNA组、Control siRNA组、空载体组及空白细胞组,以新型纳米载体EntransterTM-R作为转染试剂,按试剂说明将hTERT siRNA、Control siRNA及空载体分别转染Hela细胞,转染siRNA终浓度为50 nmol/L。培养4~6 h后更换RPMI1640完全培养基,分别于24、48 h后收集细胞,每组设3个复孔。
1.2.2 hTERT mRNA表达检测 采用 real time-PCR法。于转染24 h后收集各组细胞提取总RNA,反转录合成cDNA,设计hTERT引物:5'-CATCGCCAGCATCATCAAACCC-3',5'-AGGTCTGTCAAGGTAGAGACGTG-3'。内参照基因 3磷酸甘油醛(GAPDH)引物:5'-ACCACAGTCCATGCCATCAC-3',5'-TCCACCACCCTGTTGCTGTA-3'。由上海生工生物技术服务公司合成。使用SYBRGreen作为荧光染料,FITC2000实时荧光定量基因扩增仪进行检测,扩增条件:94 ℃ 3 min,94 ℃ 10 s,58 ℃ 30 s,72℃30 s,30个循环。参照文献报道取 Ct(cycle thresh-old)值[3]。计算△Ct=Ct(目的基因)- Ct(GAPDH),再将各实验组样本的△Ct减去正常对照的△Ct,即得△△Ct。结果以 2-△△Ct表示。
1.2.3 hTERT蛋白表达检测 采用 Western blot法。稳定转染48 h后收集各组细胞消化离心,以蛋白裂解液提取细胞总蛋白,冰上裂解3 h,取变性蛋白样品20 μg进行SDS-PAGE蛋白电泳,通过电转仪将蛋白转移至硝酸纤维素膜。用含5%脱脂奶粉的TBST缓冲液封闭1 h。按1∶2 000比例加入兔抗hTERT单克隆抗体(一抗)置于脱色摇床上孵育2 h,TBST液洗3次,各10 min。HRP标记羊抗兔IgG抗体(二抗)1∶5 000置于脱色摇床上孵育1 h,TBST液洗3次,各10 min,加显色剂,入暗室曝光、显影,图像扫描并以Image J软件进行灰度分析得出灰度值。以β-actin蛋白作为内参照。
1.2.4 细胞增殖活性测定 采用MTT法。取各组细胞以1×104个/孔接种于96孔板,每组设4个复孔,培养24、48、72 和96 h 时孔内各加入 10 μl MTT溶液(5 mg/ml,即0.5%MTT),培养4 h 后去除培养液,加入 DMSO 150 μl/孔,振荡 10 min,充分溶解结晶。于酶联免疫检测仪490 nm波长下测定各孔光吸收(A)值,以此表示细胞增殖活性。
1.2.5 化疗敏感性试验 各组稳定转染的细胞培养24 h后,分别用不同质量浓度顺铂、博来霉素处理,顺铂(1 mg/ml)至终质量浓度为 0.02、0.1、0.5、2.5、12.5 μg/ml,博来霉素(1 mg/ml)至终质量浓度为 0.01、0.1、1、10、100 μg/ml,以空白细胞作为对照,每组设4个复孔,继续培养48 h。每孔加入10 μl MTT溶液,37 ℃ 孵育 4 h,弃上清,加入 150 μl DMSO,振荡10 min,充分溶解结晶,选择490 nm波长,测定光吸收值(A490),以此计算细胞存活率=实验组A值/对照组A值×100%。用IC50计算软件得出细胞的半数生长抑制浓度(IC50)。
1.3 统计学方法 采用SPSS16.0统计软件,计量资料以±s表示,组间比较采用方差分析,率的比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 hTERT mRNA、hTERT蛋白表达 见表1。由表1可见,hTERT siRNA作用Hela细胞24、48 h后,hTERT mRNA及蛋白表达均明显降低,和空白细胞组相比差异有统计学意义(P<0.05)。而Control siRNA组、空载体组与空白细胞组相比差异无统计学意义(P >0.05)。
表1 各组hTERT mRNA、hTERT蛋白表达(±s)

表1 各组hTERT mRNA、hTERT蛋白表达(±s)
注:与空白细胞组比较,*P<0.05
组别 hTERT mRNA(2-△△Ct)hTERT 蛋白(灰度值)hTERT siRNA 组 0.47 ±0.02* 1.36 ±0.27*Control siRNA 组 0.98 ±0.09 2.86 ±0.09空载体组 0.94 ±0.11 2.61 ±0.18空白细胞组1.00 2.79 ±0.16
2.2 细胞增殖活性 Control siRNA组、空载体组及空白细胞组增殖速度相近,差异无统计学意义(P>0.05),而hTERT siRNA组细胞增殖速度明显减慢,随时间增加而增加,表明靶向hTERT的siRNA使细胞生长受到抑制,见表2。
表2 各组细胞增殖活性(±s)
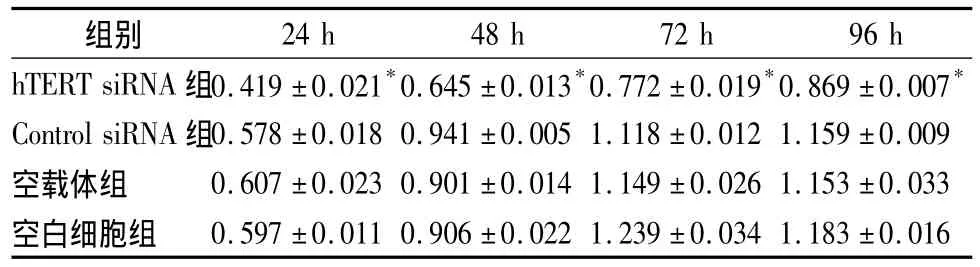
表2 各组细胞增殖活性(±s)
注:与空白细胞组比较,*P<0.05
组别24 h 48 h 72 h 96 h hTERT siRNA 组0.419 ±0.021*0.645 ±0.013*0.772 ±0.019*0.869 ±0.007*Control siRNA 组0.578 ±0.018 0.941 ±0.005 1.118 ±0.012 1.159 ±0.009空载体组 0.607 ±0.023 0.901 ±0.014 1.149 ±0.026 1.153 ±0.033空白细胞组 0.597 ±0.011 0.906 ±0.022 1.239 ±0.034 1.183 ±0.016
2.3 抑制hTERT基因对Hela细胞化疗敏感性的影响 顺铂及博来霉素作用后的细胞存活率分别见图1、图2。由图可见,与其他各组比较,同一药物浓度时hTERT siRNA组细胞存活率最低(P<0.05)。hTERT siRNA 组顺铂的 IC50为(2.19 ±0.02)μg/ml(P<0.05),Control siRNA 组、空载体组及空白细胞组IC50均无显著差异(P >0.05),分别为(8.11 ±0.03)、(7.47 ± 0.28)、(7.94 ± 0.12)μg/ml。hTERT siRNA 组博来霉素的 IC50为(7.39 ±0.45)μg/ml,Control siRNA组、空载体组及空白细胞组分别为(99.08 ± 0.56)、(94.27 ± 0.35)、(98.17 ±1.05)μg/ml,hTERT siRNA 组两药的 IC50值均明显低于其他各组,P<0.05;另三组间两药的IC50值比较均无统计学差异。
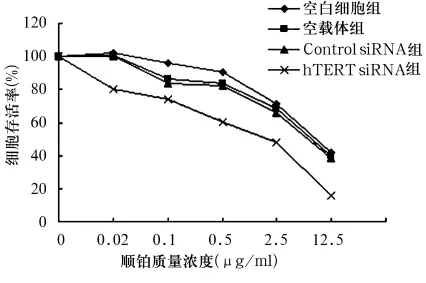
图1 Hela细胞对顺铂的敏感性试验

图2 Hela细胞对博来霉素的敏感性试验
3 讨论
端粒是位于真核生物染色体3'末端的一段富含G的DNA重复序列,对于维持基因的稳定性起重要作用,端粒酶可使端粒保持稳定的长度,而hTERT是端粒酶活性的主要限速因子[4]。以往研究证实,端粒酶的激活在宫颈癌的发生、发展中起重要作用,宫颈上皮内瘤变(CIN)时即可检测到端粒酶的表达,宫颈癌时其表达程度更高;端粒酶激活可能是宫颈癌变中的早期事件[5]。因此,hTERT是一个理想的治疗癌症的靶向目标,抑制hTERT的表达能明显抑制细胞增殖。抑制端粒酶活性的方法较多,包括反义核苷酸技术,核酶及一些小的合成分子[6]。RNA干扰是存在于植物和哺乳动物细胞中一种天然的基因沉默保护机制,siRNA可以特异性靶向mRNA使其降解从而阻止目的蛋白的表达,具有高效、特异、无毒等特点,因此设计靶向hTERT的siRNA能成为治疗肿瘤的一种方法。本研究发现,hTERT siRNA可抑制宫颈癌 Hela细胞中hTERT mRNA及蛋白水平的表达,细胞增殖受到抑制并随时间增加而增加,提示靶向hTERT的siRNA能抑制目的基因表达并抑制细胞生长。
顺铂是宫颈癌最基本的化疗药物之一,其可与DNA形成链内交联,抑制DNA合成,并通过caspases途径促进细胞凋亡[7]。而博来霉素可致DNA链的断裂,属于G2期特异性药物,是新辅助化疗中主要联合用药之一。据报道,化疗治疗宫颈癌的有效率大约为50%,且存在耐药及副作用,对于体积较大、复发的肿瘤总体治疗效率低。本研究发现,各组细胞存活率均随顺铂、博来霉素浓度的增加而降低,hTERT siRNA组细胞增殖活性明显低于其他各组,IC50浓度显著降低,提示hTERT siRNA可增强宫颈癌Hela细胞对化疗药物的敏感性。目前研究显示,细胞中hTERT与DNA修复过程有直接的关联,hTERT的异常表达促进了DNA的修复,可能与增强了与DNA修复相关的几个基因的表达有关,包括Rad51、hMLH1、hMSH6 等[8],抑制 hTERT 表达可能增强了顺铂及博来霉素导致的DNA断裂作用。因此,我们认为将hTERT抑制与化疗药物联合使用可能有更好的效果。
总之,靶向hTERT设计的siRNA可明显抑制宫颈癌Hela细胞中hTERT表达,抑制细胞生长,并增强化疗药物的敏感性,可能为宫颈癌的治疗提供新的方向。
[1]Pisani P,Bray F,Parkin DM.Estimates of the world-wide prevalence of cancer for 25 sites in the adult population[J].Int J Cancer,2002,97(1):72-81.
[2]George J,Banik NL,Ray SK .Combination of hTERT knockdown and IFN-γ treatment inhibited angiogenesis and tumor progression in glioblastoma[J].Clin Cancer Res,2009,15(23):7186-7195.
[3]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[4] Rhyu MS.Telomeres,telomerase,and immortality[J].J Natl Cancer Inst,1995,87(12):884-894.
[5]Nagai N,Oshita T,Muakami J.Semiquantitative analysis of telomerase activity in cervical cancer and precancerous lesions[J].Oncol Rep,1999,6(2):325-328.
[6]Mao YQ,Gan YB,Song SH,et al.Simultaneous targeting of telomeres and telomerase as a cancer therapeutic approach[J].Cancer Res,2003,63(3):579-585.
[7]Siddik ZH.Cisplatin:mode of cytotoxic action and molecular basis of resistance[J].Oncogene,2003,22(47):7265-7279.
[8]Sharma GG,Gupta A,Wang H,et al.hTERT associates with human telomeres and enhances genomic stability and DNA repair[J].Oncogene,2003,22(1):131-146.
