溶血磷脂酸对大鼠小胶质细胞TLR4表达的影响
2011-06-14张兆辉刘美真白寅又
黄 刚 张兆辉 刘美真 朱 扬 白寅又 李 慧
脑出血是常见的急危重症疾病,其致残率和病死率均很高,其中一个很重要的原因是出血后水肿的形成和发展,现已证明脑出血后的炎症反应是脑水肿及继发性功能缺损加重的的主要原因[1]。溶血磷脂酸(lysophosp hatidicacid,LPA)是具有多种生物学作用的磷脂信使,主要由活化的血小板产生。已有研究表明,脑出血后高浓度的LPA促进血脑屏障通透性增加和脑水肿的形成[2]。小胶质细胞起源于胚胎前期骨髓干细胞,生理条件下小胶质细胞处于静息或休眠状态。在脑出血等损伤时小胶质细胞则在神经变性和神经炎性反应过程中起关键作用[3]。Toll样受体 4(Toll-like receptor 4 TLR4)是天然免疫系统识别病原微生物的主要受体,介导细菌内毒素(1ipopolysaccharide,LPS)诱导的炎症反应,可能导致了脑出血后的细胞凋亡过程[4]。目前证实在中枢神经系统TLR4主要在神经元和小胶质细胞表达,而在血管内皮细胞、星形胶质细胞几乎不表达[5]。TLR4信号成为一个激活小胶质细胞和调节其功能的重要控制开关,在脑出血后脑组织炎症反应中具有重要作用[6,7]。LPA是否影响TLR4的表达,如何激活小胶质细胞加重脑水肿的发展呢?本实验采用大鼠海马区注射LPA,免疫组化方法检测注射后TLR4动态表达 ,探讨TLR4信号通路在脑出血继发损伤中激活小胶质细胞的作用机制。
1 材料与方法
1.1 主要仪器与试剂
立体定位仪、微量注射器、光学显微镜及手术器械等,溶血磷脂酸(Sigma公司),EB(Sigma公司),TLR4多克隆抗体(武汉华瑞康公司),SP试剂盒(武汉博士德公司),DAB显色试剂盒(武汉博士德公司)
1.2 实验动物及分组
70只成年、雄性、健康SD大鼠,体重250~300 g,均购自华中科技大学同济医学院实验动物中心,并随机分为对照组、LPA注射后 6、24、48 h组、LPA+苏拉明(L+S)注射后6、24、48 h组,每组各时间点均选10只鼠用作免疫组化检测。
1.3 动物模型的制作
大鼠以10%水合氯醛(0.35 m l/100g)腹腔注射麻醉后,固定于立体定位仪上,局部头顶去毛、消毒,行头皮正中切口,剥离骨膜,暴露前囟,确定前、后囟,并使之处于同一水平面上,参照图谱[8]进行立体定位。于前囟右侧2.0mm,后3.0mm处钻一直径约1mm的小孔,用固定于立体定位仪上的微量注射器沿钻孔垂直进针2.5 mm到达大鼠海马,LPA组注射溶LPA 100 umol/L的磷酸盐缓冲溶液(PBS)50μl,(L+S)组注射溶100 umol/LLPA+10m ol/L苏拉明的PBS 50μl,对照组注射PBS 50 ul,注药后留针 5 m in,退针,缝合皮肤,回笼饲养,给予正常进食饮水,室温控制在25℃。
1.4 组织切片的准备
各组大鼠于相应时间点用过量水合氯醛麻醉开胸,暴露心脏,分离主动脉弓。将左心室尖用眼科剪刀剪开一小口,用16号套管针从左心室插入,进入主动脉弓,结扎固定,拔出针芯。同时于右心耳处剪一小口,用生理盐水快速冲洗,直至右心耳流出的液体变清,肝脏逐渐变为白色为止。再用4%多聚甲醛的(0.1 mol/LPBS配,pH 7.4)250 m l进行心脏灌注。固定液进入大鼠血管后,逐渐出现四肢抽动。待抽动完全停止,全身组织器官变硬后开颅取脑,置于4%多聚甲醛中固定12 h,然后进行石蜡包埋。在含海马区连续冠状切片,片厚5μm。
1.5 免疫组织化学检测
石蜡切片常规脱蜡、水化,PBS(0.1 mol/L,pH 7.4)浸泡5 min。3%过氧化氢溶液室温孵育 10 min,PBS洗3min×3次,滴加 TLR4多克隆抗体(1∶100)4 ℃过夜,加生物素化的羊抗兔IgG(1∶200)室温1 h。DAB显色,常规脱水、透明、封片。阴性对照用PBS代替一抗。每个标本取两张切片,在400倍光镜下随机观察并取5个不重复视野,采用image pro p lus软件分析,分析阳性细胞积分光密度(IOD),取平均值,再测量细胞分布的区域面积area,对染成黄色的细胞计算,作为细胞数N,以IOD∕(N*area)为统计指标,代表 TLR4表达后激活小胶质细胞程度。
1.6 阳性细胞判定细胞膜和胞浆内出现棕黄色颗粒者为阳性。
1.7 统计学处理
采用SPSS17.0统计软件进行统计学分析,所有数据均以平均数±标准差(±s)表示,不同时间点实验组、实验对照组和对照组之间比较采用单因素方差分析(one-way ANOVA),在单因素方差分析有意义的基础上再进行两组间差异性检验(LSD-t检验),P<0.05有统计学意义。
2 结 果
2.1 对照组TLR4的表达
对照组神经元和神经胶质细胞的薄膜和胞浆可见少量棕黄色颗粒,呈分支状,表明正常脑组织TLR4蛋白有微弱表达(图1)。
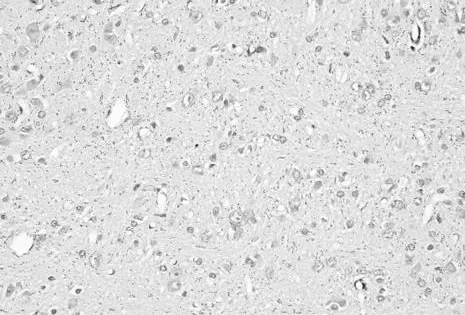
图1 正常情况下TLR4在小胶质细胞即有微弱表达(DAB染色×400倍)
2.2 LPA和LPA+S对脑组织TLR4表达的影响
实验显示在大鼠海马区注射LPA后,TLR4的表达呈一动态变化过程。注射 LPA后6 h TLR4的表达即有增加,24 h达高峰,48 h后开始下降,LPA组相应时间点 TLR4表达较对照组均显著增加,差异有统计学意义(P<0.05)。LPA+S组脑内注射后与 LPA组相比各时间点减少明显(P<0.01)(表1)。
表1 不同时间点大鼠海马区 TLR4阳性表达水平(±s)

表1 不同时间点大鼠海马区 TLR4阳性表达水平(±s)
注:与对照组比较,★P<0.05;与L+S组相应时间点比较,▲P<0.01
组别 大鼠数(只)不同时间点TLR4表达水平IOD∕(N*area)6 h 24 h 48 h对照组 10 1.33±0.12 LPA 组 10 35.08±1.55★▲78.44±2.36★▲45.35±3.78★▲LPA+S组 10 12.56±3.14★ 25.27±2.15★ 19.97±1.88★
LPA注射后TLR4表达强阳性部位主要为小胶质细胞胞浆内及突起内,小胶质细胞增生,胞体肥大,突起及胞浆均着色,阳性细胞分布普及、均一。LPA+S组可见少量染色阳性的小胶质细胞,形态基本接近正常,小胶质细胞呈灶状分布(图2、3)。
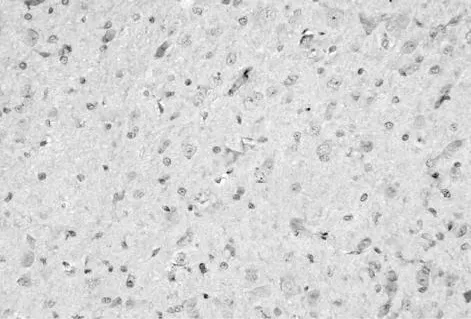
图2 LPA组注射后24 h TLR4在小胶质细胞的表达增加(DAB染色×400倍)
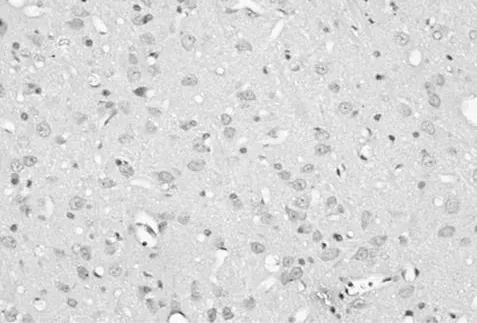
图3 LPA+S组注射后24 h TLR4在小胶质细胞的表达减少(DAB染色×400倍)
3 讨 论
脑出血损伤是典型的非感染性炎症,形成的血肿对周围组织的压迫缺血造成周围组织细胞损伤,氧自由基的产生及炎症介质的释放是其重要机制。在人类原代培养的小胶质细胞表达 TLR4,小胶质细胞作为中枢神经系统内潜在的抗原提呈细胞,在脑出血后迅速被激活,作为免疫细胞参与了脑出血的病理过程而星形胶质细胞和少突胶质细胞表达TLR4水平低下,但亦有报道星形胶质细胞和少突胶质细胞不表达TLR4[9]。
最近研究证实 TLR4在诱导的中枢神经损伤中发挥着关键作用,当 TLR4与配体结合后,启动NK-kB和IFN-b两条信号通路,导致多种炎症因子(如 TNF-α,L-1β和 L-6)、趋化因子等瀑布式释放,加重脑损伤[10]。LPA具有促内皮损伤,增加细胞粘附和内皮素释放等作用,其可能作为血管壁炎性反应的主要启动因子[11]。以往研究认为,TLR4介导的NF-kB信号途径参与脑出血后的炎症反应,加重脑组织损伤。且有实验表明脑出血后血浆中存在高浓度的LPA降解基底膜引发血管源性脑水肿,参与脑出血后脑水肿的形成[12]。但LPA促进小胶质细胞的增殖是否与TLR4的表达有关?
本实验观察到在注射LPA 6h后,注射局部的微血管及其周围 TLR4开始表达,24表达最强,以后逐渐下降。这表明,脑出血可诱导小胶质细胞从静息状态快速向活化状态转变,其形态的改变、免疫显型的变化呈一定的时间依赖性;而且血肿周围神经元的死亡和损伤与小胶质细胞的活化相关。苏拉明是G-蛋白偶联受体阻断剂,注射 LPA+S后,TLR4的表达较LPA组明显减少,这表明苏拉明能明显抑制LPA引起的TLR4的高表达,同时反证了TLR4信号传导途径在脑组织损伤所诱导的炎症反应中具有重要的作用。
近年来有关脑出血继发性损伤发病机制和防治研究成为热点,对TLR4在脑出血炎症损伤中作用机制的进一步研究,将有助于从炎症反应起点控制的角度揭开炎症因子参与脑出血损伤发生发展的机制,阐明固有免疫的启动与机体基本应激反应性损伤之间的联系[13]。
对于TLR4在脑出血炎症损伤中作用的进一步研究,将有助于揭示脑出血炎症损伤的上游机制,可能会为以后的治疗提供新的治疗方向和方法,有可能为脑出血的治疗提供新途径。TLR4可能在脑出血后脑炎症损伤中扮演重要角色。TLR4信号途径介导炎症反应导致多种CNS疾病的脑损伤发生,为深入阐明这些疾病的发病机制并拓展治疗方法提供了新的方向。但 TLR4在神经系统疾病领域的研究尚处于初步阶段,既是人体的天然免疫防御机制,又参与过度炎性损伤,其研究前景广阔。最近,有大量的实验结果提示脑出血后的血肿周围存在炎症反应,TLR4介导的信号途经是否参与脑出血炎症反应机制还有待于进一步阐明。随着TLR4功能及其下游信号通路的明确,阻断 TLR4的功能是一个潜在的治疗选择,因此,加强对TLR4的研究将会为CNS疾病的基础研究和临床应用开辟广阔的前景。
1 Zhang X,Li H,Hu S,et al.Brain edema afterintracerebralhemorrhage in rats:the roleof inflammation.Neurol India,2006,54(4):402-407.
2 余 樱,张兆辉,杨 波,等.溶血磷脂酸对血脑屏障通透性的影响及其机制.中华急诊医学杂志,2006,15(12):1109-1112.
3 Li H,Gang Z,Yuling H,et al.Different neu rotropic pathogenselicit neurotoxic CCR9-or neu rosupportiveCXCR3-expressing microglia.J Immunol,2006,177(6):3644-3656.
4 王立姝.TLR4对大鼠脑出血后炎症反应和神经细胞凋亡的作用研究.2009,中国医科大学.
5 Lehnardt S,Massillon L,Follett P,et al.Activation of innate immunity in theCNS triggersneurodegeneration through a Toll-like receptor 4-dependent pathway.Proc Natl Acad Sci USA,2003,100(14):8514-8519.
6 Tang SC,A rum ugam TV,Xu X,et al.Pivotal role for neuronal Toll-like receptors in ischemic brain injury and functional deficits.Proc Natl Acad Sci USA,2007,104(34):13798-13803.
7 Caso JR,Pradillo JM,H urtado O,et al.Toll-like receptor 4 is involved in subacu te stress-induced neu roinflammation and in the w orsening of experim en tal stroke.Stroke,2008,39(4):1314-1320.
8 包新民,舒斯云.大鼠立体定位图谱.北京:人民卫生出版社,1991.21-35.
9 LiW,Gao G,Guo,Q,et al.Function and phenotype ofm icroglia are determ ined by toll-like receptor 2/toll-like recep tor 4 activation sequence.DNA Cell Biol,2009,28(10):493-499.
10 Liu S,Kielian T,M icroglial activation by Citrobacter koseri is mediated by TLR4-and M yD88-dependent pathw ays.J Immunol,2009,183(9):5537-5547.
11 Ma L,Uchida H,Nagai J,etal.Lysophosphatidic acid-3 receptormediated feed-forw ard production of lysophosphatidic acid:an initiato r of nerve inju ry-indu ced neu ropathic pain.M ol Pain,2009,5:64.
12 李毅亮,张兆辉,阮清源,等.溶血磷脂酸对大鼠u PA蛋白的表达及其对血脑屏障的影响.卒中与神经疾病,2009.16(2):79-82.
13 Sum i N,Nishioku T,Takata F,et al.Lipopolysaccharide-activated m icroglia induce dy sfunction of the blood-b rain barrier in rat m icrovascu lar endothelial cells co-cultured w ith m icroglia.Cell Mol Neu robiol,2010,30(2):247-253.
