茶籽饼降解菌的筛选及降解条件优化与发酵效果的研究
2011-06-08田璨熙吴永尧娄立起周志成
田璨熙,吴永尧,娄立起,周志成
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
我国是世界油茶栽培面积最大,品种最丰富、茶油产量最高的国家。据不完全统计,全国每年产茶籽约6 000万t,榨油后的茶籽饼在3 500万t以上[1-2]。过去多用作燃料或肥料,对茶籽饼的综合利用率较低[3]。据报道,茶油下脚料中茶籽饼粗蛋白含量为12%~16%[4],粗蛋白中,不仅必需氨基酸含量较其它饼粕高[5],而且赖氨酸的含量较高[6-7]。说明茶籽饼具有极高的饲料开发价值,对于改良土壤板结、提高土壤肥力等方面也具有很高的潜在利用价值。可见,若能利用科学的方法将对其所含有的粗蛋白成分进行降解利用,茶籽饼的开发利用将变废为宝,前景诱人。
由于茶籽饼中含有天然的抑菌成分,抗菌作用较强[8],以致于一般的微生物不能以茶籽饼为底物生长[9],利用微生物对其进行降解比较困难,目前国内用微生物对茶籽饼进行有效降解的报道较少,因此笔者针对目前国内缺乏对茶籽饼进行微生物降解研究的现状,对能降解茶籽饼中粗蛋白的菌种进行广泛筛选,并对菌株发酵条件进行优化,为茶籽饼综合开发利用提供一定的理论和实验依据。
1 材料与方法
1.1 材料与试剂
菌株从自然环境中分离筛选;茶籽饼为某茶油厂提供。
富集培养基(g/L):茶籽饼 30,121℃下灭菌20 min;酪素平板培养基(g/L):干酪素 10,溶解,加水定容至1 000 mL并调pH值为5;琼脂2.5%。复筛培养基(g/L):(a)种子培养基为牛肉膏 5,蛋白胨10,NaCl 5 ,自然 pH 值;(b)摇瓶培养基:茶籽饼40。斜面培养基为另加质量分数为2%琼脂的种子培养基。
1.2 方 法
1.2.1 筛选方法 将采集的土壤和水样等样品按质量分数4%的接种量分别接种到富集培养基37℃条件下振荡培养3 d。利用蛋白酶对酪素的水解作用进行平板法筛选,将初筛后的活性单菌落菌置于4℃冰箱种斜面保存,用于进一步复筛。
将初筛的菌株接种于牛肉膏蛋白胨培养基中培养24 h后,接种于含6%的茶籽饼的复筛摇瓶培养基中振荡培养3 d,进行复筛。
1.2.2 分析方法 分析方法分为如下几个部分。(a)降解菌筛选方法。初筛用水解圈法对将接种于富集培养基中培养3 d后菌落进行多次平板划线纯化并保留;将初筛菌置于摇瓶中发酵通过酶活及生物量测定进行复筛。(b)粗酶液制备。供试菌株摇瓶发酵液经纱布过滤后,8 000 r/min离心20 min,收集上清液。(c)游离氨基酸含量测定。用茚三酮法[10]。(d)蛋白酶活力的测定.福林酚法测定[11]。酶活力定义为1 mL液体酶在40℃和pH 9的条件下1 min水解酪素产生1 μg酪氨酸为1个酶活力单位,以U/mL表示。(e)生物量的测定。平板菌落计数法及比浊法[12]。(f)降解率的测定。用凯式定氮法[13]将发酵前后底物经三氯乙酸浸泡处理12 h后过滤,弃上清液,对发酵前的粗蛋白含量与发酵后的粗蛋白含量分别进行测定:
降解率=[(发酵前粗蛋白含量-发酵后粗蛋白含量)/发酵前粗蛋白含量]×100%
1.2.3 培养基及条件的优化 保持基础培养基其它条件不变,依次改变培养基的茶籽饼质量分数、碳源和无机盐种类,等量接种T7菌悬液4 mL,37℃,装液量为100 mL/250mL,150 r/min摇床养48 h,通过对发酵液中蛋白酶活性及生物量测定来进行单因子优化。
在确定最佳茶籽饼质量分数,碳源和无机盐后,以初始pH值,接种量,温度,麦芽糖含量为对象,通过极差分析来确定最佳的培养条件,因素水平设计见表1。
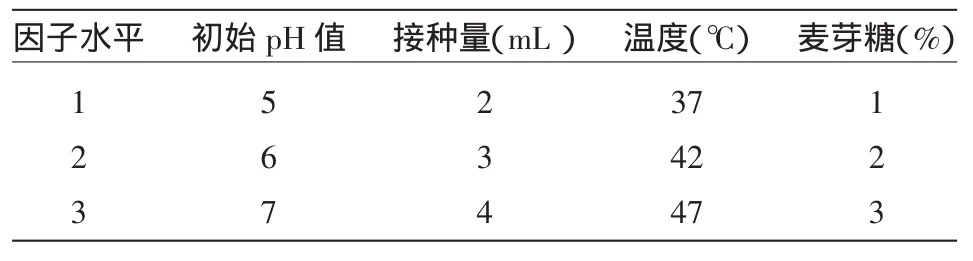
表1 正交试验因素与水平
1.2.4 发酵周期的测定 将菌株接种于上述最佳培养基及培养条件下摇瓶发酵,在培养24 h后每隔12 h取样测定其蛋白酶活力,生物量作图分析。1.2.5 降解菌的评价 将经筛选后的出发菌株及大豆粕高效降解菌M1,DB2[14]分别接种于底物为9%的茶籽饼(T7最适合的底物)和质量分数为9%的豆粕(M1,DB2最适合的底物)中摇瓶振荡培养48 h,以发酵后的生物量,酶活力为依据比较降解效果。
2 结果与分析
2.1 产蛋白酶的茶籽饼降解菌的筛选
2.1.1 初 筛 将若干个样品经茶籽饼培养基富集培养后,得到数株能以茶籽饼为底物生长且产生胞外分泌蛋白酶菌株,分别编号为T1到TN,其中T1、T6、T7、T9、T20、T31的蛋白水解能力较高。
2.1.2 复 筛 为进一步验证供试菌的降解能力,将初筛菌种中产生蛋白水解圈较大的6株菌发酵培养后,菌株T7表现出的酶活力和生物量为最优,因此选择T7为出发菌,如表2所示。
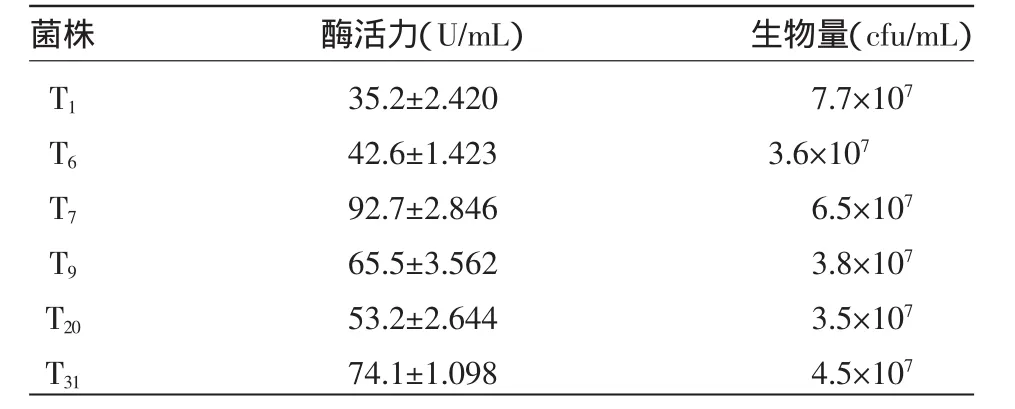
表2 菌株对茶籽饼的降解效果
2.2 单因素优化
2.2.1 茶籽饼的质量分数 菌株T7在不同茶籽饼质量分数下表现出的酶活力及生物量差异如表3所示。菌株T7在茶籽饼质量分数为9%时所表现出的生物量与蛋白酶活力最高,说明茶籽饼中所含的抑菌物质对菌株T7抑制作用很小,在茶籽饼质量分数9%以下,随茶籽饼质量分数的升高,基质中所含的某个或某些物质可能促进该菌种生长及蛋白酶的合成及分泌,而造成酶活和生物量区间性的线性增加,为此选择质量分数为9%的茶籽饼作为底物。

表3 不同的基质质量分数对生物量及酶活力的影响
2.2.2 碳 源 在发酵培养基中加入了麦芽糖能明显提高蛋白酶活力及生物量。结果一方面表明C/N比的升高能提高酶活及生物量,另一方面可能是因为加入麦芽糖为双糖,在发酵工艺上一般是属于菌体非直接利用的碳源,即对于该菌体而言,麦芽糖可能既是作为一种适合其自身的慢速利用碳源,对其蛋白酶分泌产生了延长作用,其水解产物葡萄糖又可能作为了一种诱导因子,对其蛋白酶的合成在分子水平上产生了诱导作用,结果如表4所示。
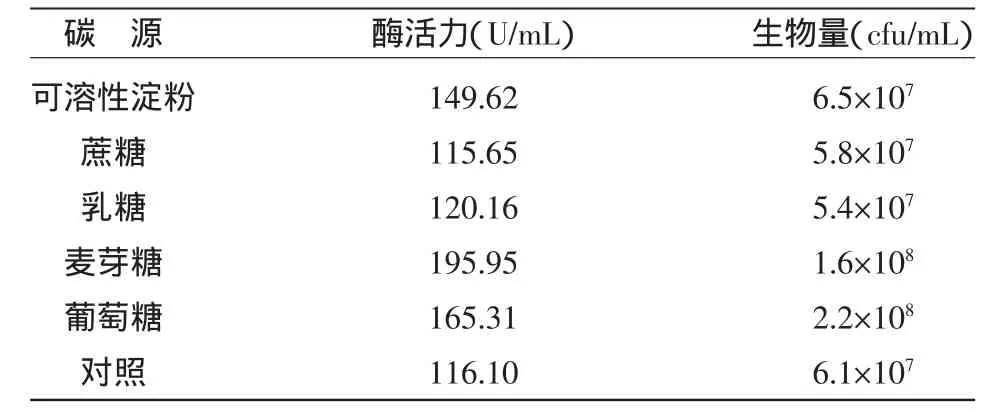
表4 不同碳源对生物量及酶活力的影响
2.2.3 无机盐离子 由表5可知:Ca2+作为通过增加膜的通透性而促进酶的分泌的作用在本实验条件下对此菌并没有显著作用,可能是由于茶籽饼本身所含有的茶皂素为天然的表面活性剂,对增加膜的通透性的效果更优于Ca2+;加入KH2PO4,NaCl后,发酵液的酶活和生物量都有提高,但酶活升高不显著,其原因可能由于离子浓度增加促进菌株生长代谢,消耗过量的底物,反而对蛋白酶的合成产生了一定程度的抑制作用;茶籽饼本身含有一定量的无机离子,外加的无机离子对菌体酶活的影响不明显,如表5所示。
2.3 正交条件优化结果

表5 不同无机离子对生物量及酶活力影响
根据各单因子优化的结果,以质量分数为9%的茶籽饼为底物,麦芽糖作为碳源,结合初始pH值,接种量,培养温度,做出的正交实验结果表明最佳培养条件组合是:100 mL培养基中,初始PH值为5,接种量为3 mL,麦芽糖2%,温度42℃,如表6所示。

表6 正交试验设计及结果
2.4 最佳培养时间
选择上述的最佳培养条件,对发酵时间作梯度处理可知,蛋白酶在60 h后合成量显著增高,但因基质浓度和代谢物累积等因素的影响,生物量明显降低,代谢途径倾向于次级代谢产物的合成,菌株T7在84 h时,酶活达到最高,因此选择84 h为最佳发酵周期。通过凯式定氮法得出,此时粗蛋白降解率为48.7%,其结果如图1所示。

图1 不同时间对发酵的影响
2.5 降解菌的评价
将供试菌与M1,DB2于豆粕和茶籽饼中作对比发酵后,菌株T7在以两种基质作为底物时的生物量差异较小,T7受茶籽饼中受含抑菌物质的影响小,酶活力在茶籽饼为降解底物时活性较高,说明茶籽饼对T7的产酶有促进作用,而菌株M1,DB2明显受到抑菌成分的影响,对茶籽饼无明显降解效果。表明菌株T7对茶籽饼的降解作用显著。三者之间的蛋白酶活力和生物量差异如表7、表8所示。

表7 三种菌株对豆粕的降解效果比较

表8 三种菌株对茶籽饼降解效果比较
3 结果与讨论
本研究中,对茶籽饼降解菌进行筛选,得到了一株受茶籽饼中抑菌物质影响小的产蛋白酶菌株,并对其发酵条件优化后,表现出良好的降解效果。
菌株T7,在培养时间优化时,表现出的不同于一般细菌生长曲线的规律,可能是因为该菌株由种子培养基转接到发酵培养基之后,由于茶籽饼中的大部分营养物质不能直接被细菌吸收利用,而需要经一段时间的降解,导致菌株因基质原因表现出了生长周期的延长或二次生长,进而导致培养周期的延长;另外,在对菌株T7分别对大豆粕和茶籽饼的降解能力比较表明,菌株对茶籽饼表现出了良好的适应性,以茶籽饼为底物的条件下,基质对菌体生长及产酶表现出了明显的促进性作用,可能在含有大量表面活性剂的基质中,表面活性剂对T7的生长代谢起到了促进作用。
由于茶籽饼中抑菌物质对大部分细菌的生长的抑制作用,导致了利用发酵法降解茶籽饼的困难,但利用菌株T7降解茶籽饼,可提高茶籽饼的综合利用率和经济价值,从而减少茶油下脚料的废弃对环境造成的污染及提高资源的利用率。但此菌株酶活力比一些高活性蛋白酶菌种要低,为此可以进一步尝试对该菌种进行诱变等方法,提高其酶活性,增加产物得率。此外,菌株T7能随基质浓度的升高而表现出更高的蛋白酶活力和茶籽饼对其它菌种则出现抑制作用的机理,也值得进一步研究。
[1] 刘志义,王素娥.茶籽饼饲料彻底脱毒试验[J].广西农业科学,1991,26(1):278-279.
[2] 唐 玲,冯宝民,李红冰,等.油茶皂素的研究进展[J].中南药学,2006,6(3):331-332.
[3] 殷肇君,李红权,李群芳,等.油茶粕中茶皂素的提取及纯化研究[J].饲业,2004,2(12):11-13.
[4] 张卫明,吴国荣,赵伯涛,等.茶籽油和饼粕的化学成分研究[J].南京师大学报,1992,15(3):82-84.
[5] 黄冬梅,胥 泓,李 庆,等.茶皂素提取工艺的研究及应用前景[J].化工科技市场,2003,(11):11-13.
[6] 郭锦华,岳艳荣,刘栗伟.茶皂素的提取工艺及发展前景[J].河南化工,1999,(4):3-5.
[7] 纪明慧,舒火明,孙振范,等.海南绿茶籽茶皂素提取工艺及茶籽油成分研究[J].安徽农业科学,2009,37(34):17077-17079.
[8] 张颂培,王 华.茶皂素及其在化妆品中的应用[J].北京工商大学学报,2009,27(3):12-14.
[9] 刘彦明,杨 宇,王 辉.茶饼中茶皂素的提取和微量元素的测定[J].信阳师范学院学报,2000,13(1):21-23.
[10] 诸葛健.工业微生物试验与研究技术 [M].科技出版社,2007:172-173.
[11] 姜锡瑞.酶制剂应用手册 [M].中国轻工业出版社,1999:292-297.
[12] 严益民.比浊法在测定发酵液菌体浓度中的应用[J].抚顺石油报,2001,21(1):22-25.
[13] 武雪萍,朱 凯,刘国顺.有机无机肥配施对烟叶化学成分和品质的影响[J].土壤肥料,2005,(1):10-13 .
[14] 颜焱娜,杨红武,刘仁萍,等.油脂下脚料降解菌的选育[J].天然产物研究与开发,2010,(4):23-27.
