应用套式RT-PCR快速检测鸭坦布苏病毒
2011-06-08颜丕熙李国新吴晓刚闫丽萍滕巧泱李泽君
颜丕熙,李国新,吴晓刚,闫丽萍,滕巧泱,李泽君
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241)
2010年春季以来,上海市、江苏省、浙江省、安徽省等地相继爆发一种导致蛋鸭减产、生长迟缓和死亡的一种新发病,研究证明引起该病的病原为坦布苏病毒(Tembusu virus)[1,2]。该病毒可经空气传播,对蛋鸭及肉鸭均有致病力。病鸭主要表现为高热、运动障碍、食欲下降甚至废绝、产蛋下降甚至停止,严重可导致死亡,死亡率可达5%~10%。剖检可见脾脏明显肿大;肝脏出血严重,伴有针尖状白色坏死点;卵巢发生出血、萎缩、破裂,输卵管有粘液[1,2]。由于该病毒为新发病原,目前尚无可靠的检测方法。本研究组曾使用RT-PCR方法对临床样品进行检测,但发现RT-PCR的敏感性比较差,不能有效的检测出该病毒。近年来套式RTPCR在疾病的诊断方面显示出灵敏、特异的优点,在登革热病毒[3]、蜱传脑炎病毒[4]和西尼罗病毒[5]等黄病毒的检测中都得到了很好应用。鉴于此,本研究建立了套式RT-PCR方法,该方法能够快速、敏感、特异地检测出鸭坦布苏病毒,为该病快速诊断与流行病学调查奠定了基础。
1 材料与方法
1.1 鸭坦布苏病毒的增殖 鸭坦布苏病毒(FX2010)由本研究室分离鉴定。取保存的病毒液100 μL接种9日龄SPF鸡胚,收集24~120 h死亡鸡胚胚体,胚体研磨后,7500×g离心30 min,吸取上清,滴定病毒含量后,用于后续试验。
1.2 引物设计 根据坦布苏病毒(FX2010)E基因序列设计两对特异性的重叠引物(表1),引物由上海Invitrogen公司合成,用DEPC水稀释至终浓度为10 μmol/L,分装后冻存于-20℃。
1.3 病毒RNA的提取 取1.5 mL Eppendorf管,向其内加入500 μL上述病毒液、800 μL Trizol(Invitrogen),静置5 min;加入0.2 mL氯仿,振荡15 s,静置2~3 min;4℃离心10 min,吸取上清并加入等体积的异丙醇,沉淀10 min;4℃ 10 800×g离心10 min,弃上清,用75%酒精清洗沉淀,混匀后,10 800×g离心10 min;倒掉上清,RNA自然干燥,用20 μL DEPC水溶解RNA。
1.4 反转录 将5μL RNA提取液与2 μL Random 9(TaKaRa)混匀,70 ℃保温10 min,迅速冰浴2 min,然 后 分 别 加 入 4 μL 5×AMV Buffer、1μL RRI、1μL AMV(Takara)、1 μL 10 umol/L dNTP、6 μL DEPC水,共20 μL,混匀后30 ℃保温10 min,42 ℃1 h,75 ℃ 10 min。
1.5 套式RT-PCR方法的建立 第一轮PCR采用25 μL反应体系:12.5 μL PCR Mix(东盛生物),1 μL P1(10 umol/L),1 μL P2(10 umol/L),1 μL cDNA模板,灭菌ddH2O补加至25 μL。置于PCR仪中,94 ℃预变性4 min;94 ℃变性30 s,53℃退火30 s,72 ℃延伸1 min,进行25个循环;最后72 ℃延伸10 min。1.0%琼脂糖凝胶电泳,并用凝胶成像系统进行拍照。第二轮PCR采用25 μL体系:取第一轮PCR反应液1 μL为模板,12.5 μL PCR Mix、1 μL P3(10 umol/L)、1 μL P4(10 umol/L),灭菌ddH2O补加至25 μL,置于PCR仪中。94 ℃预变性 4 min;94℃变形 30 s,53 ℃退火 30 s,72 ℃延伸30 s,进行25个循环;最后72 ℃延伸10 min。1.0%琼脂糖电泳,并用凝胶成像系统进行拍照。
1.6 套式RT-PCR与普通PCR敏感性比较 取病毒液进行10倍系列稀释(表2)。每个稀释度取200 μL按上述方法进行RNA提取及反转录,所获得的cDNA取1 μL作为模板,用引物P1、P2进行第一轮扩增,反应结束后进行电泳检测。以第一次PCR产物(1μL)为模板,用引物P3、P4进行套式RT-PCR扩增。同时利用1μL cDNA作为模板,用引物P3、P4进行普通PCR扩增。反应结束后进行凝胶电泳检测。
1.7 特异性实验 以禽流感病毒、新城疫病毒、网状内皮增生病病毒、鸭肝炎病毒等病毒的核酸反转录产物为模板,按上述方法对其进行PCR扩增,每次扩增设双蒸水作阴性对照,鸭坦布苏病毒反转录cDNA为模板作为阳性对照,扩增反应结束后用凝胶电泳检测。
1.8 临床应用 从安徽省、河北省、山东省、 浙江省、上海市等地发病鸭场采取病鸭脾脏组织,按1g/mL PBS加入PBS进行研磨,4℃ 10 800×g离心10 min。取200 μL上清按上述方法提取病毒RNA及反转录,随后进行套式RT-PCR检测,扩增反应结束后进行凝胶电泳检测。将阳性病料接种8日龄SPF鸭胚后分离该病毒,并应用该套式RT-PCR方法对分离病毒的鸭胚尿囊液进行检测,以确定病毒分离结果。
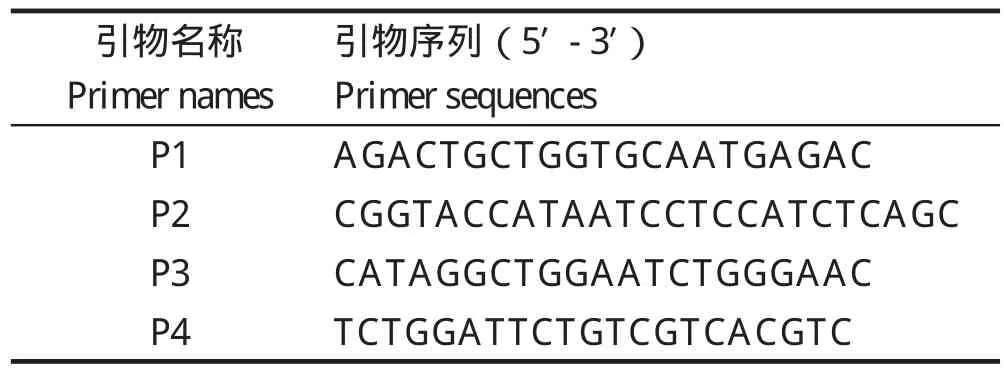
表1 PCR扩增所需特异性引物Table1 The specific primers for PCR amplication
2 结果
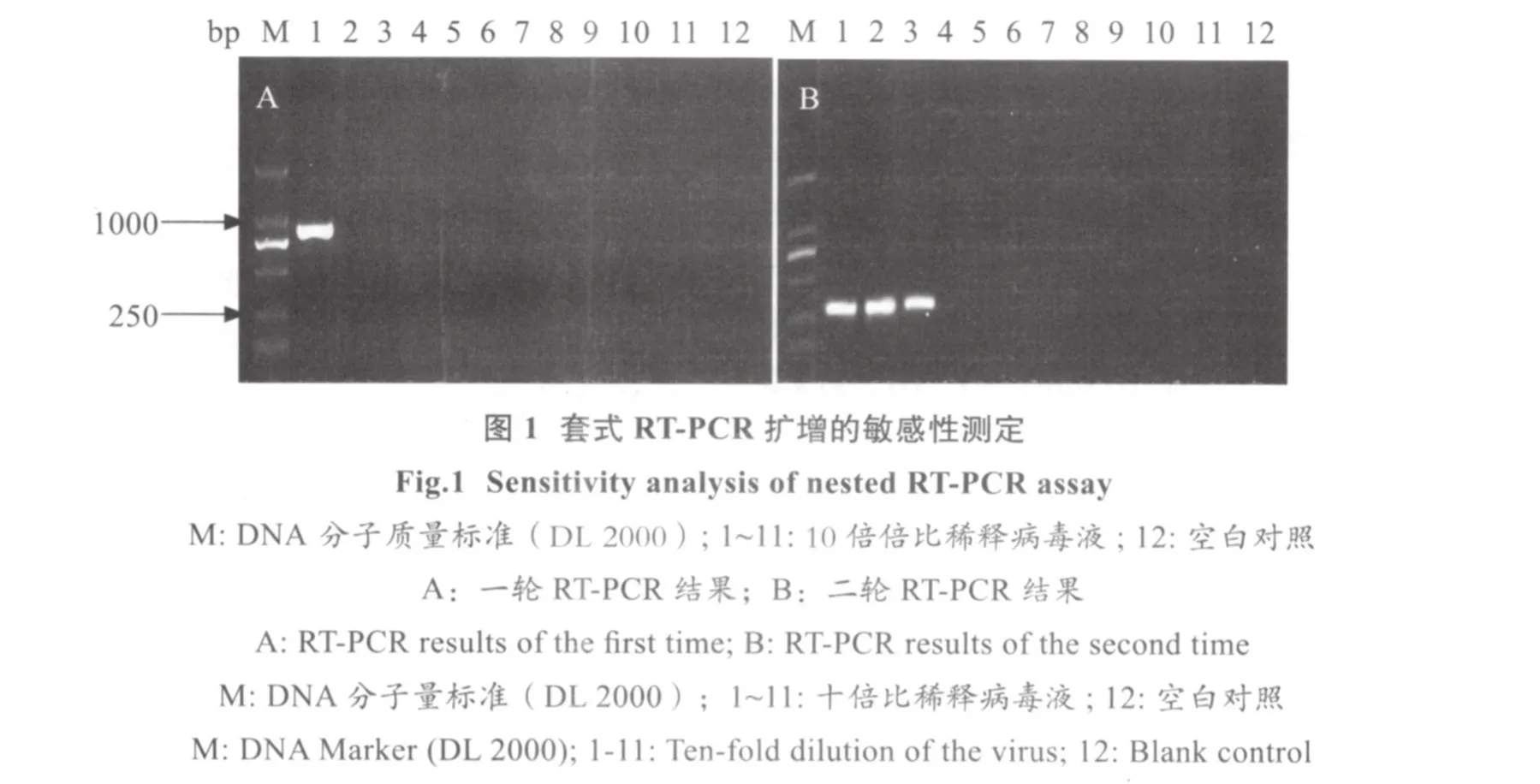
2.1 套式RT-PCR与普通PCR敏感性的比较 将毒价为105.25ELD50/100 μL的病毒液做10倍系列稀释,每个稀释度取200 μL提取RNA,反转录后取1 μL(见表2)为模板,进行第一轮扩增。凝胶电泳结果显示,只有毒价为2×105.25/100μL的病毒可以获得962 bp的目的条带(图1A)。用引物P3和P4进行第二轮扩增,结果显示,毒价为2×103.25/100 μL的病毒可以获得300 bp的目的条带(图1A)。而直接用引物P3和P4进行普通PCR扩增,病毒滴度达到2×104.25/100 μL时才可获得特异条带(图2)。结果表明套式RT-PCR扩增的敏感性较常规的PCR方法高10倍 (表2)。
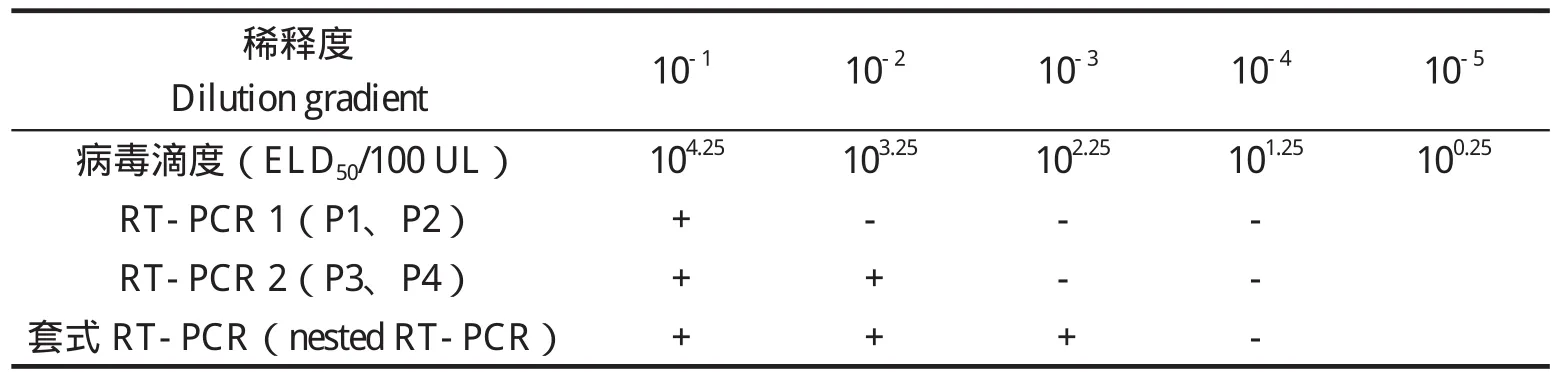
表2 套式RT-PCR的敏感性Table 2 Sensitivity comparison between nested RT-PCR assay and RT-PCR

2.2 套式RT-PCR的特异性 以禽流感病毒、新城疫病毒、网状内皮增生病病毒、鸭肝炎病毒等病毒的核酸反转录产物为模板,同时以双蒸水作阴性对照,以鸭坦布苏病毒做阳性对照,按上述方法对其进行PCR扩增,结果见图3。试验结果显示此PCR反应对鸭坦布苏病毒具有特异性。
2.3 临床样品检测 应用该套式RT-PCR方法对浙江省、上海市、山东省、河北省、安徽省等送检的病料进行PCR扩增,结果阳性病料可获得了300 bp的目的片段,阳性检出率为48/63,与病毒分离率为13/63,结果见表3。
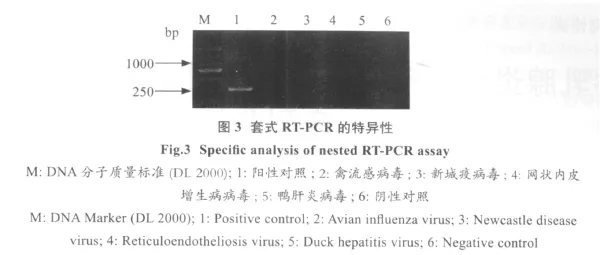
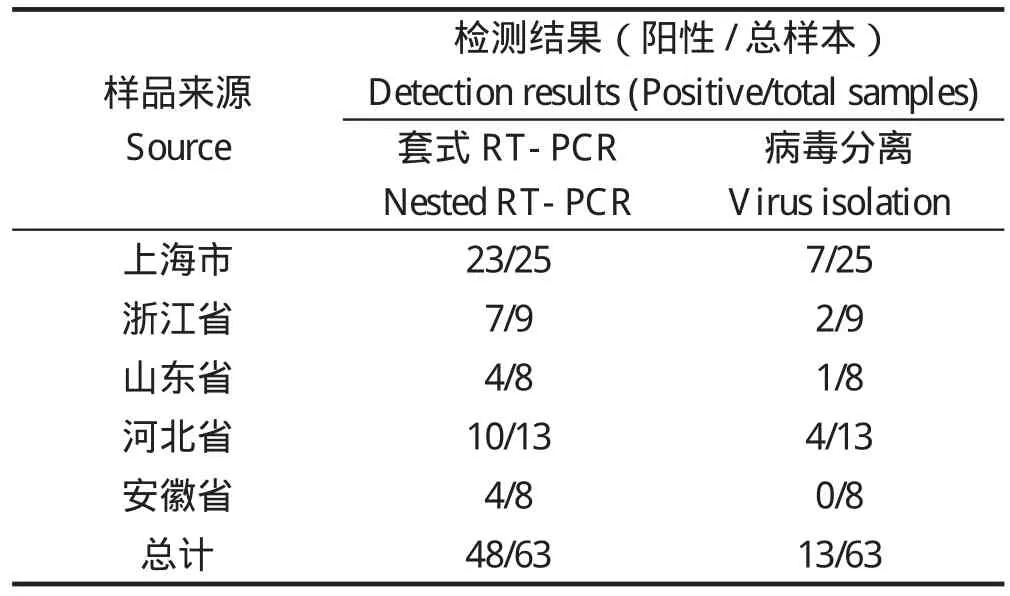
表3 临床样品检测Table 3 The detection of clinical samples by nested RT-PCR
3 讨论
鸭坦布苏病毒是2010年新发现的一种病毒。目前所知,该病毒主要侵害鸭,尤其是蛋鸭,可使蛋鸭采食量下降、生长迟缓、体重下降、产蛋减少甚至停止,并能导致一定的死亡率。剖检病理特征主要是脾脏肿大、肾脏肿大、严重者肝脏后期有针尖状白色坏死点等。该病毒的致病特点和机理目前尚不十分清楚。目前中国多数地区都遭受该病的影响,给蛋鸭养殖业带来了极大的损失。
对于该病的诊断,采用传统的病毒分离方法费时费力,并且敏感性低。本研究建立了RT-PCR方法和套式RT-PCR方法检测该病毒,并对两种方法的敏感性作了比较。结果显示,套式RT-PCR方法比RT-PCR方法1(引物P1、P2)敏感性高100倍,比RT-PCR方法2(引物P3、P4)敏感性高10倍。在特异性试验中阳性病料可获得300 bp的目的条带,而禽流感病毒、新城疫病毒、网状内皮增生病病毒、鸭肝炎病毒等的扩增结果均为阴性,表明该方法具有良好的特异性。应用该套式RT-PCR对临床病料进行检测验证,结果表明该套式RT-PCR是检测鸭坦布苏病毒的有效手段,可用于鸭坦布苏病毒的临床诊断和分子流行病学调查。同时,应用该方法可以对病毒分离进行检测与验证。综上所述,本研究所建立的套式RT-PCR能快速、灵敏、特异地检测出鸭坦布苏病毒,将为该病的防治与防控发挥重要作用。
[1]Su J, Li S, Hu X,et al. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related flavivirus[J]. PLoS One, 2011, 6(3): e18106.
[2]滕巧泱, 颜丕熙, 张旭, 等. 一种新的黄病毒导致蛋鸭产蛋下降及死亡[J]. 中国动物传染病学报, 2010, 18(6):1-4.
[3]Bronzoni R V, Moreli M L, Cruz A C,et al. Multiplex nested PCR for Brazilian Alphavirus diagnosis[J]. Trans R Soc Trop Med Hyg, 2004, 98(8): 456-461.
[4]Puchhammer-Stockl E, Kunz C, Mandl C W,et al.Identification of tick-borne encephalitis virus ribonucleic acid in tick suspensions and in clinical specimens by a reverse transcription-nested polymerase chain reaction assay[J]. Clin Diagn Virol, 1995, 4(4): 321-326.
[5]Johnson D J, Ostlund E N, Pedersen D D,et al. Detection of North American West Nile virus in animal tissue by a reverse transcription-nested polymerase chain reaction assay[J]. Emerg Infect Dis, 2001, 7(4): 739-741.
