牛乳腺炎金黄色葡萄球菌肠毒素A基因的克隆及序列分析
2011-06-08唐吉思吴金花布日额张海宝薛晓阳张忠祥
唐吉思,吴金花,布日额,张海宝,薛晓阳,刘 洋,张忠祥
(1. 内蒙古民族大学动物科技学院,通辽028043;2. 内蒙古民族大学生命科学学院,通辽028043;3. 内蒙古通辽市家畜繁育指导站,通辽028000)
奶牛乳腺炎(Bovine mastitis)是影响世界奶业发展的最主要奶牛疾病之一,它不仅给世界的乳品工业带来巨大的经济损失,而且还危害到公共卫生和人类健康[1,2]。金黄色葡萄球菌(Staphylococcus aureus)是引起奶牛乳腺炎的主要病原菌之一,根据相关文献报道由其引起的奶牛乳房炎占到50%以上[3]。金黄色葡萄球菌可损害乳房上皮细胞和腺泡的功能,使牛奶产量迅速下降,损失量约占总产量的10%~25%[4]。携带毒素基因的金黄色葡萄球菌在适当环境温度、pH、介质下还能产生毒素,影响乳制品的质量安全,同时对消费者带来安全隐患。在引起食品污染和细菌性食物中毒的案例中,金黄色葡萄球菌是仅次于大肠埃希菌的致病菌[5],约占33%。金黄色葡萄球菌产生多种毒素,主要有肠毒素(staphylococcal enterotoxins,SEs)、剥脱毒素(exfoliative toxins,ETs)和中毒休克毒素(toxic shock syndrome toxin 1,TSST-1)等。其中肠毒素是引起食物中毒的重要因子,它是一类结构相关、毒力相似、抗原性不同的胞外蛋白质[6],金黄色葡萄球菌肠毒素A(stapylococoal enterotoxin A,SEA)便是其中最重要的肠毒素之一,同时也是经常引起暴发性食物中毒的重要致病因子。在牛乳中若含有足够量的SEs即可引起食物中毒,患者通常在食入被SEs污染的食物2~6 h后发病,症状为恶心、呕吐、腹部疼痛和腹泻[7]。在美国爆发的食物中毒病例中,SEA所占的比例最大(77.8%),其次为SED(37.5%)和SEB(10.0%)[8]。为了控制金黄色葡萄球菌在食品中的残留及其造成的危害,对金黄色葡萄球菌肠毒素基因的克隆研究成为生物学界感兴趣的研究方向[9,10]。本研究成功克隆了SEA基因片段并进行序列分析,为建立相应的快速检测牛乳中SEA方法奠定了研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 金黄色葡萄球菌标准菌株(ATCC13565)由东北农业大学乳品中心惠赠;克隆载体pGEM-T easy、DH5α购自广东东盛生物科技有限公司。
1.1.2 培养基及抗生素 营养肉汤培养基、血液琼脂平板、LB培养基等本实验室自备;糖发酵反应管、药敏纸片(氨苄青霉素、庆大霉素、四环素、氟哌酸、链霉素、环丙沙星、氯霉素、复方新诺明)购自杭州天和微生物试剂有限公司。
1.1.3 主要试剂 PCR buffer、dNTP mix、Taq酶等均购自大连宝生物工程有限公司;普通琼脂糖凝胶回收试剂盒、蛋白酶K、溶菌酶购自北京索莱宝科技有限公司;质粒提取盒购自北京庄盟国际生物基因科技有限公司;TE (10 mmol /L Tris-HCl,1 mmol /L EDTA,pH 8.0)、10%SDS、饱和酚/氯仿/异戊醇(25:24:1)、丙酮、无水乙醇等试剂均为国产分析纯。引物由上海英骏生物技术有限公司合成。
1.2 方法
1.2.1 细菌的培养、分离及鉴定 将采集的乳样用接种环接种于营养肉汤培养基中,37℃培养24 h进行增菌。将增菌培养液划线接种于普通琼脂平板上,置温箱37℃培养18~24 h,观察菌落形态。挑取可疑菌落涂片,革兰氏染色镜检,进行纯化培养;同时划线接种鲜血琼脂平板,置温箱37℃培养24 h后,观察培养特性。
1.2.1.1 糖(醇)类发酵试验 取18~24 h的菌接种于糖发酵管中,置37℃培养24~48 h后观察指示剂颜色以及产气现象。如果指示剂由紫色变为黄色,表明糖类被发酵而产酸;若指示剂不变色,则表示其对糖类不发酵;若发酵管顶部有气泡出现,则表示产气。使用甘露醇、果糖、棉子糖、蔗糖、乳糖、麦芽糖等进行发酵试验。
1.2.1.2 血浆凝固酶试验 将1:4的兔血浆0.5 mL置于洁净灭菌的小试管中,再加入细菌悬浊液0.5 mL摇匀。另外用标准阳性菌株作为阳性对照,生理盐水作为阴性对照。
1.2.1.3 接触酶试验 用接种环挑取新鲜的纯化菌落置于洁净载玻片上,滴加1滴3%的过氧化氢溶液,观察结果。
1.2.1.4 甲基红试验 取少量37℃培养了24~48 h的培养液于另一试管内,加几滴试剂,若培养液呈红色,则为阳性;如果呈现黄色则为阴性,仍需继续培养4~5 d后进行试验。
1.2.2 PCR扩增SEA 根据GenBank中公布的Staphylococcus aureus的SEA基因序列,使用Primer 5.0和Oligo 6.0软件设计引物,该引物扩增片段长度为582 bp(见表1)。模板的制备采用溶菌酶、蛋白酶K消化,氯仿异戊醇抽提的方法[11]。目的基因PCR扩增反应体系如下:10×PCR buffer(Mg+)2.5 μL、dNTP(2.5 mmol/L)mixture 2 μL、模板 DNA 2 μL、上游引物(20 pmol/μL)1μL、下游引物(20 pmol/μL)1 μL、Taq酶 (5 U/μL)0.5 μL、ddH2O 16 μL,总反应体系 25 μL。PCR反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,30个循环;72 ℃再延伸5 min,4℃保存。取50 μL的PCR产物进行琼脂糖凝胶电泳,在紫外透射仪下观察条带。

表1 扩增SEA基因片段的引物序列Table 1 Primers used for PCR amplification of SEA gene
1.2.3 PCR产物的克隆和序列测定 按照Solarbio生物公司琼脂糖凝胶回收试剂盒说明书回收PCR产物,将胶回收产物连接pGEM-T Easy载体,连接体系如下:2×T4连接酶 buffer 5 μL、pGEM-T Easy Vector 1 μL、模板 DNA 1 μL、T4 DNA 连接酶 1 μL、ddH2O 2 μL,总反应体系 10 μL。
将连接产物转化感受态大肠杆菌DH5α,把转化菌涂布于含有氨苄青霉素的营养琼脂培养基上,并进行蓝白斑筛选。挑取白斑于含有氨苄青霉素的LB培养基中37℃震荡过夜培养,然后按照质粒提取试剂盒提取重组质粒DNA,阳性克隆质粒命名为pGEM-SEA。用PCR方法快速鉴定克隆阳性,反应条件同前。PCR阳性质粒再用EcoRⅠ酶来进行酶切鉴定,反应体系如下:重组质粒pGEMSEA 5 μL、EcoR Ι 0.5 μL、10× Buffer 2 μL、ddH2O 12.5 μL,总反应体系 20 μL。
阳性质粒送上海生工测序,将所获得序列与GenBank中公布的序列进行比较分析。
2 结果
2.1 金黄色葡萄球菌的分离、培养及鉴定结果 分离的细菌在普通琼脂平板上培养18 h后形成了湿润、光滑、隆起、边缘整齐的中等大小的菌落,初期呈灰白色,一段时间后转为金黄色;在鲜血琼脂培养基上培养24 h左右形成的菌落较普通琼脂平板较大,呈金黄色,圆形隆起、表面光滑、湿润,边缘整齐,溶血类型为β型。细菌形态观察表明,分离菌株在显微镜下呈葡萄状簇集成堆,少数成双或散在,有的以短链排列,革兰氏染色呈阳性。
2.2 生化特性鉴定 分离菌的生化特性鉴定结果为该菌能发酵6种糖类,接触酶试验、凝固酶试验及溶血试验均呈阳性(见表2)。
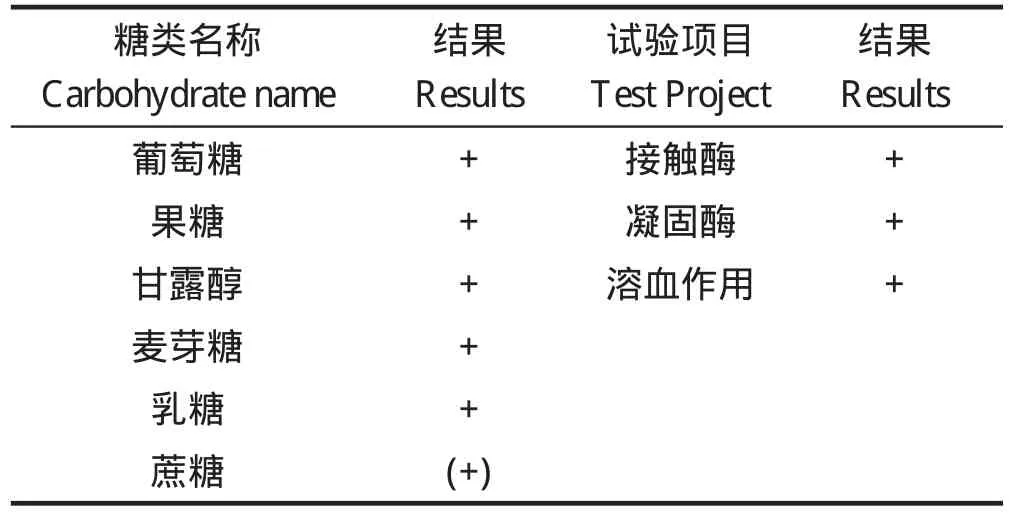
表2 分离菌生化试验结果Table 2 The results of biochemistry identity of Staphylococcus aureus
2.3 目标基因克隆结果 从临床采集的金黄色葡萄球菌菌株提取总DNA作为模板,经PCR扩增SEA基因后,扩增出大约580 bp的目的条带,结果见图1。
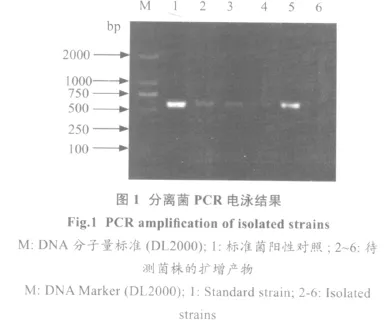
2.4 pGEM-SEA重组质粒的筛选及酶切鉴定 SEA的PCR扩增产物克隆入pGEM-T easy载体中,挑取白色菌落扩增培养后提取质粒,PCR筛选阳性质粒,用EcoR I进行酶切,消化产物经1%琼脂糖凝胶电泳分析。重组质粒经酶切后,得到约580 bp的目的条带,表明重组质粒构建正确,将此质粒命名为pGEM-SEA(图2、3)。



2.5 SEA基因的序列分析 测序结果表明,克隆的基因序片段列长度为582 bp,与GenBank公布的序列(EF520720.1)比对,核苷酸序列共有5处出现碱基突变,见图4,相似性达到99.14%。分离株与标准菌株SEA基因序列的相似性达到100%。
3 讨论
SEA是其引起食物中毒的主要毒素之一,一旦残留于原料乳中往往造成食物的安全隐患。但是由于该毒素在100℃下能够耐受2 h而不被破坏,目前各种乳品生产工艺过程的加热灭菌过程均不可杀灭它。近年来围绕其开展研究的基础报道较多,内蒙古自治区是中国重要的乳品生产与供应基地,开展与乳品安全相关的基础研究对于保障广大乳品消费者安全具有重要意义。
本试验采集的乳样来自内蒙古通辽市周边蒙牛乳业集团所属奶牛场患有乳腺炎的奶牛,金黄色葡萄球菌总体检出率在30%左右,经过生化试验及PCR分子鉴定筛选出SEA阳性菌株4个。表明该病原菌在内蒙古东部地区仍属于主要的病原菌之一,而且产SEA菌株确实存在。
本研究成功地克隆牛源SEA基因片段,长度为582 bp。与GenBank公布的序列(EF520720.1)进行核苷酸序列比对,结果表明,该片段共有5处碱基突变,相似性达到99.14%。可见,内蒙古地区牛源SEA具有一定的差异性。
在糖发酵试验中,5株金黄色葡萄球菌对甘露醇和蔗糖的发酵结果并不完全一致,部分菌株对蔗糖发酵试验表现阴性,可能是在传代培养过程中出现了代谢特征的变异。药敏试验表明,所分离的金黄色葡萄球菌对氨苄青霉素表现出明显的耐药性,对链霉素、卡那霉素、庆大霉素、氯霉素、氟哌酸、复方新诺明也有一定程度的耐药性,但对四环素和环丙沙星敏感性较高,该结果与王登峰等[12]的报道结果不一致,可能是因为各地临床选用抗生素类药物品种不同,进而造成了耐药性差异。
临床上奶牛乳腺炎发病率很高,特别是隐性乳腺炎造成的危害最为严重。为了控制乳腺炎的发生,业者通常会给与大剂量的抗生素进行治疗与控制,但这样往往造成大量耐常规药物的耐药菌株产生,并随着食物直接危害人类。随着人们对绿色乳品消费的需求,乳品安全问题越来越引起全社会的高度重视,因此加强牛乳品相关病原菌的基础研究对控制奶牛乳腺炎的发生与发展具有重要意义。
[1]Denis M, Wedlock D N, Lacy-Hulbert S J, et al. Vaccines against bovine mastitis in the New Zealand context: what is the best way forward[J]. N Z Vet J, 2009, 57 (3): 132-140.
[2]Taverna F, Negri A, Piccinini R, et al. Characterization of cell wall associated proteins of a Staphylococcus aureus isolated from bovine mastitis case by a proteomic approach[J]. Vet Microbiol, 2007, 119 (2-4): 240-247.
[3]Talbot B G, Lacasse P. Progress in the development of mastitis vaccines[J]. Livestock Prod Sci, 2005, 98(1-2):101-113.
[4]Kerro-Dego O, Prysliak T, Potter A A. DNA-protein immunization against the GapB and GapC proteins of a mastitis isolate of Staphylococcus aureus [J].Vet Immunol Immunopathol, 2006, 113 (1/ 2): 125-138.
[5]高涛.食品中金黄色葡萄球菌肠毒素及检测方法的研究进展[J]. 福建分析测试, 2003, 12(2): 1775-1778.
[6]张严峻, 张俊彦, 梅玲玲, 等. 金黄色葡萄球菌肠毒素基因的分型和分布[J].中国卫生检验杂志, 2005,15(6):682-683.
[7]E. P. Casman and R. W. Bennett. Culture medium for the production of staphylococcal enterotoxin A[J]. Bacteriol,1963, 7(86): 18-23.
[8]Hayes P R. Food Microbiology and Hygiene[M]. London:Elsevier Appied Science, 1985: 38-41.
[9]张红河, 张卫英, 董晓勤, 等. 快速检测金黄色葡萄球菌肠毒素A基因方法的建立与应用[J]. 中国微生态学杂志,2006, 18(1): 46-47.
[10]陈悦, 倪培华, 吴洁敏. 金黄色葡萄球菌肠毒素 A基因克隆及表达[ J ]. 检验医学, 2006, 2l(2): 113-116.
[11]萨姆布鲁克J, 拉塞尔D W. 分子克隆实验指南[M]. 3版.黄培堂, 王嘉玺, 译. 北京: 科学出版社, 2002, 1256-1259.
[12]王登峰, 李建军, 段新华, 等. 我国牛源金黄色葡萄球菌耐药现状及药敏试验方法探讨[J]. 中国动物传染病学报, 2011,19(1): 31-37.
