H1N2亚型猪流感病毒反向遗传操作系统的建立
2011-06-08周艳君李泽君马继红杨馥如童光志
黄 梦,于 海,周艳君,李泽君,马继红,杨馥如,童光志
(中国农业科学院上海兽医研究所,上海 200241)
猪流感(swine influenza)是由A型流感病毒引起的,广泛存在于猪群中的一种严重的猪呼吸系统疾病,主要临床症状为突发、高热、咳嗽、呼吸困难、衰竭、发病率高和死亡率低。猪流感病毒(Swine influenza virus,SIV)容易发生变异,目前已发现的A型SIV有H1N1、H1N2、H1N7、H2N3、H3N1、H3N2、H3N3、H3N6、H4N6、H5N1和H9N2等11种不同血清亚型,其中在中国广泛流行的主要是H1N1、H1N2、H3N2三种[1-3]。一直以来,由于猪流感单独感染不会在猪群中大规模流行,也不引起猪群的死亡,猪流感在临床上一直没有引起广泛的重视。但是,由于猪流感在公共卫生方面的意义,以及近年来猪在流感病毒新亚型产生中具有混合器作用共识的产生,猪流感的研究开始得到重视。2009年爆发的甲型H1N1流感的病原更是与猪流感病毒有着千丝万缕的联系,研究证实是由一株北美的三元重组毒株H1N1或H1N2与欧亚谱系的H1N1猪源流感病毒重组而来,这一研究结果甚至导致了“谈猪流感色变”的恐慌[4-6]。
反向遗传学操作技术是一种可以从分子水平上探讨流感病毒致病性、宿主适应性及跨种间传播的可能性及其机制的热门技术。通过对病毒的基因组进行直接的操作和修饰,利用经修饰的克隆化的cDNA获得有感染性的病毒,再对病毒的特性,如生长能力,致病性及宿主适应性进行研究,从而对病毒决定其致病力,种间传播能力的功能位点和基因片段进行定位[7-19]。建立H1N2亚型SIV反向遗传操作系统,并拯救出能够在动物传代细胞中复制的重组H1N2亚型SIV,能够为SIV致病机理、传播机制及病毒基因功能的研究以及新型猪流感疫苗的研制奠定坚实基础。
1 材料和方法
1.1 毒株与质粒 猪流感毒株A/swine/Shanghai/1/07(H1N2)(简称S12)由本实验室分离保存[20];八质粒流感病毒拯救系统双向表达载体PBD由李泽君研究员提供。
1.2 菌种和细胞 E.coli JM109感受态细胞由本实验室制备;293T细胞由本实验室保存;SPF鸡胚种蛋购自山东昊泰实验动物繁育有限公司。
1.3 主 要 试 剂 AMV Reverse Transcriptase、LA Taq、dNTP、Klenow大片段均购自TaKaRa大连宝生物工程公司;高保真酶PfuUltra Ⅱ Fusion Hs DNA Polymerase购自Agilent公司;RNA提取试剂盒RNeasy Mini Kit, 质粒提取试剂盒QIAGEN Plasmid Purification Kit购自QIAGEN公司;柱式胶回收试剂盒购自上海华舜公司;BspQⅠ、T4 DNA Polymerase、T4 DNA ligase均购自 NEB公司;DMEM培养基、OPTI-MEM培养基、TPCK-trypsion、FCS、Lipofectamine 2000均购自Invitrogen公司。
1.4 主要试剂引物设计 对GenBank中公布的H1N2亚型流感病毒5'和3'末端保守序列进行比对,并参照文献[21],利用Oligo6.0软件设计合成扩增流感病毒PB2、PB1、PA、HA、NA、NP、M和NS基因的引物及流感病毒反转录通用引物Uni-12,引物由Invitrogen公司合成。
1.5 病毒RNA的提取及RT-PCR扩增 按照RNeasy Mini Kit说明书提取分离保存的鸡胚尿囊液中病毒的总RNA,用鼠源反转录酶AMV Reverse Transcriptase 反转录获得病毒cDNA。以此cDNA为模板,用高保真酶PfuUltra Ⅱ Fusion Hs DNA Polymerase扩增病毒的HA、NA、NP、M、NS、PA、PB1、PB2八个基因片段。
1.6 重组质粒的构建、鉴定及纯化 PCR产物经1%琼脂糖电泳后,切下目的条带,用柱式胶回收试剂盒回收纯化。M、NS、HA、NA、NP、PA、PB1和PB2八个基因片段的胶回收产物,在dCTP和dTTP存在的条件下,用T4 DNA Polymerase 12 ℃作用30 min、75 ℃作用20 min。PBD载体经BspQⅠ酶切回收后,在dATP和dGTP存在的条件下,用Klenow大片段在25 ℃作用25 min、75 ℃作用20 min,然后分别用胶回收试剂盒回收最终产物,处理好的基因片段与PBD载体,在T4 DNA ligase的作用下16 ℃连接5 h。
连接产物按常规方法转化至大肠杆菌JM109感受态细胞中,取100 μL菌液涂布于含有氨苄青霉素(50 μg/mL)LB平板上,37 ℃培养12 h,挑取白色孤立菌落,接种于5 mL含有氨苄青霉素(50μg/mL)液体LB培养基,37 ℃培养8 h。菌液PCR鉴定为阳性克隆的,送上海Invitrogen公司进行序列测定。序列正确的质粒按照QIAGEN Plasmid Purification Kit的说明书提取质粒,并对质粒浓度进行精确测定。
1.7 病毒的拯救 按每个质粒1 μg的比例,将8个质粒混合到同一个EP管内,加入250 μL无血清的OPTI-MEM培养基。16 μL Lipofectamine 2000与250 μL无血清的OPTI-MEM培养基混合作用5 min。作用好的Lipofectamine 2000加至混合好的质粒中,室温作用20 min。胰酶消化293T细胞接种细胞培养板,过夜培养形成单层。用OPTI-MEM细胞培养液洗单层细胞2次,将上述质粒和脂质体混合物加到细胞单层表面。37 ℃、5%CO2培养箱中培养6 h后,弃去上清,添加1.5 mL的含1%犊牛血清的OPTI-MEM培养基,37℃、5%CO2培养箱培养48 h。48 h后,用1 mL注射器吸取细胞上清接种于9~11日龄SPF鸡胚尿囊腔。置于37 ℃温箱,24 h后,弃去死亡鸡胚,48 h后收集鸡胚尿囊液。1.8 获救病毒的鉴定 收集的鸡胚尿囊液,用血凝试验(HA)检测,确定其血凝效价,然后将此尿囊液再次接种SPF鸡胚,72 h后收集鸡胚尿囊液测定其血凝效价。按照RNeasy Mini Kit说明书提取鸡胚尿囊液中病毒的总RNA,用鼠源反转录酶AMV Reverse Transcriptase 反转录获得病毒cDNA。以此cDNA为模板,扩增病毒M基因的一段保守区序列,PCR产物纯化克隆后,送上海Invitrogen公司进行序列测定。测序结果与亲本的相应序列进行比对,确定拯救的病毒的核苷酸序列与亲本的相应序列是否相符合。同时,以此cDNA为模板,扩增病毒的HA、NA、NP、M、NS、PA、PB1、PB2八 个 基因片段,并经1%谅脂糖凝胶电泳鉴定基因片段大小与预期是否相符。
2 结果
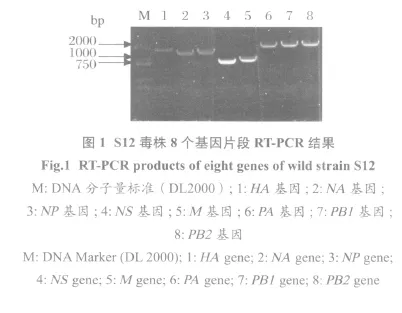
2.1 RT-PCR扩增产物的鉴定结果 从分离保存的鸡胚尿囊液中提取病毒的总RNA,分别用8对特征性引物,RT-PCR扩增病毒的8个基因片段,经1%琼脂糖凝胶电泳,得到的HA、NA、NP、M、NS、PA、PB1、PB2这8个基因片段的大小与预期相符(图1)。2.2 重组PBD阳性质粒鉴定结果 8个基因片段连接到PBD载体上后,常规方法转化到JM109大肠杆菌感受态细胞中,菌液PCR鉴定为阳性的,送上海Invitrogen公司进行序列测定,测序结果与实际相符。
2.3 拯救病毒的鉴定结果 从接种细胞上清的SPF鸡胚中收集到的鸡胚尿囊液能够使1%的红细胞悬液发生凝集现象。由于S12亲本毒株血凝效价很低,仅为1:8,拯救的一代病毒的血凝效价也很低,仅为1:2。将拯救的一代病毒再次接种于SPF鸡胚,72 h后收集鸡胚尿囊液,再次测得的血凝效价为1:8,与原始毒株完全一致。
提取鸡胚尿囊液中病毒的总RNA, 反转录获得病毒cDNA。以此cDNA为模板,扩增病毒M基因的一段保守区序列,PCR产物纯化克隆后,经序列测定确定拯救病毒的核苷酸序列与亲本的相应序列相符合。同时,扩增拯救病毒的8个基因片段,经1%琼脂糖凝胶电泳,基因片段的大小与预期相符(图2)。由以,确定重组病毒获得成功拯救,将此病毒命名为rS12。

3 讨论
猪流感是广泛存在于猪群中一种呼吸系统疾病,单独感染不引起明显的症状,也不会导致猪群的死亡,但是当猪流感病毒与猪繁殖与呼吸综合征病毒、猪支原体等呼吸系统疾病病原混合感染或继发时,常常造成严重的损失。另外,由于猪流感在公共卫生方面的意义,对人类健康存在着潜在的威胁,所以,为了更好防控猪流感,对猪流感病毒的致病机制进行深入研究显得尤为重要。
反向遗传操作技术提供了一个可以从分子水平研究流感病毒致病性、种间传播能力、病毒变异机制的平台和基础。本研究成功构建了H1N2亚型猪流感病毒毒株S12的八质粒反向遗传操作系统,从哺乳动物细胞中拯救出有活性的病毒粒子,经鉴定各基因片段的序列与原始病毒相应序列完全一致。此反向遗传操作系统的构建为进一步研究病毒的复制调控机制、变异方向、致病性、种间传播分子机制奠定了基础,同时也为猪流感新型疫苗的研制开辟了新的途径。
[1]郭元吉, Webster R G, 王敏. 猪型流感病毒血凝素基因的核苷酸全序列分析[J].中华实验和临床病毒学杂志,1995, 9(1): 11-14.
[2]Ma W, Vincent A L, Gramer M R, et al. Identification of H2N3 influenza A viruses from swine in the United States[J]. Proc Natl Acad Sci USA, 2007, 104(52): 20949-20954.
[3]于海. 中国部分地区猪流感病毒的分子流行病学研究[D].北京:中国农业科学院, 2008.
[4]Chen G W, Shih S R.Genomic Signatures of Influenza A Pandemic (H1N1)2009 Virus[J]. Emerg Infect Dis, 2009,15(12): 1897-1903.
[5]Steel J, Staeheli P, Mubareka S, et al. Transmission of Pandemic H1N1 Influenza Virus and Impact of Prior Exposure to Seasonal Strains or Interferon Treatment [J]. J Virol, 2010, 84: 21-26.
[6]Yassine H M, Khatri M, Zhang Y J, et al.Characterization of triple reassortant H1N1 Influenza A viruses from swine in ohio [J]. Vet Microbiol, 2009, 139: 132-139.
[7]程从升, 舒跃龙, 张智清. 流感病毒的反向遗传学研究进展[J].病毒学报, 2007, 23(1): 68-71
[8]刘大飞, 刘明, 刘春国, 等. H1N1 亚型猪流感病毒反向遗传操作系统的建立及高产细胞型疫苗株的拯救[J].中国农业科学, 2009, 42(5): 1797-1804.
[9]苏胜杰, 许静, 宋家升, 等. H5N1 亚型高致病性禽流感病毒A/duck/HuBei/49/05 株反向基因操作系统的建立[J]. 畜牧与饲料科学, 2010, 31(2): 20-21.
[10]Erich Hoffmann, Gabriele Neumann, Yoshihiro Kawaoka,et al. A DNA transfection system for generation of influenza A virus from eight plasmids [J]. Proc Natl Acad Sci USA, 2000, 97(11): 6108 - 6113.
[11]Hoffmann E, Webster R G. Unidirectional RNA polymerase I-polymerase II transcription system for the generation of influenza A virus from eight plasmids [J]. J Gen Virol,2000, 81: 2843-2847.
[12]Fodor E, Devenish L, Engelhardt O G, et al. Rescue of Influenza A Virus from Recombinant DNA [J]. J Virol,1999, 73(11): 9679-9682.
[13]Gabriele Neumann, Ken Fujii, Yoichiro Kino, et al. An improved reverse genetics system for influenza A virus generation and its implications for vaccine production [J].Proc Natl Acad Sci USA, 2005, 102(46): 16825-16829.
[14]Gabriele neumann, Tokiko watanabe, Hiroshi ito, et al.Generation of influenza A viruses entirely from cloned cDNAs [J]. Proc Natl Acad Sci USA, 1999, 96: 9345-9350.
[15]Hiroichi Ozaki, 1 Elena A, Govorkova, et al. Generation of High-Yielding Influenza A Viruses in African Green Monkey Kidney (Vero)Cells by Reverse Genetics [J].J Virol, 2004, 78(4): 1851-1857.
[16]Keawcharoen J, Spronken M I, Vuong O, et al. Repository of Eurasian influenza A virus hemagglutinin and neuraminidase reverse genetics vectors and recombinant viruses [J].Vaccine, 2010, 28(36): 5803-5809.
[17]Ozawa M, Goto H, Horimoto T, et al. An Adenovirus Vector-Mediated Reverse Genetics System for Influenza A Virus Generation [J]. J Virol, 2007, 81(17): 9556-9559.
[18]Pirada Suphaphiphat, Bjoern Keiner, Heidi Trusheim, et al. Human RNA Polymerase I-Driven Reverse Genetics for Influenza A Virus in Canine Cells [J]. J Virol, 2010,84(7): 3721-3725.
[19]Jackson S, Van Hoeven N, Chen L M, et al.Reassortment between Avian H5N1 and Human H3N2 Influenza Viruses in Ferrets: a Public Health Risk Assessment [J].J Virol, 2009, 83(16): 8131-8140.
[20]Yu H, Zhang P C, ZhouY J, et al.Isolation and genetic characterization of avian-like H1N1 and novel ressortant H1N2 influenza viruses from pigs in China [J].Biochem Biophys Res Commun, 2009, 386: 278-283.
[21]Hoffmann E, Stech J, Guan Y, et al.Universal primer set for the full-length amplification of all influenza A viruses[J]. Arch Virol, 2001, 146: 2275-2289.
