宿主细胞磷酸激酶在新城疫病毒感染中的作用
2011-06-08陈鸿军仇旭升孙英杰于圣青
詹 媛,陈鸿军,仇旭升,孙英杰,于圣青,丁 铲
(中国农业科学院上海兽医研究所,上海 200241)
新城疫(newcastle disease,ND)是由新城疫病毒(Newcastle disease virus, NDV)引起的急性、高度接触性的人畜共患病,主要侵害禽类,被OIE列为List A疾病。自1926年ND首次爆发以来,世界范围内大流行已有3次[1]。ND在中国已存在几十年,至今仍然是家禽的主要疫病之一。NDV的基因组由单股负链RNA构成,基因组按照3'-NP-P-M-F-HN-L-5'的顺序编码6种病毒结构蛋白。
近年来,逐步有研究发现p38MAPK、PKA以及Akt等磷酸化通路在病毒感染的过程中发挥了重要的作用。腺病毒可通过PKA和PI3K信号途径对内皮细胞中连接蛋白40和43的表达进行调节。最新研究表明,在流感病毒感染过程中,宿主通过对蛋白磷酸化水平的调节进而调节病毒蛋白表达和病毒的大量增殖[2]。而在与NDV同属于副黏病毒属的水泡性口炎病毒(Vesicular stomatitis virus,VSV)、呼吸道合胞体病毒(Respiratory syncytia virus,RSV)和麻疹病毒(Measles virus,MeV)中也已经发现细胞内的CK-II和PKC等磷酸化激酶参与了病毒的感染过程[3]。关于磷酸化通路是否参与了NDV的感染过程目前尚无报道。本研究利用蛋白磷酸激酶抑制剂和激活剂研究磷酸化通路在NDV感染中的作用,试图为NDV复制机理和抗病毒药物的研究提供新的思路。
1 材料与方法
1.1 毒株和细胞 本试验所用病毒毒株为NDV标准强毒 Herts/33,由扬州大学刘秀梵院士惠赠;鸡0系成纤维细胞细胞系(DF1)由本研究室保存;细胞采用含10%胎牛血清的DMEM 培养液,常规37 ℃、5%CO2 培养箱中传代培养。
1.2 化学试剂 4',6-二脒基-2-苯基吲哚(DAPI),SB203580、H-89、staurosporine 和PMA购自Sigma公司;其他生化试剂均为分析纯,购自生工生物工程(上海)有限公司产品。
1.3 NDV感染相关宿主磷酸激酶的初步筛选将DF-1细胞5×103个/孔接种至96孔细胞培养板中,使用10% FBS的1640培养基在37 ℃、细胞培养箱中培养。细胞生长到70%左右时,参考相关文献中的浓度,分为5个处理组:PKC抑制剂Staurosporine(100 nmol/L)处理组[4],PKC激活剂PMA(100 nmol/L)处理组[5],Staurosporine和PMA联用组[6],p38MAPK 蛋白激酶抑制剂SB203580(20 μmol/L),PKA蛋白激酶抑制剂H-89(10 μmol/L)。每组每孔均加入100 μL的药物,37 ℃作用4 h后洗去。将10-1到10-9倍比稀释的病毒尿囊液接种至96孔板中,每一稀释度接种一纵排8个重复。最后两纵排为正常DF-1对照,置于细胞培养箱中继续培养,逐日观察细胞病变并记录结果,按Reed-Muench法计算药物处理后的 TCID50。
1.4 PKC蛋白激酶抑制剂处理条件的优化
1.4.1 PKC蛋白激酶抑制剂预处理时间对NDV生长的影响 用100 nmol/L的staurosporine分别4 、6 、8 h预处理细胞后,接种10倍倍比稀释(10-1~10-9)的Herts/33鸡胚尿囊液,测定病毒的TCID50,确定staurosporine的最适预处理时间。
1.4.2 PKC蛋白激酶抑制剂浓度对NDV生长滴度的影响 用不同浓度的staurosporine预处理DF1后,分别接种100×TCID50、50×TCID50和20×TCID50的Herts/33病毒,观察抑制剂浓度和病毒致细胞病变能力之间的关系
1.5 PKC蛋白激酶抑制剂的细胞毒性实验
1.5.1 PKC蛋白激酶抑制剂对细胞形态的影响将细胞培养用飞片分别放入35 mm培养皿中,将1×105细胞接种于培养皿中,加入2 mL含10%FBS DMEM培养基,37 ℃细胞培养箱中培养。当细胞生长到70%左右时,分别用2、5、10、20、50、100、200、400、500 nmol/L staurosporine处理4 h,DAPI染色,正置显微镜观察细胞核形态变化。
1.5.2 PKC蛋白激酶抑制剂对培养基pH的影响用培养DF1细胞所用的DMEM培养基配制2、5 、10、20、50、100、200 nmol/L的staurosporine工作液,用pH计测定其pH值。
1.6 PKC蛋白激酶抑制剂对病毒生长状况的影响
用20 nmol/L的staurosporine预处理细胞4 h,然后用Herts/33病毒感染DF-1细胞,在感染后的不同时间点收集培养上清,测定TCID50。分别用20、50、100、200 nmol/L的 staurosporine预处理细胞4 h,然后用Herts/33病毒感染DF-1细胞,在感染后的不同时间点收集培养上清,测定病毒的滴度。设置同样稀释倍数的DMSO作为对照。
2 结果
2.1 NDV感染相关宿主磷酸激酶的筛选结果
2.1.1 PKC激酶抑制剂和激活剂对Herts/33毒力的影响 本实验所用Herts/33毒株的病毒滴度为109.0TCID50/0.1 mL,而用100 nmol/L PKC激酶抑制剂staurosporine预处理DF1细胞4 h后病毒滴度变为107.8TCID50/0.1 mL,下降了101.2 个滴度;用100 nmol/L PKC激酶激活剂PMA预处理DF1细胞4 h后病毒滴度为108.8TCID50/0.1 mL;若将等量的staurosporine和PMA混合后预处理DF1细胞4 h,病毒滴度为108.59TCID50/0.1 mL。用同稀释度的DMSO预处理DF1细胞4 h后病毒滴度为108.8TCID50/0.1 mL(图1)。

图1 磷酸激酶抑制剂和激活剂对Herts/33毒力的影响Fig.1 The influence of the of different inhibitors and activators of phosphokinase on the titer of the NDV Herts/33
2.1.2 PKA和p38MAPK抑制剂对Herts/33病毒滴度的影响 本试验所用Herts/33毒株的病毒滴 度 为 108.5TCID50/0.1 mL, 用 10 μm ol/L/PKA激酶抑制剂H-89预处理DF1细胞4 h后测定病毒 滴 度 为108.33TCID50/0.1 mL; 用 20 μm ol/L p38MAPK激酶抑制剂SB203580预处理DF1细胞4 h后测定病毒滴度为108.43TCID50/0.1 mL。同时设置staurosporine和DMSO对照组,用100 nmol/Lstaurosporine和同稀释度的DMSO预处理DF1细胞4 h后测定病毒滴度分别为107.41TCID50/0.1 mL和108.41TCID50/0.1 mL(图2)。

图2 PKC蛋白激酶抑制剂处理时间与病毒滴度之间的关系Fig. 2 The relation between the processing time of proteinkinase C inhibitor and the titer of the Herts/33
2.2 PKC蛋白激酶抑制剂的作用条件
2.2.1 PKC蛋白激酶抑制剂的最佳作用时间用100 nmol/L的staurosporine分别4、6、8 h预处理细胞,同时设置未用药物的处理组,测定病毒的TCID50,结果见图2。
2.2.2 staurosporine的最适工作浓度 无论staurosporine浓度有多高,都无法抑制100 TCID50和50 TCID50的Herts/33病毒,所有的孔都出现细胞病变。而当病毒接种量为20 TCID50时,随着staurosporine浓度的升高,细胞病变率逐渐下降(表1)。当药物浓度为400 nmol/L时,对细胞产生明显的损伤。
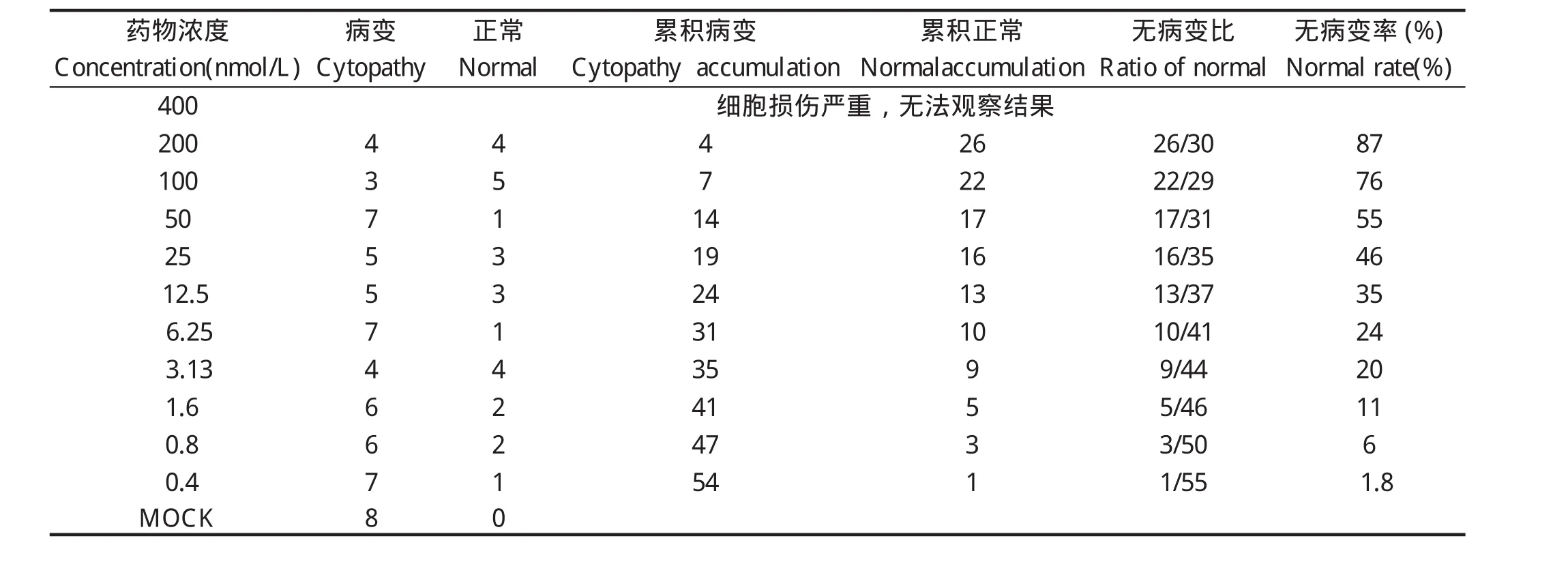
表1 病毒接种量为20 TCID50时staurosporine 浓度与病变率之间的关系Table 1 The relation between the concentration of staurosporine and the cytopathy post infected with 20 TCID50 Herts/33
2.3 PKC蛋白激酶抑制剂的细胞毒性实验
2.3.1 PKC蛋白激酶抑制剂对细胞形态的影响分别用 2、5、10 、20 、50、100 、200、400、500 nmol/L的staurosporine处理DF1细胞4 h后,DAPI染色,以正置显微镜观察,结果显示在2 nmol/L至200 nmol/L的浓度范围内,细胞核形态无明显变化(图3)。当浓度大于400 nmol/L时,细胞受到明显影响。

图3 staurosporine浓度对细胞核形态的影响Fig.3 The in fluence of different concentration of staurosporine on the shape of cell nucleus
2.3.2 PKC蛋白激酶抑制剂对细胞培养基PH的影响 测定用DMEM配制成的2、5、10、20、50、100、200 nmol/L的staurosporine工作液的pH值与DMEM培养基的pH值(7.54)无明显差别,基本稳定在7.5左右。
2.4 PKC蛋白激酶抑制剂对病毒增殖的影响
2.4.1 staurosporine对病毒增殖的影响 接种0.01 MOI的 病 毒 2、3、4、6、8、10、12、16、20、24、30、36、42、48 h时分别收集细胞培养物上清,用TCID50方法测定病毒的滴度。100 nmol/L药物处理组在8 h后上清中病毒的滴度开始逐渐下降,与未处理组相比48 h后最终约下降100.5个滴度。以时间的log2为横轴,上清中TCID50的对数值为纵轴,绘制出细胞上清中的病毒滴度曲线(图4)。
图4 不同试剂处理细胞后上清中病毒在不同时间的滴度Fig.4 The growth curve of Herts/33 virus infected with chicken embryo fibroblast (DF1)cells which were treated by different reagents
2.4.2 不同浓度的staurosporine对病毒增殖的影响
分别用20、50、100、200 nmol/L的 staurosporine预处理细胞4 h,分别在感染后8、16、24、32、40、48 h收集细胞培养物上清,用TCID50方法测定病毒的滴度。结果显示,随着药物浓度的增加,上清中病毒的滴度逐渐下降,而DMSO对照组并无影响(图5)。

图5 不同浓度staurosporine处理DF1细胞后对病毒增殖速率的影响Fig.5 The effect of virus propagation rate in DF1 cells which were dealt with different concentrations of staurosporine and infected with Herts/33
3 讨论
近年来关于磷酸化通路与病毒感染进程的相关性研究逐渐受到了大家的关注。在研究较为透彻的丙型肝炎病毒中,已经发现宿主细胞内的磷酸化激酶可以使丙肝病毒的F蛋白磷酸化,从而造成蛋白分布的差异进而影响病毒的复制转录过程[7]。而通过缺失蛋白磷酸化位点的方法导致病毒的活力衰减也有先例,由此机理构建出的弱毒狂犬病毒株已在美国获得专利。这些研究结果表明,宿主细胞的磷酸激酶与病毒的增殖能力之间存在有一定的关系,迄今为止尚无NDV的P蛋白的磷酸化水平对其功能影响的的相关报道。但是,已有大量的外国学者在其他副黏病毒中发现P蛋白的磷酸化作为一种调控手段参与病毒的增殖过程[8-13],这也是本研究的切入点。
已知蛋白激酶C(protein kinase C,PKC)属于丝氨酸/苏氨酸激酶家族,与介导细胞的生长、分化和凋亡的信号转导密切相关[14]。staurospurine(STS)是从链酶菌素提取的一种化合物,为经典的PKC 抑制剂,主要作用于PKC 的C 端催化区,抑制PKC 催化底物时与ATP 的结合[15]。通过staurosporine抑制试验,我们证实了PKC激酶与NDV增值速率之间存在着一定的相关性。研究结果表明,staurosporine可以通过抑制PKC活性进而降低NDV的病毒滴度,而且这种抑制作用可被PKC激酶的专性激活剂PMA所反抑制。除PKC外,病毒可以通过PKA和PI3K途径调节细胞内蛋白的表达水平也被广泛证实。在丙肝病毒中,NS3是蛋白激酶A(PKA)和蛋白激酶C(PKC)介导的磷酸化作用的有效调节因子,通过影响环磷酸腺苷(cAMP)及磷脂酰肌醇(PI)等信号转导通路中蛋白激酶的级联反应,进而调节基因转录、激活特定基因表达。在本试验中发现,PKA蛋白激酶的抑制剂H-89和P38MAPK通路的抑制剂SB203580等均对NDV的病毒增殖无影响,这就说明PKC蛋白激酶确实通过对P蛋白磷酸化的影响参与了NDV的增殖调控。
由于staurosporine还可以参与细胞周期的调节,抑制细胞的生长并诱导凋亡的产生,所以具有一定的毒副作用。为此,我们测定了staurosporine的最佳作用时间和浓度。结果显示,在2 h到6 h的预处理时间内,staurosporine均可以发挥其抑制功能,以4 h的预处理时间最为理想。当NDV接种量为20个TCID50时,0.4 nmol/L至200 nmol/L的staurosporine均可抑制病变的产生;当浓度为50 nmol/L时可达到50%的抑制率。但是这种抑制作用也是有限的,当病毒接种量为50和100个TCID50时,无论何种浓度的staurosporine均无法抑制病变的产生,这可能是因为PKC在大量NDV同时感染细胞时对病毒增殖的调控作用是有局限性的。
为了直观的表现出PKC蛋白激酶抑制剂对NDV病毒增殖的影响,我们测定了staurosporine参与下NDV生长曲线的改变。通过与未处理组和DMSO对照组相比较可以发现,staurosporine处理8 h后起可以发现病毒的增值速率开始降低,最终下降100.5个滴度。通过不同浓度的staurosporine处理实验发现,这种下降程度与药物浓度呈现出相关性,随着药物浓度的增加,病毒增殖速率下降程度越发剧烈。此外,我们还可以看出这种抑制作用起始于病毒感染的早期,因为在病毒接种后8 h开始就可以观察到明显的差异。
我们认为,NDV的磷酸化相关蛋白可能导致了以上实验结果,NDV的基因组由单负股RNA构成,基因组按照3'-NP-P-M-F-HN-L-5'的顺序编码六种病毒结构蛋白。P蛋白的主要功能是与L蛋白、NP蛋白形成有活性的RNA 聚合酶,参与病毒基因组RNA的转录和复制,而且P蛋白中的丝氨酸和苏氨酸含量较高,可作为磷酸化的位点。一般认为,P蛋白的磷酸化可以引起蛋白的结构发生变化或改变等电点,从而促进其与NP蛋白和L蛋白的作用,同时对于自身寡聚体的形成起着至关重要的作用[16,17]。本文通过初步揭示了PKC蛋白激酶与病毒增殖之间的关系,并推测这种影响作用可能是通过对P蛋白磷酸化水平的调节而实现的,这一研究结果将对发现抗NDV病毒药物靶标或研究NDV新型防控技术具有重要意义。
[1]殷震, 刘景华. 动物病毒学[M]. 2版.北京: 科学出版社,1997: 736-743.
[2]He Y, Xu K, keiner B, et al. Influenza A virus replication induces cell cycle arrest in G0/G1 phase [J].Virology,2010, 22, [Epub ahead of print].
[3]Sun M, Fuentes S M, Timani K, et al. Akt plays a critical role in replication of non-segmented negative-stranded RNA viruses[J]. J Virol, 2008, 82(1): 105-114.
[4]蔡阳, 欧阳荔. Staurosporine 衍生物的合成[J]. 中国医药工业杂志, 2001, 32(1): 12-13.
[5]王燕燕, 周政涛, 崔向军, 等. 蛋白激酶C抑制剂星形孢菌素对肺腺癌A549 细胞侵袭力的影响研究[J].中国药房, 2010, 21(25): 2336-2338.
[6]陈宏, 李荣清, 丁云霞, 等. PKC激活剂佛波酯PMA 和抑制剂Staurosporine 对大肠癌HT229 细胞黏附作用的影响[J]. 实用癌症杂志, 2005, 20(1): 39-43.
[7]Appel N, Pietschmann T, Bartenschlager R.Mutational analysis of hepatitis C virus nonstructural protein 5A:potential role of differential phosphorylation in RNA replication and identification of a genetically flexible domain[J]. J Virol, 2005, 79(5): 3187-3194.
[8]Saikia P, Gopinath M, Shaila M S. Phosphorylation status of the phosphoprotein P of rinderpest virus modulates transcription and replication of the genome[J]. Arch Virol,2008, 153(4): 615-626.
[9]Jakubiec A, Jupin I. Regulation of positive-s trand RNA virus replication: the emerging role of phosphorylation[J].Virus Res, 2007, 129(2): 73-79.
[10]Shiell B J, Gardner D R, Crameri G, et al. Michalski WP. Sites of phosphorylation of P and V proteins from Hendra and Nipah viruses: newly emerged members of Paramyxoviridae[J]. Virus Res, 2003, 92(1): 55-65.
[11]Kaushik R, Shaila M S. Cellular casein kinase II-mediated phosphorylation of rinderpest virus P protein is a prerequisite for its role in replication/transcription of the genome[J]. J Gen Virol, 2004, 85(Pt 3): 687-691.
[12]Huntley C C, De B P, Banerjee A K. Phosphorylation of Sendai virus phosphoprotein by cellular protein kinase C zeta[J]. J Biol Chem, 1997, 272(26): 16578-16584.
[13]Asenjo A, González-Armas J C, Villanueva N.Phosphorylation of human respiratory syncytial virus P protein at serine 54 regulates viral uncoating[J]. Virology.2008, 380(1): 26-33.
[14]Hofmann J. Protein kinase C isozymes as potential targets for anticancer therapy[J]. Curr Cancer Drug Targets,2004, 4(2): 125-146.
[15]Entschladen F, Drell T L 4th, Lang K, et al. Neurotransmitters and chemokines regulate tumor cell migration:potential for a new pharmacological approach to inhibit invasion and metastasis development[J]. Curr Pharm Des,2005, 11(3): 403-411.
[16]Ahlquist P, Noueiry A O, Lee W M, et al. Host factors in positive-strand RNA virus genome replication[J]. J Virol,2003, 77(15): 8181-8186.
[17]Barton D J, Sawicki S G, Sawicki D L. Solubilization and immunoprecipitation of alphavirus replication omplexes[J]. J Virol, 1991, 65(3): 1496-1506.
