猪源TTV Taqman实时荧光定量PCR检测方法的建立和应用
2011-06-08侯军委周艳君王礞礞李国新童光志
侯军委,周艳君,王礞礞,李国新,于 海,童光志
(中国农业科学院上海兽医研究所,上海 200241)
TTV(Torque teno virus,TTV)又称输血传播病毒(Transfusion Transimitted Virus),该病毒最初是由日本学者Nishizawa等采用代表性差异分析法从一名输血后发生急性感染的非甲~戊型肝炎患者血清中发现的[1]。此后,很多国家对本国不同人群中TTV感染进行了流行病学调查,发现人群的TTV DNA阳性率一般在10%以上[2]。随后发现该病毒在自然界各种动物中存在广泛,能感染人类、灵长类和家养动物包括猪、鸡、牛、羊、猫和狗[3]。
TTV是一种无囊膜的单股负链环状DNA病毒,目前,该病毒被归为圆环病毒科,指环病毒属[4]。感染不同动物的TTV基因组长度也不同,感染人和猿的TTV基因组长度为3.7~3.9 kb,感染猪和狗的TTV基因组长度分别为2.8 kb和2.9 kb左右,而在猫体内获得的TTV其基因组长度则约为2.1 kb[5]。目前对于TTV的编码基因尚未完全确定,有人认为TTV含有4个放阅读框(ORF1~ORF4)[6],也有人认为含有6个开放阅读框(ORF1~ORF6)[7]。
已知感染猪的TTV共两种基因型,即TTV1和TTV2[8]。有学者对西班牙猪群感染TTV的情况进行了回溯性调查,发现从1985年到2005年的所有年份均检出TTV,母猪和肉猪中,TTV1感染率分别为34.2%和30.9%,TTV2感染率分别为46.6%和62.8%,TTV1和TTV2共感染则分别为19.8%和24.5%[9]。有报道证实,欧洲野猪群中TTV感染的总阳性率为84%,其中TTV1和TTV2阳性率分别为58%和66%[10]。目前,应用于猪源TTV检测的方法仍然以常规PCR为主,但常常敏感性不够;套式PCR虽然敏感性更高,但容易出现假阳性。近年来实时荧光定量PCR技术以其特异性强、灵敏度高、重复性好、快速高效等特点在病原检测以及基因表达水平分析等方面得到了广泛应用。本研究旨在建立针对猪源TTV1和TTV2的实时荧光定量PCR检测方法,为病毒检测以及病毒在体内复制等领域的研究提供快速、简便和可靠的技术工具。
1 材料与方法
1.1 病料与核酸样品 检测病料来自内蒙古和广西的某猪场;带有TTV1和TTV2全长的质粒Psk-TTV1和Psk-TTV2由本实验室构建;猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)、 猪 瘟 病 毒(Classical swine fever virus, CSFV)、猪2型圆环病毒(Porcine circovirus type 2, PCV2)、 猪 流 感 病 毒(Swine influenza virus,SIV)由本实验室提供。
1.2 试剂和仪器 Ex Taq DNA聚合酶、Hot Start Ex Taq、dNTP、DNA Marker、pMD18-T载体等均购自大连宝生物有限公司;质粒提取试剂盒、胶回收试剂盒和基因组DNA提取试剂盒均购自上海华舜生物技术有限公司;大肠杆菌DH5α由本实验室保存。主要仪器有Mastercycler ep realplex荧光定量PCR仪(Eppendorf公司)。
1.3 引物和探针 应用MegAlign软件对本实验室分离的毒株及GenBank数据库中的TTV1和TTV2全长核苷酸序列分别进行同源性分析,利用Primer Express 3.0软件分别在TTV1和TTV2的UTR高度保守区域设计并合成一对特异性引物和TaqMan荧光探针。探针的5'端标记的荧光报告基团是FAM,3'端标记的荧光淬灭基团为BHQ。TTV1的引物序 列 为QF1:5'- TCCGAATGGCTGAGTTTATGC-3',QR1:5'- CCGCCCAGTCGCTAGACA-3',TTV1的 TaqMan探 针 序 列 为:FAM1-CCAGCGGTAGACAGAA ,BHQ1, 扩 增 片 段长度为58 bp;TTV2的引物序列为QF2:5'-TTTATGCCGCTGGTGGTAGAC -3',QR2:5'-CCCCTTGACTCCGCTCTCA -3',TTV2的 TaqMan探针序列为:FAM2- AACAGAGCTGAGTGTCTAA,BHQ2,扩增片段长度为86 bp。另外,针对TTV1和TTV2的UTR保守区域分别设计了一对常规PCR引物用于制备阳性标准品, 其中,TTV1的引物序列 为 PF1:5'-GCAGTTCCGAATGGCT -3',PR1:5'-CTTCATGTAGGCCCTC -3'; TTV2的引物序列为 PF2:5'- AGACGAATGGCTGAGTT -3',PR2:5'-GGGCCCGGTTCCGCTGG -3'。 引 物 由 Invitrogen公司合成,探针由上海基康生物技术有限公司合成。
1.4 病毒基因组DNA的提取 按照Tissue/Cell gDNA Mini Kit试剂盒说明书提取病料组织中的病毒基因组DNA。
1.5 阳性标准模板的制备 以PF1和PR1为引物,扩增Psk-TTV1的UTR保守序列区;以PF2 和PR2为引物,扩增Psk-TTV2的UTR保守序列区。二者反应条件相同:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min。反应结束后,取5μL PCR产物在1%琼脂糖凝胶上电泳检测扩增结果。回收纯化目的片段,分别与pMD18-T载体连接,转化至DH5α大肠埃希氏菌中,提取质粒进行PCR鉴定和序列测定,挑选测序结果正确的质粒并测定其浓度,获得pMD18-TTV1和pMD18-TTV2质粒作为阳性标准品模板,根据公式计算出质粒标准品的拷贝数。
1.6 标准曲线的绘制 用DEPC水对阳性标准质粒进行10倍系列稀释,TTV1取6个稀释度作为标准模板,TTV2取9个稀释度作为标准模板,分别优化引物和探针的反应浓度、Tm值及反应时间,进行荧光定量RT-PCR反应 ,计算Ct值并绘制标准曲线。
1.7 特异性试验 应用建立起来的两种荧光定量PCR检测方法分别对本实验室构建的TTV1全长(TTV1-FJ2) 和 TTV2全 长(TTV2-GD9) 及CSFV、 PCV2、PRRSV、SIV 进行特异性试验。
1.8 敏感性试验 用100copies /uL ~107copies /μL阳性标准品做荧光定量PCR,进行敏感性试验。1.9 重复性试验 取3份病毒含量不同的样品进行批间重复性试验和批内重复性试验。
1.10 病料的的检测 应用建立起来的TaqMan实时荧光定量PCR鉴别TTV1和TTV2的检测方法,检测采集自内蒙古、广西等地猪场猪只的组织脏器、全血样品共计44份,对结果进行统计学分析。
2 结果
2.1 标准曲线的建立 将pMD18-TTV1质粒经10倍系列稀释至1.88×101~1.88×106copies/μL共6个浓度作为标准品,每个浓度的标准品做3个重复;将pMD18-TTV2质粒经10倍系列稀释至8.12×102~8.12×109copies/μ L共8个浓度作为标准品分别进行实时荧光定量PCR反应。二者反应体系均为 25μL,包括 10×Ex Taq Buffer(Mg2+Plus)2.5μL,dNTP mix(各 2.5 mmol/L)2.5μL ;上、下游引物(10 pmol/ L)各 1 μL ,探针(10 pmol/L)0.5 μ L ;Ex Taq SH (5 U/μL )0.2 μL , 模板 (质粒或 cDNA)5 μL ,DEPC 水 12.3 μL 。二者反应条件一致:95 ℃变性 2 min,以 95 ℃变性 15 s,55 ℃ 退火 15 s ,68 ℃ 延伸 20 s,扩增 45 个循环,在 68 ℃进行单点荧光检测。结果TTV1和TTV2的各浓度均有很好的线性关系,阴性对照无扩增反应,其中,TTV1得到标准曲线方程为 y=-3.313×LOG(X)+46.75,相关系数R2=0.984;扩增效率E=1.00,见图 1(A和B);TTV2得到标准曲线方程为 y=-3.449×LOG(X)+50.16,相关系数R2=0.995;扩增效率E=0.95,见图 2(A和B)。

图1 实时荧光定量PCR检测猪源TTV1的动力学曲线(A)和标准曲线(B)Fig.1 Amplification plots (A)and standard curve (B)of real-time fluorescent quantitative PCR for TTV1

图2 实时荧光定量PCR检测猪源TTV2的动力学曲线(A)和标准曲线(B)Fig.2 Amplification plots (A)and standard curve (B)of real-time fluorescent quantitative PCR for TTV2
2.2 特异性试验结果 以对照病毒PRRSV、CSFV、PCV2、SIV和带有TTV全长的质粒TTV1-FJ2、TTV2-GD9为模板用建立起来的两种荧光定量PCR做检测,结果显示,针对TTV1的检测方法检测PRRSV、CSFV、PCV2、SIV和TTV2-GD9为阴性,检测TTV1-FJ2为阳性(图3);针对TTV2的检测方法检测PRRSV、CSFV、PCV2、SIV和TTV1-FJ2为阴性,检测TTV2-GD9为阳性(图4),说明本方法具有很好的特异性。

图3 TTV1荧光定量PCR特异性试验结果Fig.3 Specificity test of the real-time fluorescent quantitative PCR for TTV1
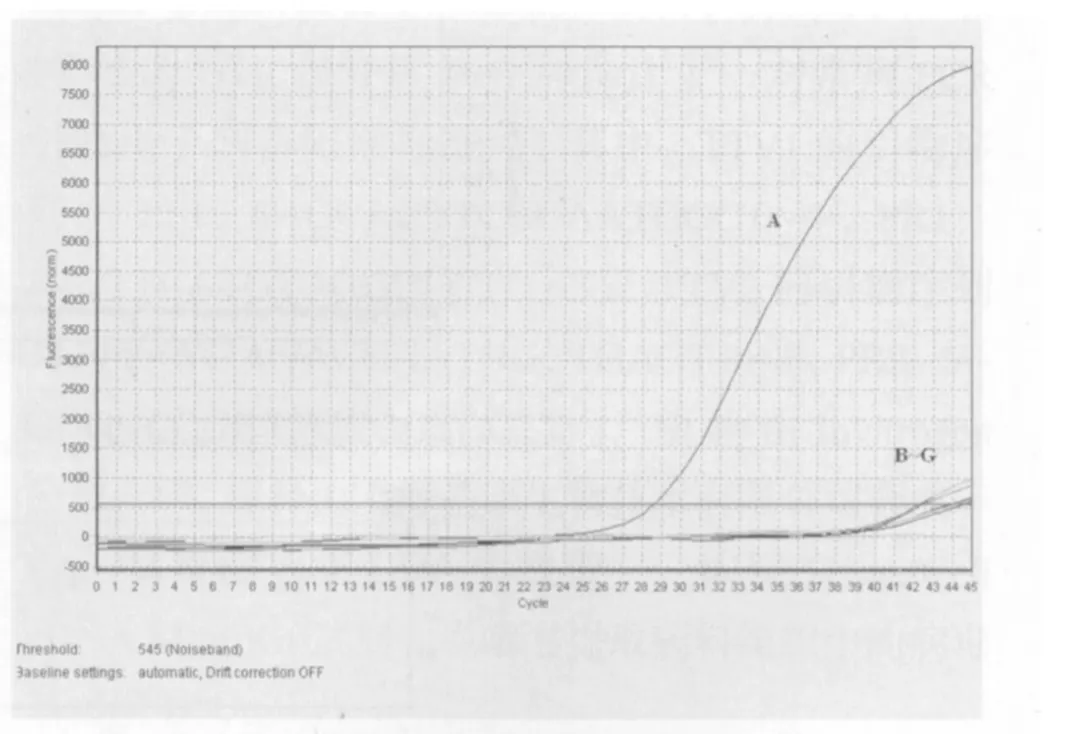
图4 TTV2荧光定量PCR特异性试验结果Fig. 4 Specificity test of the real-time fluorescent quantitative PCR for TTV2
2.3 敏感性试验结果 将pMD18-TTV1和pMD18-TTV2阳性质粒按照109-100分别倍比稀释作为模板,进行TaqMan实时荧光定量PCR检测,两种检测方法的最低检出量均为10 copies/μL(表1)。

表1 Taqman 实时荧光定量PCR的敏感性实验结果Table 1 Sensitivity analysis of the Taqman real-time fl uorescentquantitative PCR
2.4 重复性试验结果 对含量不同的TTV1和TTV2病毒感染样品各3份分别做5个批内重复和批间重复,变异系数均小于3%,表明该方法重复性良好(见表2和表3)。

表2 实时荧光定量PCR检测TTV1批内及批间重复试验结果Table 2 Intra- and inter-batch reproducibility of real-time fl uorescent quantitative PCR assay for TTV1

表3 实时荧光定量PCR检测TTV2批内及批间重复试验结果Table 3 Intra- and inter-batch reproducibility of real-time fl uorescent quantitative PCR assay for TTV2
2.5 样品检测结果 应用建立起来的TaqMan实时荧光定量PCR鉴别TTV1和TTV2的检测方法,检测采集自内蒙古、广西等地猪场猪只的组织脏器、全血样品共计44份,结果显示21份样品TTV1阳性(47.73%),31份样品TTV2阳性(70.45%),14份样品二者均阳性(41.82%),6份样品二者均阴性(13.64%)(表4)。
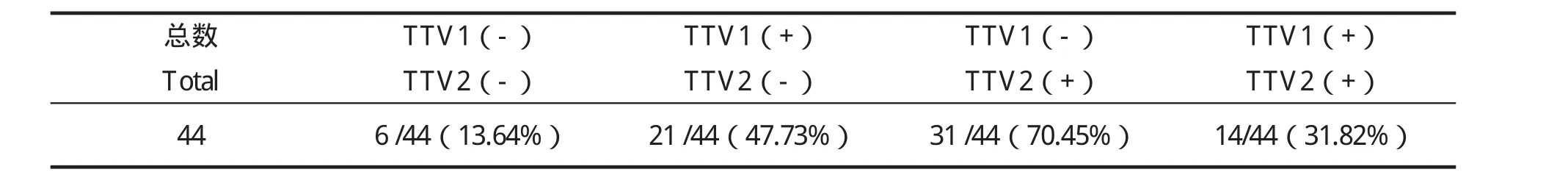
表4 应用荧光定量PCR检测猪组织和血液样品中TTV的结果Table 4 Detection result of samples with real-time fl uorescent quantitative PCR for TTV1 and TTV2
3 讨论
TTV虽然在猪中广泛存在,却被认为是没有致病性的孤儿病毒[14]。通过PCR对猪的组织样品进行检测,发现其DNA主要存在于肺、淋巴结、扁桃体和回肠中[15]。王礞礞等[16]首次对2008~2009年采集自国内7个省份的258份组织样品进行了TTV感染情况调查,结果证实在我国的猪群中也存在TTV的感染,其中TTV1感染的阳性率为37.6%,TTV2感染阳性率为82.6%,TTV1和TTV2的共感染率为38.4%。Kekarainen等[17]在检测猪血清中发现TTV的出现和PCV2的流行具有一定的相关性,在断奶仔猪多系统衰竭综合征(PMWS)感染的猪中,TTV的感染率为97%,在没有PMWS感染的猪中TTV的感染率为78%。研究表明PCV2是一种可以和猪共存时间较长的一种病毒,是PMWS的主要诱因之一[18]。王礞礞等[19]对国内猪群中TTV与PCV2共感染的流行病学调查显示,PCV2和TTV1共感染率为36.4%, PCV2与TTV2共感染率为74.8%。
目前,检测猪源TTV的方法主要有普通PCR[17]、套式PCR[20]、半套式PCR[21]和滚环扩增[22]等方法。普通PCR敏感性较差且不能定量,套式PCR、半套式PCR和滚环扩增耗时较长,而荧光定量PCR检测方法不仅可以克服上述缺点,而且还可以应用于病毒的复制等领域的研究。
本研究建立的针对猪源TTV1和TTV2的两种Taqman 实时荧光定量PCR方法,通过特异性、敏感性和重复性试验验证,结果表明,这两种方法均具有较高的灵敏性,最低可检测到10 copies/μL的阳性标准品;特异性强,对TTV1和TTV2检测结果为阳性,但对PRRSV、CSFV、PCV2、SIV的检测结果均为阴性;重复性好,对分别含有TTV1和TTV2的各3份病毒样品进行5个批内重复和批间重复,变异系数均小于3%。Taqman 实时荧光定量PCR与SYBR Green PCR和常规PCR相比,具有更好的特异性和灵敏性,可以用于猪源TTV的定性和定量检测,实时了解样品中的病毒含量,在猪源TTV的诊断中具有一定的实用价值。
[1]Nishizawa T, Okamoto H, Konishi K, et al. A novel DNA virus (TTV)associated with elevated transaminase levels in posttransfusion hepatitis of unknown etiology [J]. Biochem Biophys Res Commun, 1997, 241(1): 92-97.
[2]庄辉. TT病毒的研究现状及展望[J]. 中华内科杂志,1999, 38(11): 727-728.
[3]Kekarainen T, S Lopez-Soria, J Segales. Detection of swine Torque teno virus genogroups 1 and 2 in boar sera and semen [J]. Theriogenology, 2007, 68(7): 71-966.
[4]Biagini P, de Micco P, de Lamballerie X. Identification of a third member of the Anellovirus genus ("small anellovirus')in French blood donors [J]. Arch Virol, 2006, 151(2): 405-408.
[5]Okamoto H, Takahashi M, Nishizawa T, et al. Genomic characterization of TT viruses (TTVs)in pigs, cats and dogs and their relatedness with species-specific TTVs in primates and tupaias [J]. J Gen Virol, 2002, 83(6): 1291-1297.
[6]Okamoto H, Nishizawa T, Kato N, et al. Molecular cloning and characterization of a noval DNA virus (TTV)associated with posttransfusion hepatitis of unknown etiology [J]. Hepatol Res, 1998, 10(1): 1-16.
[7]Yokoyama H, Yassuda J, Okamoto H, et al. Pathological changes of renal epithelial cells in mice transgenic for the TT virus ORF1 gene [J]. J Gen Virol, 2002, 83 (1): 141-150.
[8]Niel C, Diniz-Mendes L, Devalle S. Rolling-circle amplification of Torque teno virus (TTV)complete genomes from human and swine sera and identification of a novel swine TTV genogroup[J]. J Gen Virol, 2005, 86(5):1343-1347.
[9]Segales J, Martinez-Guino L, Cortey M, et al. Retrospective study on swine Torque teno virus genogroups 1 and 2 infection from 1985 to 2005 in Spain [J]. Vet Microbiol,2009, 134(3-4): 199-207.
[10]Martinez L, Kekarainen T, Sibila M, et al. Torque Teno virus(TTV)is highly prevalent in the European wild boar(Sus scrof a)[J]. Vet Microbiol, 2006, 118 (324):223-229.
[11]Hoffmann B, Beer M, Reid S M, et al. A review of RTPCR technologies used in veterinary virology and disease control: sensitive and specific diagnosis of five livestock diseases notifiable to the World Organisation for Animal Health[J].Vet Microbiol, 2009,139(9): 123.
[12]Espy M J, Uhl J R, Sloan L M, et al. Real-time PCR in clinical microbiology: applications for routine laboratory testing[J]. J Clin Microbiol, 2006, 19(1): 165-256.
[13]Ohga S, Nomura A, Takada H, et al. Epstein-Barr virus(EBV)load and cytokine gene expression in activated T cells of chronic active EBV infection [J]. J Infect Dis, 2001,183(9): 1-7.
[14]McKeownN E, Fen auxlu, mengxJ et al. Molecular characterization of porcine TT virus, an orphan virus, in pigs from six different countries [J]. Vet Microbiol, 2004,104(1-2): 113-117.
[15]Bigarre L, Beven V, de Boiss é son C, et al. Pig anelloviruses are highly prevalent in swine herds in France [J]. J Gen Virol, 2005, 86(3): 631-635.
[16]王礞礞, 周艳君, 童光志, 等. 我国猪群中TTV的鉴定及其分子流行病学分析[J]. 中国预防兽医学报, 2009,31(10): 751-755.
[17]Kekarainen T, Segales J. Torque teno virus infection in the pig and its potential role as a model of human infection [J]. Vet J, 2009, 180(2): 163-168.
[18]Finsterbusch T, Mankertz A. Porcine circoviruses--small but powerful [J]. Virus Res, 2009, 143(2): 177-183.
[19]王礞礞, 周艳君, 童光志, 等. 猪圆环病毒2型与猪TTV混合感染的流行病学调查[J]. 中国动物传染病学报, 2010, 18(1): 75-78.
[20]Kekarainen T, Sibila M , Segales J. Prevalence of swine torque teno virus in post-weaning multi-systemic wasting syndrome (PMWS)-affected and non-PMWS-affected pigs in Spain [J]. J Gen Virol, 2006, 87: 833-837.
[21]Segales J, Martinez G L, Cortey M, et al. Retrospective study on swine torque teno virus genogroups 1 and 2 infection from 1985 to 2005 in Spain [J]. Vet Microbiol,2009, 134(3-4): 199-207.
[22]Niel C, Diniz-Mendes L, Devalle S. Rolling-circle amplification of Torque teno virus (TTV)complete genomes from human and swine sera and identification of a novel swine TTV genogroup [J]. J Gen Virol, 2005, 86:1343-1347.
