F,Cl,OH取代烷烃能量及轨道系数的理论研究
2011-06-06姚树文侯振雨崔乘幸
姚树文,侯振雨,崔乘幸
(河南科技学院,河南新乡453003)
计算化学是理论化学的一个分支,其主要作用在于利用有效的数学近似以及电脑程序计算分子的性质(总能量、偶极矩、四极矩、振动频率、反应活性等)并用以解释一些具体的化学问题.理论上讲,对任何分子都可以采用相当精确的理论方法进行计算.但是由于这些方法的计算量随电子数的增加成指数或更快的速度增加,所以他们只能用于很小的分子,对更大的体系,往往需要采取一些近似的方法,以在计算量和结果的精确度之间寻求平衡[1-3].分子轨道(molecular orbital,MO)是分子轨道理论的一个核心概念,指电子在分子中的运动区域[4],该概念首先由弗里德里希·洪德和罗伯特·桑德森·马利肯在1927~1928年引入[5-6].电子在分子中的空间运动状态可以用分子轨道波函数(ψ,薛定谔方程的数学解)描述,借助Hartree-Fock方程或自洽场方法可对其作定量近似.定性上看,分子轨道由原子轨道线性组合(LCAO-MO法)获得,组合后的分子轨道数目与组合前的原子轨道数目相等[7].本文采用量化软件Gaussian 03对F,Cl,OH取代烷烃进行了研究,得到了此三类杂原子对烷烃能量及分子轨道系数的影响趋势.
1 实验部分
(1)利用Gaussian程序中的Hartree-Fock方法,6-31G基组来计算;
(2)用Gaussianview软件分别构建1~10个碳的烷烃,1,1-氟代烷,1,1-氯代烷,伯醇的分子模型并进行计算;
(3)利用Excel软件计算分别计算1~10个碳的烷烃,1,1-氟代烷,1,1-氯代烷,伯醇的轨道参数,并且通过作图分析这些参数的稳定性.
2 实验结果
依据上述实验过程,对所得的实验结果进行分析.
2.1 氟代烷烃、氯代烷烃和羟基取代烷烃HF能量变化
2.1.1 烷烃的HF能量变化 由表1可知烷烃随着碳原子数目的增多,能量逐渐减小;能量差先减小再增大,1个碳和2个碳的能量差较大,3个碳的与两个碳的能量差骤减.随着碳链的增长,能量差又逐渐增大,4个碳时能量趋于平衡,能量差变化不是太大,趋于一个固定值.
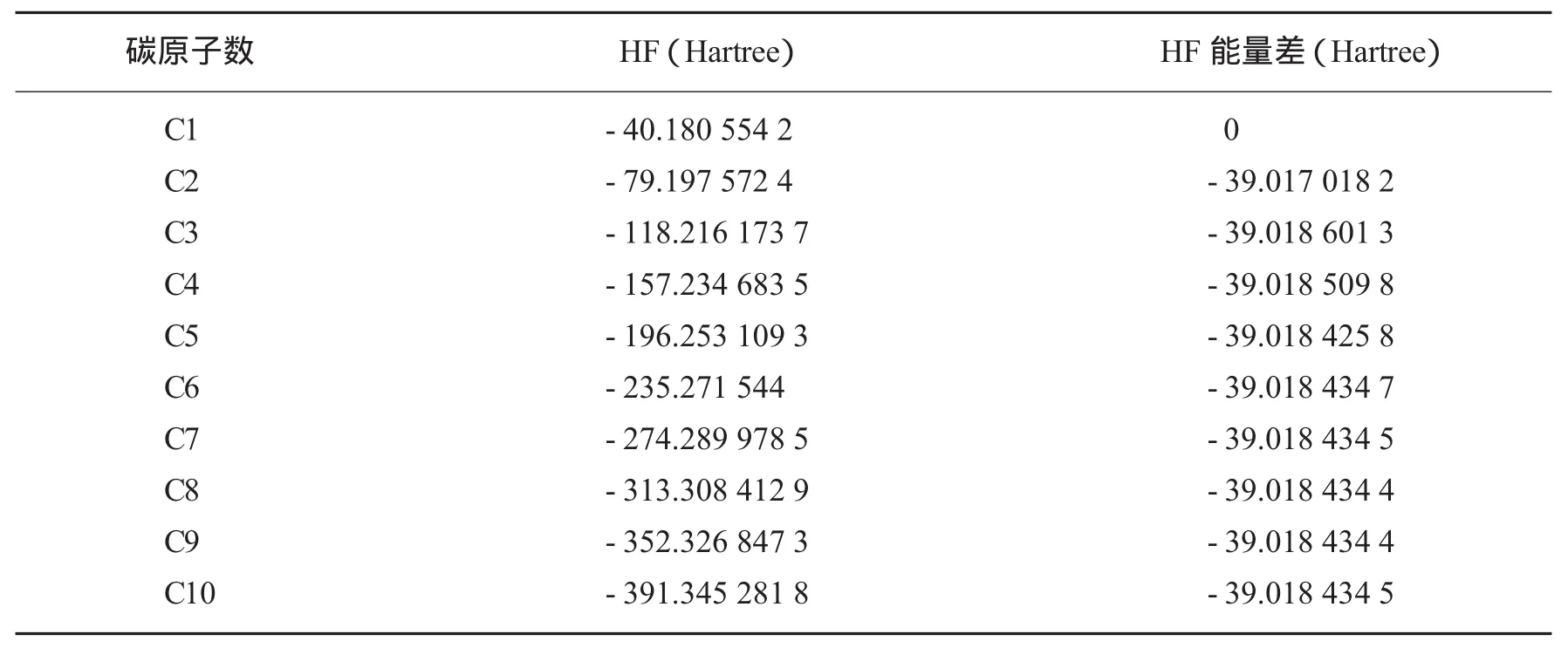
表1 烷烃随碳原子增多能量变化规律
2.1.2 氟代烷烃的HF能量变化 由表2可知随着碳链的增长,烷烃端基碳上1个氢被F取代后,即1,1-氟代烷的能量逐渐减小;1,1-氟代烷能量差逐渐增大.其中1个碳与2个碳时能量差比较小,随着碳链的增长,能量差逐渐增大,4个碳时能量差变化很小.

表2 1,1-氟代烷随碳原子增多能量变化规律
2.1.3 氯代烷烃的HF能量变化 由表3可知随着碳链的增长,烷烃端基碳上1个氢被Cl取代后,即1,1-氯代烷的能量逐渐减小;1,1-氯代烷能量差逐渐增大.其中1个碳与2个碳时能量差比较小,随着碳链的增长,能量差逐渐增大,4个碳时能量趋于平衡,能量差变化不是太大,趋于一个固定值.

表3 烷烃上1个氢被Cl取代后Cl的HF能量变化规律
2.1.4 羟基取代烷烃的HF能量变化 由表4可知随着碳链的增长,烷烃端基碳上1个氢被OH取代后,即伯醇的能量逐渐减小;伯醇能量差逐渐增大.其中1个碳与2个碳时能量差比较小,随着碳链的增长,能量差逐渐增大,4个碳时能量趋于平衡,能量差变化不是太大,趋于水平.

表4 烷烃上1个氢被OH取代后O的HF能量变化规律
2.2 氟代烷烃、氯代烷烃和羟基取代烷烃的F、Cl、O轨道参数稳定性
2.2.1 氟代烷烃中F的占有轨道参数变化 由图1所示可知,1,1-氟代烷中F占有轨道的轨道系数平方和随着碳原子数目的增多而逐渐增大,5个碳时,能量平方和渐渐地趋于稳定.由图2所示可知,F的占有轨道系数平方除以能量的总和随着碳原子数目的增多而逐渐减小,5个碳以后变化较小.

图1 1,1-氟代烷中F占有轨道系数平方和
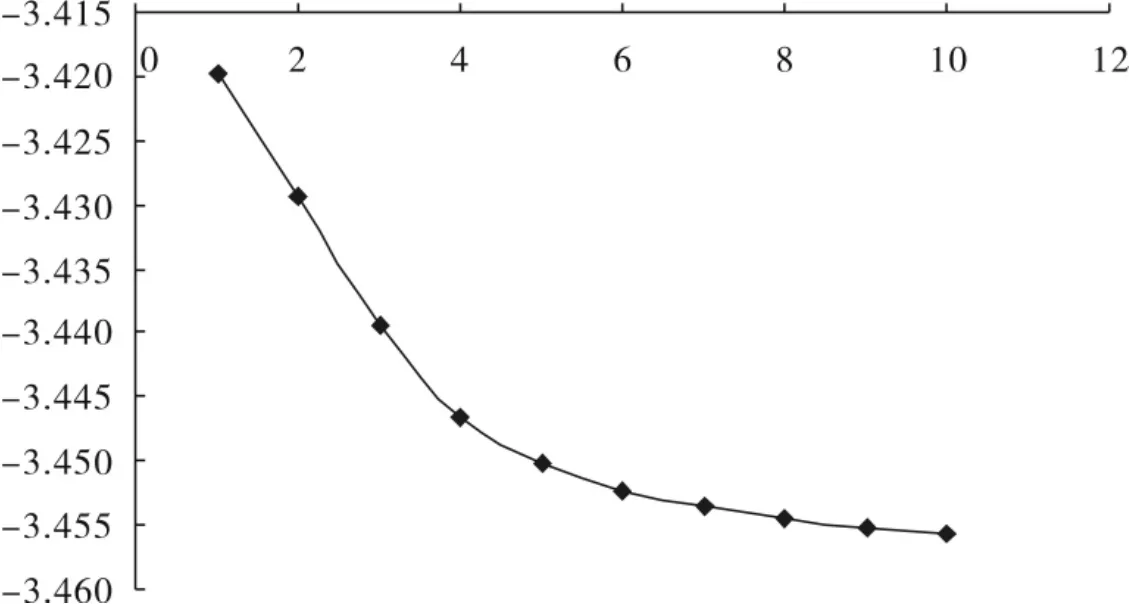
图2 1,1-氟代烷中F占有轨道系数平方和除以对应能量总和
2.2.2 氯代烷烃中Cl的占有轨道参数变化 由图3所示可知,1,1-氯代烷中F占有轨道的轨道系数平方和随着碳原子数目的增多而逐渐增大,5个碳时能量平方和渐渐地趋于稳定.由图4所示可知,Cl的占有轨道系数平方除以能量的总和随着碳原子数目的增多而逐渐增大,第2个碳以后逐渐减小,但是变化不是太大.

图3 1,1-氯代烷中Cl占有轨道系数平方和

图4 1,1-氯代烷占有轨道系数平方和除以对应能量总和
2.2.3 羟基取代烷烃中O的占有轨道参数变化 由图5所示可知,伯醇中O占有轨道的轨道系数平方和随着碳原子数目的增多而逐渐增大,4个碳时能量平方和渐渐趋于一个稳定值.由图6所示可知,O的占有轨道系数平方和除以对应能量的总和值随着碳原子数目的增多而逐渐减小.

图5 伯醇中O占有轨道系数平方和
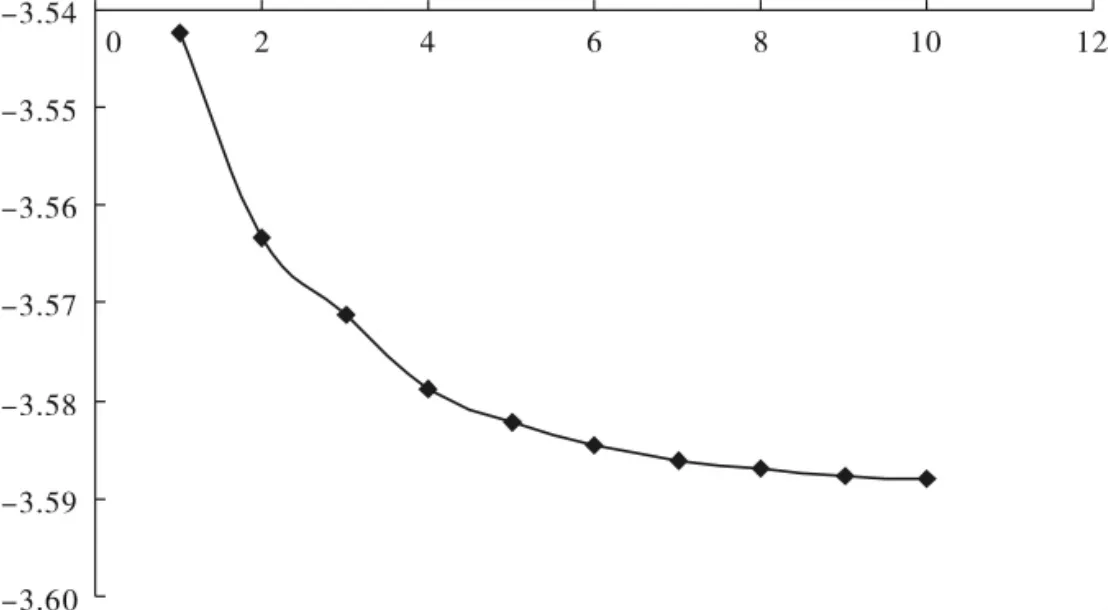
图6 伯醇中O的占有轨道系数平方和除以对应能量总和
3 结论
随着碳链增长烷烃的能量及烷烃端基的1个氢被F、Cl、OH取代的能量逐渐减小.烷烃随着碳原子数目的增多HF能量差逐渐减小.其中前2个碳的能量差较大,3个碳的与2个碳的能量差骤减,随着碳链的增长,能量差又逐渐增大,4个碳时能量趋于平衡,能量差变化不是太大,趋于一个固定值.烷烃端基碳上1个氢被F、Cl取代后与同碳原子的烷烃相比能量逐渐较小.能量差与烷烃的能量差变化不同,被取代后的能量差都是逐渐增大,在4个碳时变化不是太大,趋于一个固定值.伯醇的能量与同碳原子数目的烷烃相比较,能量逐渐减小,但是没有被F、Cl取代时的能量减小的多.能量差与被F、Cl取代时规律相同,都是逐渐增大,4个碳时趋于平衡.随着碳链增长烷烃端基碳上的1个氢被F、Cl、OH取代的F、Cl、O所有占有轨道系数平方和逐渐增大,一般在4个碳时能量平方和渐渐趋于稳定.占有轨道系数平方除以对应能量总和随碳原子数目的增多都是逐渐减小.
[1]徐昕,王南钦,吕鑫,等.量子化学的研究现状、发展趋势与展望[J].化学进展,1996(1):30-42.
[2]刘靖疆.基础量子化学与应用[M].北京:高等教育出版社,2004.
[3]陈颖健.密度泛函理论和量子化学计算[J].国外科技动态,1999(1):11-14.
[4]Daintith J.Oxford dictionaryofchemistry[M].NewYork:Oxford universitypress,2004.
[5]黄素芳.自洽场分子轨道理论[J].重庆科技学院学报:自然科学版,2010,12(3):186-188.
[6]Robert S.Mulliken's nobel lecture[J].Science,1967,157:13-24.
[7]姚树文,侯振雨,崔乘幸.Aln(n=2~22)团簇构型研究[J].河南科技学院学报:自然科学版,2011,39(1):72-77.
