p53蛋白在UVB诱导凋亡的富集表皮干细胞的角质形成细胞中的表达
2011-06-01梅雪岭
梅雪岭,连 石
• 论 著 •
p53蛋白在UVB诱导凋亡的富集表皮干细胞的角质形成细胞中的表达
梅雪岭,连 石
目的 研究p53蛋白在中波紫外线(ultraviolet light B,UVB)诱导凋亡的富集表皮干细胞的角质形成细胞群中的表达情况。方法 分离富集人表皮干细胞的角质形成细胞群和正常角质形成细胞群,使用UVB诱导两种细胞群凋亡,蛋白印迹法比较不同剂量UVB诱导前后两组细胞的p53蛋白表达的差异。结果 两种细胞在不同剂量的UVB照射后p53蛋白表达均比照射前显著增加,在20mJ/cm2与40mJ/cm2照射剂量时,富集人表皮干细胞的角质形成细胞群p53蛋白表达高于正常角质形成的细胞群,差异有统计学意义(P<0.05)。结论 富集人表皮干细胞的角质形成细胞p53蛋白表达比其它角质形成细胞对中波紫外线的照射易感。
p53蛋白;干细胞;凋亡;皮肤癌
人类表皮干细胞于1970年被发现,其主要的生物学功能是维持表皮的自然更替和创伤后的愈合[1]。表皮干细胞的研究前景广阔,目前利用表皮干细胞体外扩增制备的人工表皮已经用于临床烧伤的治疗。探讨表皮干细胞与皮肤癌的关系是研究的另一备受关注的方向,人们希望这是探寻皮肤癌防治的一条道路[2]。前期研究表明,表皮干细胞的凋亡与皮肤癌之间存在一定联系[3]。有研究显示p53蛋白通过调控细胞内的信号转导途径而参与了调控细胞的凋亡反应,是细胞凋亡反应中的关键蛋白[4,5]。同时p53蛋白还是一种抑癌因子,50%皮肤鳞状细胞癌存在p53蛋白基因的突变[6]。目前关于p53蛋白在表皮干细胞凋亡过程中的表达情况尚未有研究[7-9]。因此我们研究窄谱中波紫外线(UVB)诱导下的表皮干细胞的凋亡反应中p53蛋白的表达情况并分析其表达特征与表皮干细胞凋亡反应的关系。
1 材料和方法
1.1 材料和试剂
正常人皮肤标本来源于包皮环切术的患者(年龄≤20岁)(标本使用经本院伦理委员会批准)。中性蛋白酶II(2.4 U/ ml;罗氏,德国),胰蛋白酶/EDTA (Cascade Biologics,美国),蛋白酶抑制剂(Cascade
1.2 方法
1.2.1 富集人表皮干细胞的角质形成细胞群以及正常原代角质形成细胞的分离和培养 依据传统制备原代角质形成细胞的方法分离人原代角质形成细胞群[3],将皮肤标本置于中性蛋白酶II中,4℃过夜使表皮与真皮分离。将表皮片置于胰蛋白酶/EDTA中,37℃作用30 min,以蛋白酶抑制剂终止反应,加入EpiLife培养基制备成人正常原代角质形成细胞的单细胞悬液。将单细胞悬液种于培养板内培养正常原代角质形成细胞(normal primary keratinocytes,KC)。利用快速粘附IV型胶原法制备富集人表皮干细胞的角质形成细胞(keratinocytes adherent to collagen type IV,AC)[3]。即将人的原代角质形成细胞的单细胞悬液种于用20 μg/ml IV型胶原包被的24孔培养板内,置于37℃培养箱内孵育20min。之后,用培养基清洗培养板2次,将培养板内没有粘附的细胞全部去掉,剩余的即为快速粘附IV型胶原的角质形成细胞。将两种细胞群置于相同的条件下培养,EpiLife培养基,5% CO2培养箱,37℃培养24h后进行UVB照射。
1.2.2 UVB照射 用磷酸缓冲液清洗所培养的细胞两次,细胞表面只保留少量磷酸缓冲液。用UVB (UV236B Waldmann,德国,波长285~320 nm,峰值312 nm)于25℃室温下照射细胞。辐射能量分为0、20、40和80 mJ/cm2。将照射后的细胞置于无生长因子的EpiLife培养基中继续培养8h后,用于实验。
1.2.3 蛋白印迹 将细胞置于混有蛋白酶抑制剂的裂解液中裂解15 min。按照蛋白定量试剂盒使用说明操作,测定蛋白浓度。每孔内加入相等量的蛋白并通过15% SDS-PAGE凝胶在60mA毫安下电泳90 min。将蛋白转移至硝酸纤维素膜上。加一抗鼠抗人p53单克隆抗体4℃过夜,加二抗抗鼠HRP抗体室温作用 1h。使用ECL化学发光显色液显色照相并用凝胶成像扫描系统分析荧光强度。荧光强度值即代表蛋白样品的相对含量,取其与Actin的光密度比值进行分析。
1.3 统计学分析
2 结果
接受不同剂量(0,20, 40, 80 mJ/cm2)UVB照射后8小时,两种细胞群的p53蛋白表达电泳见图1。两种细胞在20、40、80 mJ/cm2的UVB照射后,p53蛋白表达均比照射前(0 mJ/cm2)显著增加(P<0.05);KC接受照射后p53 蛋白表达随剂量增加而相应上升,而AC p53蛋白表达的峰值出现在40mJ/cm2剂量时,之后略有下降。两种细胞在0、20、40、80mJ/cm2照射剂量下,p53蛋白的光密度比值分别为AC:0.038 ±0.021、0.826 ±0.031、0.912±0.037、0.719±0.028;KC:0.008 ±0.020、0.326 ±0.030、0.701 ±0.022、0.812±0.032。其中20mJ/cm2与40mJ/cm2剂量照射后,AC细胞p53蛋白表达均高于KC,差异均有统计学差异(P<0.05)(图2)。
3 讨论
表皮是位于真皮外层的复层上皮,表皮的终末分化细胞不断脱落,并依赖其具有自我更新和产生子代细胞能力的干细胞替代。研究显示,正常细胞转变为癌细胞需要3~5个遗传事件,对于表皮细胞而言最具有积累损伤而形成癌细胞的可能性。因此,研究人员普遍认为表皮干细胞是致癌因素作用的靶细胞,也很可能是肿瘤基因治疗的靶点[2]。在之前的研究中,我们利用UVB诱导富集表皮干细胞的角质形成细胞的凋亡反应,发现UVB照射后表皮干细胞较其它角质形成细胞更易于凋亡。由于凋亡现象能够去除一部分DNA异常的细胞,因此研究结果提示我们表皮干细胞的一些生物学特性可能是人体防御皮肤癌的天然屏障,而此屏障的异常或许是皮肤癌发生的原因之一[3]。本研究中,我们继续深入研究之前的实验,检测UVB诱导的凋亡的表皮干细胞的p53蛋白的表达。利用快速粘附细胞外基质蛋白的方法分离富集人表皮干细胞的角质形成细胞群,同时制备正常人的原代角质形成细胞群,UVB诱导两种细胞群凋亡[3],检测两种细胞群p53蛋白的表达情况。
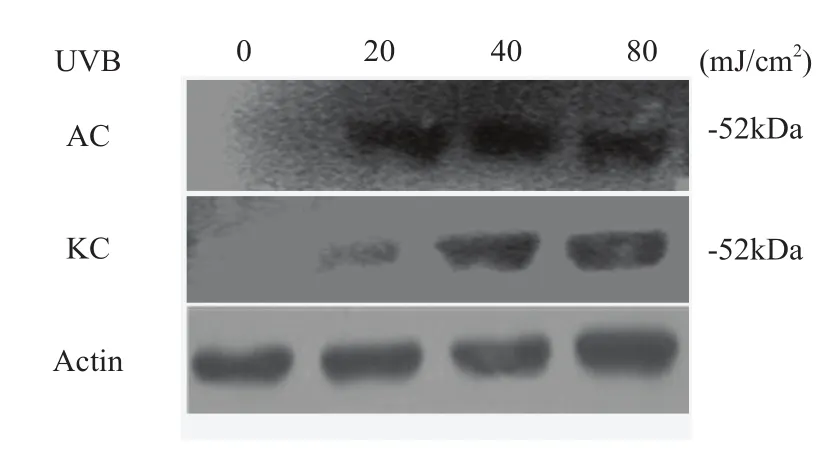
图1 不同剂量UVB 照射后AC和KC细胞p53蛋白电泳图

图2 不同剂量UVB 照射后AC和KC细胞p53蛋白表达量化图
研究发现,UVB照射后,正常角质形成细胞的p53蛋白的表达随照射剂量增加而逐渐升高,各照射组蛋白表达均显著高于未照射组,说明UVB能够显著刺激角质形成细胞p53蛋白的表达,且呈剂量依赖趋势。同时,UVB照射后富集表皮干细胞的角质形成细胞的p53表达亦显著增加,各照射剂量组细胞p53蛋白的表达均显著高于未照射组,40mJ/cm2照射剂量时为蛋白表达的峰值,80mJ/cm2照射剂量时蛋白表达则略低于40mJ/cm2组,说明UVB虽然能够显著刺激表皮干细胞中p53蛋白的增加,但高剂量的UVB却在一定程度上抑制了p53蛋白的表达。此外,研究结果还显示,20 mJ/cm2和40 mJ/cm2UVB照射后富集人表皮干细胞的角质形成细胞p53蛋白的表达显著高于正常角质形成细胞的p53蛋白表达,说明在20 mJ/cm2和40 mJ/cm2UVB照射剂量作用下,表皮干细胞中p53蛋白的活化表达强于其它角质形成细胞,即表皮干细胞内的p53蛋白对UVB较易感。之前的实验显示UVB照射后富集人表皮干细胞的角质形成细胞表现为凋亡易感,因此我们推断p53蛋白在表皮干细胞的凋亡易感性中可能发挥了重要作用。此结果不仅再次证实了p53蛋白在表皮细胞凋亡中的关键作用,更进一步深入阐明了表皮干细胞的生物学特性。另外我们还发现在80 mJ/cm2UVB剂量照射后富集人表皮干细胞的角质形成细胞p53蛋白的表达与正常角质形成细胞的p53蛋白表达没有显著差异,说明表皮干细胞中的p53蛋白对低剂量的UVB较敏感。我们推测其可能的原因是:UVB照射后,虽然表皮干细胞内的多种蛋白活化并参与了凋亡反应如p53,bcl-2,Bax等[10],但不同的蛋白可能对不同剂量的UVB敏感性不同,因此导致了细胞凋亡反应的差别。我们也将继续研究UVB诱导的表皮干细胞凋亡反应中其它相关蛋白的表达情况,从而更加了解表皮干细胞的生物学特性。
综上所述,本研究证实了p53蛋白在UVB诱导的凋亡的表皮干细胞中的活化,并且我们发现在低剂量的UVB诱导下,表皮干细胞的p53蛋白比其它角质形成细胞的p53蛋白更易活化。其结果为皮肤癌的成因与防治研究拓展了一条新思路。
[1] Watt FM, Jensen KB. Epidermal stem cell diversity and quiescence [J]. EMBO Mol Med, 2009, 1(5):260-267.
[2] Finlan LE, Hupp TR. Epidermal stem cells and cancer stem cells: insights into cancer and potential therapeutic strategies [J]. Eur J Cancer, 2006, 42(9):1283-1292.
[3] Mei XL, Lian S. Ultraviolet B light-induced apoptosis in human keratinocytes enriched with epidermal stem cells and normal keratinocytes [J]. Chin Med J(Engl), 2011, 124(4):591-598.
[4] Chaturvedi V, Qin JZ, Stennett L, et al. Resistance to UV-induced apoptosis in human keratinocytes during accelerated senescence is associated with functional inactivation of p53 [J]. J Cell Physiol, 2004, 198(1):100-109.
[5] Verschooten L, Declercq L, Garmyn M. Adaptive response of the skin to UVB damage: role of the p53 protein [J]. Int J Cosmet Sci, 2006, 28(1):1-7.
[6] Raj D, Brash DE, Grossman D. Keratinocyte apoptosis in epidermal development and disease [J]. J Invest Dermatol, 2006, 126(2):243-257.
[7] Van Laethem A, Garmyn M, Agostinis P. Starting and propagating apoptotic signals in UVB irradiated keratinocytes [J]. Photochem Photobiol Sci, 2009, 8(3):299-308.
[8] Latonen L, Laiho M. Cellular UV damage responses--functions of tumor suppressor p53 [J].Biochim Biophys Acta, 2005, 1755(2):71-89.
[9] Papoutsaki M, Moretti F, Lanza M, et al. A p38-dependent pathway regulates DeltaNp63 DNA binding to p53-dependent promoters in UV-induced apoptosis of keratinocytes [J]. Oncogene, 2005, 24(46):6970-6975.
[10] Decraene D, Agostinis P, Pupe A, et al.Acute response of human skin to solar radiation: regulation and function of the p53 protein [J]. J Photochem. Photobiol, 2001, 63 (1):78-83.
p53 expression in UVB-induced apoptotic human keratinocytes enriched with epidermal stem cells
MEI Xue-ling,LIAN Shi
Department of Dermatology, Beijing Friendship Hospital, Capital Medical University, Beijing 100052, China
Objective To investigate p53 expression in ultraviolet light B(UVB)-induced apoptotic human keratinocytes enriched with epidermal stem cells. Methods Keratinocytes enriched with epidermal stem cells and normal primary keratinocytes were isolated and induced apoptosis by UVB. The expression of p53 was investigated by Western blotting. Results UVB irradiation increased p53 expression of cells. Compared to normal primary keratinocytes, p53 expression of keratinocytes enriched with epidermal stem cells significantly increased at 20 and 40 mJ/cm2(P<0.05). Conclusion p53 expression of human epidermal stem cells are more susceptible than other keratinocytes.
p53 protein;Stem cells;Apoptosis;Skin Neoplasms [J Pract Dermatol, 2011, 4(4):197-199]
R318
A
1674-1293(2011)04-00197-03

梅雪岭
100052,首都医科大学附属北京友谊医院皮肤科(梅雪岭);首都医科大学北京宣武医院皮肤科(连石)
梅雪岭,博士,主治医师,研究方向: 皮肤病理与表皮干细胞研究,E-mail: dayoff@vip.sina.comBiologics,美国),EpiLife培养基(Cascade Biologics,美国),蛋白定量试剂盒(Bio-Rad Hercules,美国),鼠抗人p53单克隆抗体(Santa Cruz,美国)。
2011-09-14
2011-11-06)(本文编辑 祝贺)
