核转录因子E2F-1、P27在大肠癌中的表达及意义
2011-06-01杨建华周世广刘春海时志民孙冬霞
杨建华,王 蕾,周世广,刘春海,瞿 峰,时志民,孙冬霞
(1. 邯郸市中心医院 病理科, 河北 邯郸 056004;2. 河北工程大学医学院,河北 邯郸 056002)
近年来,许多研究认为肿瘤实际是一种细胞周期病,即细胞周期启动、运行和终止异常,细胞增殖过多,凋亡减少,肿瘤形成。在细胞周期中G1-S是控制细胞周期进程的最关键环节,因为在G1期中存在一限制点(restriction point,R点)。在R点之前,细胞周期的运行依赖于细胞外生长因子,而一旦细胞周期跨过R点,细胞周期即为一自主性的过程,不再依赖于外界生长因子,所以G1-S对于细胞周期的运行和完成是至关重要的[1-2]。其中,核转录因子E2F-1、P27对调节细胞由G1期进入S期起着至关重要的作用。本研究采用免疫组化SP法检测人大肠癌中E2F-1和P27的表达,探讨两者与大肠癌的临床病理关系。
1 材料和方法
1.1 组织标本
收集选取2006年1月-2010年12月在河北工程大学附属医院进行大肠癌根治性切除经病理确诊的大肠癌78例,所有病例根治性手术前均未行化疗或放疗。78例患者中,男53例,女25例;年龄39~79岁,平均(59.3±20.3)岁;淋巴结转移43例,无淋巴转移35例。按WHO分类标准(1996)进行组织学分级:高分化24例,中分化24例,低分化30例。所有病例根据国际抗癌联盟(UICC)1997年修订的TNM分期标准进行分期。同时取同期手术切除和结肠镜活检并经病理确诊的大肠腺瘤30例,另取癌旁10 cm以上正常大肠黏膜20例作为对照组。
1.2 方 法
试剂:兔抗人E2F-1多克隆抗体购自Santa Cruz Biotechnology,鼠抗人单克隆抗体P27和即用型S-P试剂盒均购自北京中杉金桥生物有限公司。
步骤:采用免疫组化SP法,玻片经多聚赖氨酸行防脱片处理,微波抗原修复。染色过程按试剂盒说明操作。
1.3 结果判断
切片免疫组化染色以已知阳性的肺癌为阳性对照,以PBS代替一抗为阴性对照。染色均以细胞内出现棕黄色颗粒为阳性细胞,两名病理医生在显微镜下计数10个高倍视野,按阳性细胞所占百分比并参考着色强度分级如下:(-):阳性细胞数<10%;(+):阳性细胞数10%~24%;(++):阳性细胞数25%以上。
1.4 统计学方法
使用SPSS16.0统计软件分析数据,各组间比较用χ2检验,应用非参数统计中Spearman等级相关对E2F-1和P27在大肠癌中表达的相互关系进行分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 E2F-1和P27在大肠癌中的表达
E2F-1和P27阳性物质分布于细胞核,见图1、2。大肠癌E2F-1阳性表达率明显高于正常大肠黏膜和大肠腺瘤(P<0.05),正常大肠黏膜和大肠腺瘤E2F-1阳性表达率差异无显著性意义(P>0.05);P27在正常大肠黏膜中的阳性表达率明显高于大肠腺瘤以及大肠癌,P27阳性表达在正常大肠黏膜、大肠腺瘤以及大肠癌之间差异具有显著性意义(P<0.05),见表1。
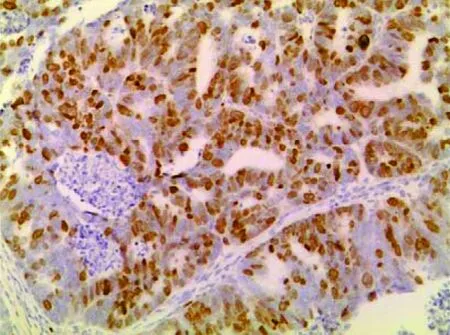
图1 大肠腺癌中E2F-1呈细胞核阳性表达 SP ×400
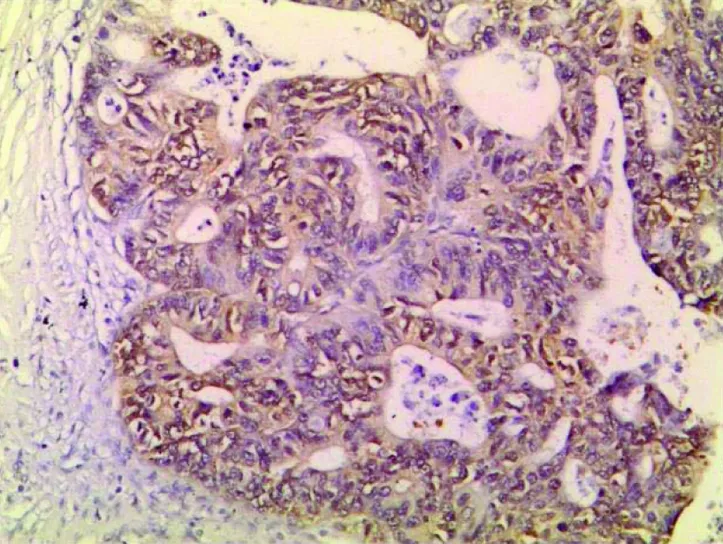
图2 大肠腺癌中P27呈细胞核阳性表达 SP ×400

表1 正常大肠黏膜、大肠腺瘤以及大肠癌中E2F-1、P27的表达
2.2 大肠癌组织中E2F-1和P27表达与临床病理指标之间的关系
在大肠癌组织中,E2F-1和P27的表达与患者的性别、年龄、大小无明显相关关系(P>0.05)。但E2F-1和P27表达与大肠癌的病理分化程度、临床分期和淋巴结转移相关(P<0.05)。且随着病理分级、临床分期的增高,E2F-1表达逐渐增高而P27表达降低,见表2。
2.3 大肠癌组织中E2F-1与P27表达的关系
对大肠癌组织中E2F-1与P27表达水平进行相关性分析,E2F-1阳性表达的48例大肠癌中,2例P27阳性表达,E2F-1与P27表达呈显著负相关(P<0.01,r= -0.393)。

表2 大肠癌组织中E2F-1、P27的表达与临床病理特征的关系
3 讨 论
大肠癌的发生是一个渐进过程。它经历了正常大肠黏膜-上皮增生-腺瘤Ⅰ、Ⅱ、Ⅲ级-不典型增生-原位癌-大肠癌-转移的演进过程。早期阶段主要是细胞过度增生,进一步发生细胞增生调控紊乱,最终导致早期癌和转移,目前尚不清楚是哪些基因在肿瘤进展的哪个阶段发生突变或失调。但是,研究确定在G1期中存在一限制点(restriction point,R点)。一旦细胞周期跨过R点,细胞周期即为一自主性的过程,不再依赖于外界生长因子,所以G1-S对于细胞周期的运行和完成至关重要[1-2]。其中,核转录因子E2F-1对调节细胞由G1期进入S期起着至关重要的作用,转录因子E2F-1可与DP蛋白家族(DP1和DP2)结合形成异二聚体,增强其转录活性;也可与Rb结合形成异二聚体,抑制其转录活性[3]。
研究发现,E2F-1在多种肿瘤的发生发展过程中发挥了复杂的作用,起到癌基因或抑癌基因的作用。在食管鳞状细胞癌、胃癌和涎腺肿瘤中均可见到E2F-1的过度表达[4-7]。在小细胞肺癌,E2F-1可以作为一种生长促进因子,促进肿瘤增殖,是预后不好的指标[8]。但是,也有一些实验结果却表明[9-11],E2F-1的过表达可以终止细胞的过度增生和诱导细胞凋亡,起到抑癌基因的作用[12]。
作者在对人大肠石蜡标本研究中发现,E2F-1更多的表现为癌基因的作用。在正常大肠黏膜、大肠腺瘤以及大肠癌中E2F-1蛋白阳性表达逐渐增高。在大肠癌组中E2F-1蛋白的阳性表达率明显高于正常组和大肠腺瘤组。由此推断在大肠癌的发生过程中,E2F-1过表达起到了促进作用。同时,在大肠癌组织中,E2F-1阳性表达与大肠癌的组织分级、临床病理分期以及淋巴结转移有关。且随着大肠癌组织分级和临床病理分期增高,E2F-1表达也逐渐增强,表明E2F-1的过表达在一定程度上可以反映大肠癌的生物学特性,其表达水平越高,肿瘤的侵袭力越强,恶性度就越高。
p27 是细胞周期蛋白依赖性激酶抑制剂 (cyclin - dependent kinase inhibitors,CKI)家族中的重要一员,是一种抑癌基因,在多种肿瘤中发现有该蛋白水平下降[13]。p27可直接抑制cyclin - CDK复合物的生物学活性,使细胞停滞于G1期,同时具有促进细胞分化、介导细胞间黏附及诱导凋亡等功能[14]。本实验研究发现,P27从正常大肠黏膜到大肠腺瘤到大肠癌中表达逐渐下降,提示P27在大肠癌的发生中可能起重要作用。本实验研究亦发现P27蛋白表达与大肠癌的分化程度、浸润深度、TNM分期以及淋巴结转移均有关。P27蛋白水平在低分化、有淋巴结转移、肿瘤转移时降低,提示P27蛋白表达率降低的大肠癌更易发生淋巴结及远处转移和肌层浸润。故认为P27低表达是大肠癌预后不良的一个独立指标。P27蛋白表达与肿瘤的恶性程度负相关,可能为P27的低表达时,对G1/ S期转换的抑制作用减弱,使细胞更易进入S期;P27表达能影响细胞间接触,下调P27能抑制细胞粘附从而促进肿瘤细胞扩散。
此外,本研究对E2F-1与P27相关性进行分析发现,在大肠癌中,E2F-1的高表达伴随着P27低表达,二者呈负相关;也说明二者在大肠癌中分别起着癌基因和抑癌基因的作用。
总之,在大肠癌组织中E2F-1过度表达以及P27表达缺失,对大肠癌的发生发展起着重要作用,检测E2F-1和P27在肿瘤组织中的表达情况可能成为评价肿瘤患者预后的重要指标。
参考文献:
[1] Zetterberg A, Larsson O, Wiman K G. What is the restriction point? [J].Curr Opin Cell Biol, 1995, 7 (6): 835-842.
[2] Blagosklonny M V, Pardee A B. The restriction point of the cell cycle[J]. Cell Cycle, 2002, 1 (2): 103-110.
[3] Wu Z, Zheng S, Yu Q. The E2F family and the role of E2F1 in apoptsis[J]. Int J Biochem Cell Biol, 2009, 41 ( 12 ) :2389-2397.
[4] 伍宏彪,吴巨钢,张鹏,等. 胃癌进展中转录因子e2f -1的表达变化及其意义[J].中国普外基础与临床杂志[J].2010,6(17):573-580.
[5] Etges A, Nunes FD, Ribeiro KCB, et al. Immunohistochemical expression of retinoblastoma pathway proteins in normal salivaryglands and in salivary tumors[J]. Oral Oncol,2004,40(3):326-331.
[6] Yamazaki K, Hasegawa M, Ohoka I, et al. Increased E2F-1 expression via tumor cell proliferation and decreased are correlated with adverse prognosis in patients with squamous cell cancer of the oesophagus[J]. J Clin Pathol,2005,58(9):904-910.
[7] Ebihara Y, Miyamoto M, Shichinohe T et al. Over-expression of E2F-1 in esophageal squamous cell cancer correlates with tumor progression[J].Dis Esophagus,2004,17(2):150-154.
[8] Gorgoulis VG, Zacharatos P, Mariatos G,et al. Inhibition of aldose reductase prevents growth factor induced G1-S phase transition through the AKT/Phosphoinositide 3-Kinase/E2F-1 pathway in human colon cancer cells[J]. Mol Cancer Ther, 2010,9(4):813-824.
[9] Hao H, Chen C, Rao XM,et al. E2F-1- and E2Ftr-mediated apoptosis: the role of DREAM and HRK[J]. J Cell Mol Med, 2011, 15(11):4930-4934.
[10] Gomez-Gutierrez JG, Garcia-Garcia A, Hao H,et al. Adenovirus-mediated expression of truncated E2F-1 suppresses tumor growth in vitro and in vivo[J]. Cancer,2010,116(18):4420-4432.
[11] Mary JE,Yan Bin D,Hailing Y,et al.E2F-1 Up-Regulates c-Myc and p14ARF and induces apoptosis in colon cancer cells[J].Clin Can Res,2001,7(11):3590-3597.
[12] Zacharatos P,Kotsinas A, Evangelou K,et al.Distinct expression patterns of the transcription factor E2F-1 in relation to tumour growth parameters in common human carcinomas[J].J Pathol,2004,203(3):744-753.
[13] Ana BQ, Gustavo F, Cristine D, et al. Expression of P27, p21WAF/Cip1 and p16INK4a in normal oral epithelium, oral squamous papilloma, and oral squamous cell carcinoma [J]. Anticancer Res, 2010,30(7): 2799-2803.
[14] Li O, Antonio M F, Steve O,et al. Incomplete folding upon binding mediates Cdk4/Cyclin D complex activation by tyrosine phosphorylation of inhibitor P27 protein [J]. J Biol Chem, 2011,286(26): 30142-30151.
