表达猪圆环病毒2型ORF2和猪IFN-γ基因重组腺病毒的免疫保护作用
2011-05-31裴党帅郑念广唐明森陈瑞爱罗满林
裴党帅,郑念广,唐明森,夏 芳,陈瑞爱,,罗满林,*
(1.华南农业大学,广东广州 510642;2.广东大华农动物保健品股份有限公司,广东新兴 527400)
表达猪圆环病毒2型ORF2和猪IFN-γ基因重组腺病毒的免疫保护作用
裴党帅1,郑念广1,唐明森1,夏 芳2,陈瑞爱1,2,罗满林1,2*
(1.华南农业大学,广东广州 510642;2.广东大华农动物保健品股份有限公司,广东新兴 527400)
本研究以构建的猪圆环病毒2型(PCV-2)ORF2和猪IFN-γ重组腺病毒(简称rAd-OI)为免疫原免疫30日龄、母源抗体为阴性的三元杂商品仔猪。25头猪随机分为5组,每组5头。A组肌注免疫rAd-OI 106.12TCID50/头,B组肌注免疫rAd-OI 107.12TCID50/头,C组肌注免疫rAd-OI 108.12TCID50/头,D组肌注免疫rAd-OI 109.12TCID50/头,E组不作免疫,留作攻毒对照。一免后21 d进行二免,二免后21 d进行第3次免疫,免疫后每周采血检测抗体水平。免疫后56 d(即第三次免疫后14 d)所有猪攻毒PCV-2,剂量为5×105.67TCID50/头。攻毒前后每周采血检测抗体水平及病毒血症情况。攻毒21 d后处死所有猪,检测组织中的病毒含量。结果显示C组的抗体水平一直显著高于其他各组,攻毒后的病毒血症也低于其他各组。结合抗体水平、免疫和攻毒后的临床症状以及病毒血症水平得出,C组的免疫剂量较为理想,此结果为PCV-2 ORF2及猪IFN-γ重组腺病毒疫苗的生产开发提供了理论依据。
PCV-2 ORF2和猪IFN-γ重组腺病毒;免疫保护;抗体测定
PCV(Porcine circovirus,PCV)在分类学上属于圆环病毒科,是一种小的、无囊膜的、环状单股DNA病毒,直径平均为17nm,是迄今为止发现的一种最小的动物病毒。根据猪圆环病毒的致病性、抗原性及核苷酸序列的差异,PCV被划分成无致病性PCV-1(Porcine circovirus type 1,PCV-1)和致病性PCV-2(Porcine circovirus type 2,PCV-2)两个基因型。PCV-2病毒基因组全长1 767或1 768个核苷酸[1-3],共编码11个开放阅读框架ORF(open reading frames,ORFs),其中 ORF1、ORF2是两个最大的阅读框,ORF1编码与复制有关的Rep蛋白,ORF2编码衣壳蛋白Cap蛋白。PCV-2 DNA以滚环方式复制,ORF1与ORF2间的茎环结构AA GTA TTAC为其复制起点[4]。两基因型之间ORF1比较保守,同源性为 83%,ORF2同源性为67%~70%。
PCV-2被认为是仔猪断奶后多系统衰竭综合征(Postweaning multisystemiac wasting syndrome,PMWS)的原发性病原,后来发现PCV-2还与猪皮炎与肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)、先天性震颤(Congenital termors,CT)、后期流产(Late-term abortions)和渗出性皮炎(Exudative epidermitis)等疾病密切相关,统称为PCV-2相关疾病。其主要临床表现为消瘦、生长迟缓、皮肤苍白、黄疸、呼吸困难和腹泻等,目前已成为危害我国养猪业及世界养猪业的重要免疫抑制性疾病之一[5-6]。1991年加拿大首次爆发PMWS,随之PCV-2迅速在北美洲、南美洲、欧洲、亚洲、大洋洲和非洲的各个养猪国家蔓延。目前我国PCV-2感染已相当严重,全国各大小猪场均存在PCV-2感染[7],PCV-2已经成为阻碍当今养猪业健康发展的重要病原之一。疫苗免疫作为防控PCV-2的主要手段,已成为国内外学者专家关注的热点。目前,国内外已有PCV-2灭活疫苗及亚单位疫苗注册上市,但其免疫效果还有待进一步提高[8-9]。随着分子生物学技术的发展,活载体疫苗、核酸疫苗等新型疫苗正在积极研究中,成为目前主要研究的热点。腺病毒载体是目前应用比较广泛的载体,由于其宿主范围广、感染性强、安全性高、外源病毒能游离表达等特点,被广泛应用于制药、基因工程疫苗、基因治疗以及肿瘤治疗等领域。Wang X等[10]以PCV-2 ORF2为目的基因,构建出了重组腺病毒rAd-Cap。免疫小鼠后,用间接ELISA、Western blot及病毒中和试验均可在免疫鼠血清中检测到PCV-2 ORF2抗体。用rAd-Cap免疫仔猪后也能检测到ELISA抗体及病毒中和抗体;攻毒后,免疫猪有短暂的发热,发热时间较攻毒对照组短,无其他明显的临床症状。闻晓波等[11]以构建好的PCV-2大庆分离株质粒pMD-18T/PCV-2为模板,PCR分别扩增去掉核定位信号肽的Cap蛋白基因(dNLS-ORF2)和 Rep蛋白基因(ORF1),将其串联克隆到原核表达载体pET 30α(+)上,成功构建了重组质粒 pET 30α-ORF2/ORF1,转化E.coliBL 21(DE3)pLysS感受态细胞,经 IPTG诱导后进行 SDS-PAGE电泳与Western blot分析,纯化后的重组蛋白与PCV-2阳性血清发生特异性反应,并能与免疫小鼠的抗血清发生特异性反应,说明重组蛋白具有较好的免疫学活性。刘根梅等将PCV-2 ORF2基因扩增后进行T/A克隆,亚克隆至腺病毒转移载体pShuttle-CMV,构建了重组穿梭质粒pShuttle-CMV-ORF2,经PCR方法和限制性内切酶酶切鉴定及测序鉴定后,经PmeI酶切线性化,在BJ 5183细菌中与腺病毒骨架载体pAD Easy-1同源重组获得重组腺病毒质粒pAD-CMV-ORF2,脂质体法转移AD-293细胞进行病毒的包装和扩增,成功构建了重组腺病毒rAD-CMV-ORF2,免疫接种小鼠后产生了较高的抗体水平[12]。可见,重组腺病毒免疫能够显著减轻免疫猪的病理变化及病毒血症,是有效的PCV-2候选疫苗。本研究在前人工作的基础上,以广东大华农动物保健品股份有限公司研发中心分子生物学实验室构建的rAd-OI为免疫原免疫30日龄仔猪,以检测rAd-OI的免疫效果,以期对rAd-OI疫苗的研发生产提供理论依据。
1 材料与方法
1.1 材料
rAd-OI为广东大华农动物保健品股份有限公司研发中心分子生物学实验室构建,PCV-2分离自临床表现为PMWS的仔猪腹股沟淋巴结,PK-15细胞、AD-293细胞为广东大华农动物保健品股份有限公司研发中心提供。
病毒基因组DNA/RNA快速提取试剂盒为Takara公司产品。质粒抽提试剂盒为Omega公司产品。荧光定量 PCR试剂盒为Invitrogen公司产品。PCV-2 ELISA抗体检测试剂盒为武汉科前动物生物制品有限公司产品,7500 Fast Real-Time PCR System为美国ABI公司产品。
1.2 方法
1.2.1 试验用动物分组及免疫方案 25头三元杂仔猪购自广东省新兴县,PCV-2母源抗体检测为阴性。实验猪随机分为5组,每组5头。A组肌注rAd-OI 106.12TCID50/头,B组肌注 rAd-OI 107.12TCID50/头,C组肌注rAd-OI 108.12TCID50/头,D组肌注rAd-OI 109.12TCID50/头,E组不作免疫,留作攻毒对照。一免后21 d进行二免。二免21 d后进行第三次免疫。免疫后每周采血检测抗体水平。免疫后56 d(即第三次免疫14 d)所有组攻毒PCV-2,剂量为5×105.67/头。攻毒前后每周采血检测抗体水平及病毒血症情况,观察猪只的临床反应情况。攻毒21 d后处死所有猪,检测组织中的病毒含量。
1.2.2 病毒扩增及PCV-2 TCID50的测定 采集的病料研磨后反复冻融 3次,离心吸取上清液经0.22 μ m滤膜过滤后接种 PK-15细胞,接毒后24 h用300 mmol/L的D-氨基葡萄糖作用细胞30 min,加足维持液继续培养48 h~72 h后收毒。扩增得到的PCV-2用PCR方法进行全基因扩增,将扩增得到的目的片段经纯化回收后连接pMD 18-T载体,转化DH5α感受态细胞后抽提质粒,进行菌液及质粒的PCR检测,并将PCR阳性的菌液送至Invitrogen公司进行测序鉴定,具体方法参考文献[13]。PCV-2 TCID50的测定按照文献[14]的方法进行,按Reed与Muench氏法计算病毒TCID50。
AD-293细胞用于扩增 rAd-OI。待细胞长至80%左右满时,加入病毒液37℃孵育1 h,加足营养液后继续培养48 h收毒。
1.2.3 免疫前后抗体水平监测 免疫前1 d采血,免疫后每周采血,监测抗体消长规律。抗体的检测按照猪圆环病毒2型ELISA抗体检测试剂盒的方法进行。
1.2.4 荧光定量PCR方法检测病毒血症水平
1.2.4.1 荧光定量PCR检测方法的建立 以PCV-2为模板进行PCR反应扩增ORF2,将扩增产物回收纯化后连接pMD 18-T载体,转化大肠埃希菌DH5α感受态细胞,在氨苄(Amp)抗性平板上筛选阳性克隆;在含Amp的 LB肉汤中震荡培养过夜,用DNA提取试剂盒提质粒,经PCR检测、双酶切检测阳性的质粒即为标准阳性质粒。标准阳性质粒用分光光度计测定浓度后换算为拷贝数,经10倍倍比稀释在荧光定量PCR仪上进行反应,得出各自的反应曲线,制作标准曲线。并对该方法的敏感性、特异性和重复性进行检测,具体方法可参考文献[15]。
荧光定量PCR检测方法的反应体系为:Super Mix-UDG 12.5 μ L,上 下 游引 物 各 1.5 μ L,探 针0.5 μ L,Rox 校正染料 0.5 μ L,DNA 模板 2.0 μ L,ddH2O 6.5 μ L, 总体积为 25 μ L 。
反应程序为:55℃,2 min;95℃,2 min;95℃,3 s;60℃,30 s,40个循环。
1.2.4.2 血清和组织中病毒含量的测定 取200μ L清亮无溶血的血清用病毒基因组DNA/RNA快速提取试剂盒提取DNA,以提取的DNA为模板进行荧光定量PCR反应,检测其中的病毒含量。
称取肺脏、腹股沟淋巴结0.05 g,充分研磨后用500μ L灭菌PBS溶解,反复冻融3次,12 000 r/min离心5 min,取200 μ L 上清液提取DNA,以提取的DNA为模板进行荧光定量PCR反应,检测其中的病毒含量。
2 结果
2.1 临床症状
各组猪在攻毒前体温都处于正常范围,攻毒后免疫组体温略有上升,但不明显。攻毒对照组有两头体温上升较高,攻毒后7 d时高达41.5℃。与免疫保护组相比,攻毒对照组明显消瘦,各组均未出现黄疸及神经症状。
2.2 试验猪抗体消长情况
由表1可知,免疫组A在免疫后21 d抗体明显上升,免疫42 d后抗体达到阳性水平;免疫组B在免疫后28 d抗体明显上升,免疫35 d后抗体达到阳性水平;免疫组C在免疫后21 d抗体明显上升,免疫35 d后抗体达到阳性水平;免疫保护组D在免疫后21 d抗体明显上升,免疫35 d后抗体达到阳性水平;攻毒对照组在攻毒前抗体无显著变化,攻毒刺激后抗体有所上升。
2.3 剖检处死病变
所有猪在攻毒后21 d处死,观察病变。攻毒对照组可见肺脏大面积充血、坏死(图1E);腹股沟淋巴结肿大、坏死(图 1F);脾脏出血,边缘梗死(图1G);肾脏有白色点状坏死(图1H)。
2.4 组织病理学变化
试验猪处死后采集病料做组织切片观察病理变化。免疫保护组肺组织结构完整,未见病理变化(图2A)。腹股沟淋巴结未见明显病理变化(图2B)。脾脏结构完整,无明显病理变化(图2C)。肾脏结构正常(图2D)。攻毒对照组肺脏间质增宽,肺泡壁增宽,毛细血管腔扩张充血(图2E),淋巴细胞浸润(图2F)。淋巴结淋巴滤泡结构缺失,淋巴细胞排列疏松(图2G)。间质性肾炎,肾小管间淋巴细胞浸润(图2H)。
2.5 病毒血症情况
2.5.1 试验猪攻毒前后血清中的病毒含量
由表 2可知,攻毒后 3、7、14、21 d,C 组的病毒含量均明显低于其他各组。随着攻毒后时间的延长,各组的病毒含量均逐渐下降,且仍以C组的下降最为显著。
2.5.2 试验猪处死后脏器含毒情况
由表3可知,C组的病毒含量显著低于其他各组。说明C组的免疫剂量能够有效减少攻毒对猪体的侵害。
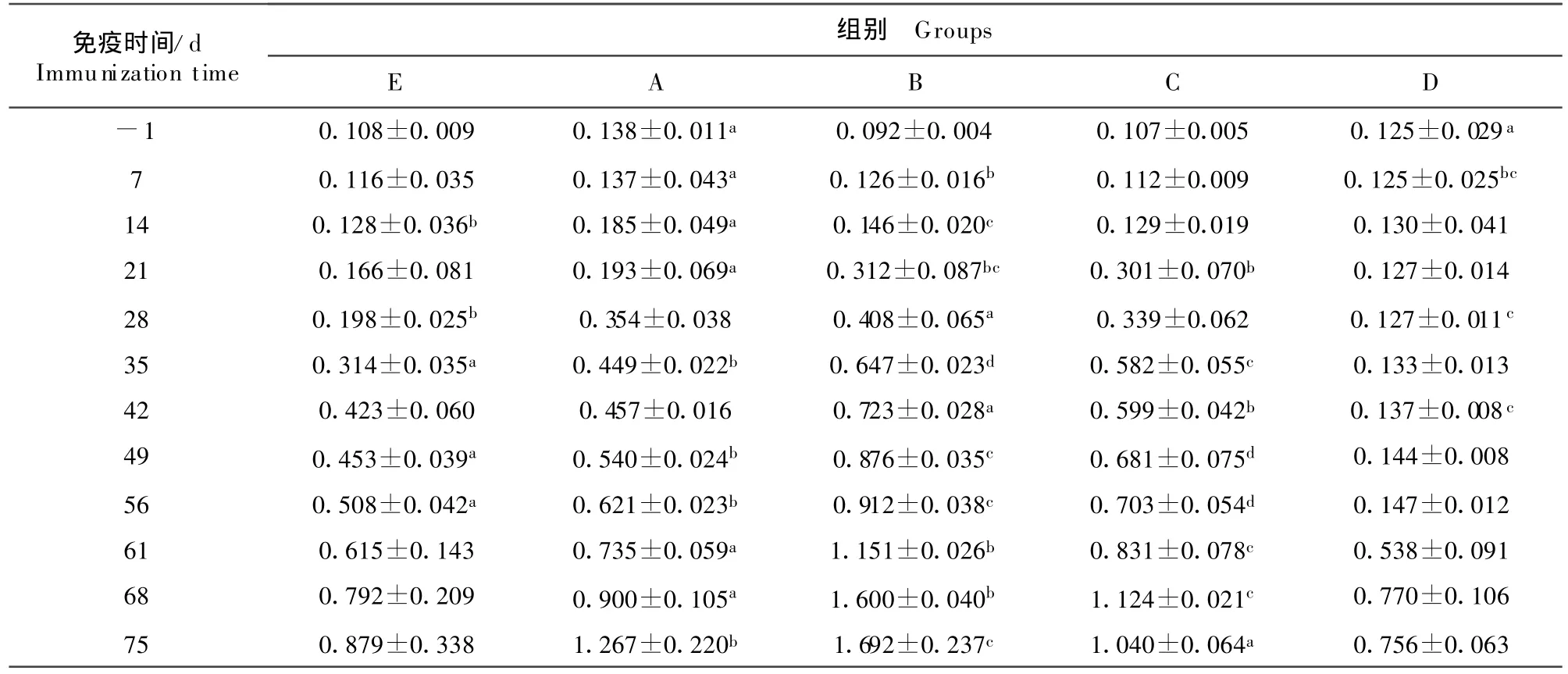
表1 试验猪抗体消长情况Table 1 The g rowth and decline of antibody level
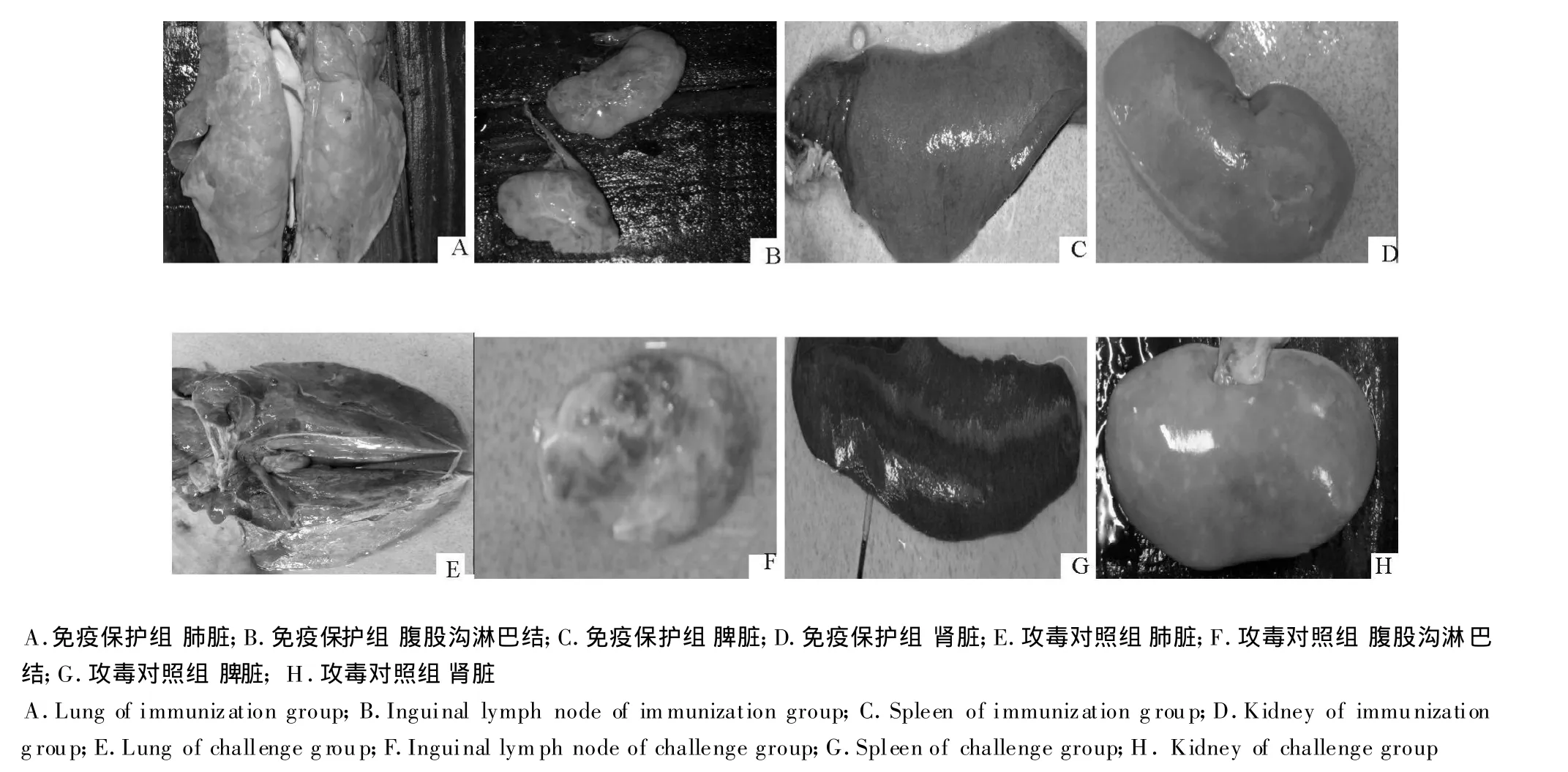
图1 试验猪剖检病变Fig.1 The pathological lesions of piglets

图 2 试验猪组织病理学变化(HE 40×)Fig.2 The histopathological lesions of piglets
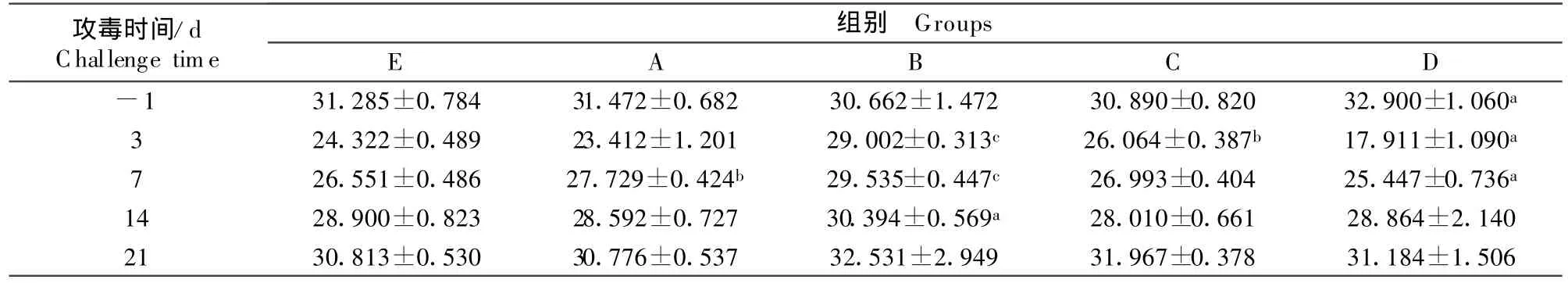
表2 试验猪攻毒前后血清中的病毒含量Table 2 The content of virus in serum of piglets before and after challenge

表3 试验猪处死后脏器含毒情况Table 3 T he content of virus in tissues of piglets
3 讨论
目前,PCV-2灭活疫苗主要有Merial公司研制的全病毒灭活疫苗Circovac,及Fort Dodge公司研制的PCV1-2嵌合全病毒灭活疫苗Suvaxyn PCV-2 one dose,灭活疫苗具有无毒、安全、性能稳定等优点,但对机体刺激时间比较短,需多次接种,且效果并不十分理想,而且PCV-2在细胞上的增殖滴度低,也给其制备生产增加了成本。国外已注册的亚单位疫苗主要有Intervet公司研制的Porcilis PCV及Boehringer-Ingelhein公司的CircoFLEX。两者均为杆状病毒表达的Cap蛋白亚单位疫苗,两剂量的Porcilis PCV及单剂量的CircoFLEX免疫3周龄及以上商品猪,均能产生强烈的伴有中和抗体的体液免疫反应,能减轻病毒血症,减少淋巴结组织损伤及PCV病毒载量[8]。但是表达亚单位Cap蛋白的杆状病毒需用昂贵的昆虫细胞培养系统,因而这些疫苗的生产成本较高,而且诱导的免疫应答主要为体液免疫,忽视了细胞免疫应答在PCV-2保护免疫中的作用[16]。Fenaux M 等[17]用 PCV-2的 ORF2替换PCV-1的ORF-2,成功构建减毒的嵌合PCV1-2,免疫SPF仔猪42 d后,大部分免疫猪血清中PCV Cap蛋白抗体均发生阳转,攻毒21 d后在所有免疫猪均未检查到病毒血症,淋巴结肿大及衰竭明显减轻,淋巴结中病毒DNA及抗原量较对照组显著减少,且抗体阴性猪对PCV-2也具有相当的抵抗力,表明细胞免疫在保护性免疫方面具有重要的作用。减毒活病毒疫苗虽然能诱导更强的免疫应答,但该疫苗的长期使用存在返强的危险,且增殖能力较低。
本研究中所用的攻毒毒株分离自临床表现为PMWS的仔猪,病料采集后经PCV-2特异性引物PCR检测为阳性,阳性病料接种PK-15细胞后扩增至第10代时仍能在细胞培养物中检测到病毒。由于PCV-2在PK-15细胞上不会产生肉眼可见的细胞病变,本研究对扩增出来的病毒液进行了间接免疫检测,具体方法参考文献[14],结果检测到了特异性的绿色荧光,说明病毒得以扩增。扩增出的病毒按间接免疫荧光方法和PCR方法分别测定其TCID50,两者得出的结果分别为10-5.62/0.1 mL和10-5.67/0.1 mL,两者差异不显著(P>0.05)。扩增出的病毒经纯化后按5 mL/头肌肉注射30日龄健康仔猪,未出现明显症状,但明显消瘦,剖检可见腹股沟淋巴结明显肿大,其他器官均正常。采集全血和腹股沟淋巴结、肺等脏器,经PCR检测均为阳性,经荧光定量PCR检测病毒含量显著高于对照组(P<0.05)。
本研究以不同剂量的rAd-OI作为免疫原免疫30日龄三元杂仔猪,用ELISA方法检测抗体消长情况,用荧光定量PCR方法检测免疫、攻毒及剖检后血清、脏器中的病毒含量,并对剖检所得组织制作病理组织学切片以观察各组织的病变情况。为了获得较高的抗体值,本试验共进行了三次免疫,每次免疫间隔21 d。结果表明,各免疫组在首免后42 d均达到了抗体阳性水平,且以C组抗体水平为最高,攻毒对照组在攻毒前抗体无显著变化。在实际生产中,只需进行两次免疫即可达到阳性。攻毒后在PCV-2的刺激下,各组的抗体均有明显的增加,攻毒对照组的抗体也达到了阳性标准,但仍以C组的抗体水平为最高。在病毒血症监测方面,攻毒后3、7、14、21 d以及处死后,免疫组C组的病毒含量都明显低于攻毒对照组。在攻毒后的临床症状、大体病变和组织病变方面,免疫组整体上也优于攻毒对照组。综合抗体水平、临床症状以及病毒血症水平,可以得出C组的免疫剂量较为合理。以上结果均说明,rAd-OI活病毒作为免疫原能够有效地刺激机体产生中和抗体,减轻病毒血症,减少PCV-2对脏器组织的损伤,降低组织器官的病毒含量。今后我们还将致力于研究rAd-OI对机体细胞免疫的影响,探讨rAd-OI免疫后各类细胞因子的变化情况。此外,还将探讨rAd-OI活病毒疫苗、rAd-OI灭活疫苗以及其他种类PCV-2疫苗的免疫效果差异。总之,本研究作为rAd-OI疫苗研制的前期临床性试验,为PCV-2疫苗的研发和猪圆环病毒病的防控奠定了基础。
[1]Hamel A L,Lin L L,Nayar G P.Nucleotide sequence of porcine circovirus associated with postweaning multisy stemic wasting syndrome in pigs[J].J Virol,1998,72:5262-5267.
[2]M eehan B M,M cNeilly F,Todd D,et al.Characterization of novel circovirus DNAs associated with wasting syndromes in pigs[J].J Gen Virol,1998,79(9):2171-2179.
[3]M ankertz A,Domingo M,Folch J M,et al.Characterisation of PCV-2 isolates from Spain,Germany and France[J].Virus Res,2000,66:65-77.
[4]Cheung A K.Rolling-circle replication of an animal circovirus genome in a theta-replicating bacterial plasmid inEscherichia coli[J].J Virol,2006,80(17):8686-8694.
[5]杨汉春.猪免疫抑制性疾病的流行特点与控制对策[J].中国畜牧兽医,2004,31(5):41-43.
[6]Segale′s J,Allan G M,Doming O M.Porcine circovirus diseases[J].Animal Health Res Rev,2005,6:119-142.
[7]祝卫国,党如意,杨增岐,等.陕西 7个地区猪2型圆环病毒(PCV2)感染的血清学调查[J].中国兽医杂志,2007,43(7):37-38.
[8]邢海云,赵建增,赵亚荣.猪2型圆环病毒疫苗的研究进展[J].中国生物制品学杂志,2009,22(3):305-308.
[9]Fo rt M,Sibila M,Pérez-M artí n E,et al.One dose of a porcine circovirus 2(PCV2)sub-unit vaccine administered to 3-weekold conventional piglets elicits cell-mediated immunity and significantly reduces PCV2 viremia in an experimental model[J].Vaccine,2009,27(30):4031-4037.
[10]Wang X,Jiang P,Li Y,et al.Protection of pigs against postweaning multisystemic wasting syndrome by a recombinant adinovirus expressing the capsid protein of porcine circovirus type 2[J].Vet Microbiol,2007,121(3-4):215-224.
[11]闻晓波,李冬野,李树东,等.猪圆环病毒2型ORF2-O RF1串联基因的原核表达及活性分析[J].动物医学进展,2010,31(2):41-44.
[12]刘根梅,谭实勇,陈瑞爱,等.猪圆环病毒2型ORF2重组腺病毒的构建与鉴定及其免疫效果研究[J].中国畜牧兽医,2010,37(5):60-65.
[13]唐小飞,谢芝勋,刘加波,等.猪圆环病毒2型广西株的分离和全基因组序列分析[J].动物医学进展,2007,28(10):12-16.
[14]芦银华,谈国蕾,华修国,等.应用间接免疫荧光试验检测猪圆环病毒抗体[J].中国兽医科技,2002,32:19-20.
[15]张福良,宋长绪,杨鸣琦,等.猪圆环病毒2型荧光定量PCR检测方法的建立[J].中国兽医学报,2010,31(2):248-250.
[16]黄红亮,邵定勇,罗满林,等.猪圆环病毒 2型疫苗研究进展[J].动物医学进展,2006,26(3):90-95.
[17]Fenaux M,Opriessnig T,Halbur P G,et al.A chimeric porcine circovirus(PCV)with the immunogenic capsid gene of the pathogenic PCV ty pe 2(PCV2)cloned into the genomic backbone of the nonpathogenic PCV1 induces protective immunity against PCV2 infection in pigs[J].J Virol,2004,78(12):6297-6303.
Immunological Protection of Recombinant Adenovirus Expressing PCV-2 ORF2 and IFN-γGene
PEI Dang-shuai1,ZHENG Nian-guang1,TANG Ming-sen1,XIA Fang2,CHEN Rui-ai1,2,LUO Man-lin1,2
(1.South China Agricultural University,Guangzhou,Guangdong,510642,China;2.Guangdong Dahuanong Animal Health Products Co.,Ltd,Xinxing,Guangdong,527400,China)
In this study,30 day-old,three-way cross merchandise piglets of maternal antibody negative were inoculated with the established recombinant adenovirus expressing PCV-2 ORF2 and porcine IFN-gamma gene.25 piglets were randomly divided into 5 groups of five piglets.Different doses of recombinant viruses were immunized through muscle injection,group A with 106.12TCID50,group B with 107.12TCID50,group C with 108.12TCID50,group D with 109.12TCID50,group E were not immunized,as for challenge control.The boost immunization was after 21 days of the first immunization.The third immunization was after 21 days of the boost immunization.In order to detect antibody level,the sera of piglets were collected weekly since the first immunization.After 56 days of the first immunization(after 14 days of the third immunization),all piglets were challenged with PCV-2,in 5×105.67TCID50.Before and after challenge,the sera of piglets were collected weekly for detecting antibody level.21 days after the challenge,all piglets were killed for Detecting virus contents of tissues.The results showed that the antibody levels of group C were significantly higher than that of other groups,and its viremia levels were also lower than that of others.The dose of group C was reasonable according to the antibody levels,clinical manifestation and viremia levels.The results provided theoretical basis for research and development of recombinant adenovirus expressing PCV-2 ORF2 and porcine IFN-γGene.
PCV-2 ORF2 and porcine IFN-recombinant adenovirus for detecting;immunological protection;antibody level;viremia
S852.659.2
A
1007-5038(2011)07-0033-06
2011-03-11
广东大华农动物保健品股份有限公司科研项目(033A201005-3)
裴党帅(1984-),男,陕西兴平人,硕士研究生,主要从事家畜传染病学研究。*通讯作者
book=38,ebook=49
