Ⅰ型鸭肝炎病毒PCR-DHPLC检测方法的建立
2011-05-31肖西志梁成珠凌宗帅张太翔岳志芹
孙 涛,肖西志,徐 彪,梁成珠,凌宗帅,张太翔,岳志芹
(1.山东出入境检验检疫局,山东青岛 266002;2.潍坊出入境检验检疫局,山东潍坊 261041;3.济南出入境检验检疫局,山东济南 250014)
Ⅰ型鸭肝炎病毒PCR-DHPLC检测方法的建立
孙 涛1,肖西志1,徐 彪1,梁成珠1,凌宗帅3,张太翔2,岳志芹1
(1.山东出入境检验检疫局,山东青岛 266002;2.潍坊出入境检验检疫局,山东潍坊 261041;3.济南出入境检验检疫局,山东济南 250014)
用RT-PCR结合变性高效液相色谱技术(DHPLC),建立Ⅰ型鸭肝炎病毒的快速检测方法。根据获得的Ⅰ型鸭肝炎病毒(DHV I)RNA聚合酶基因序列,应用Primer Premier5.0软件设计了1对引物,RT-PCR扩增产物经变性高效液相色谱进行快速检测。以正常鸭胚尿囊液、正常鸭肝组织、鸭瘟病毒、番鸭细小病毒、鹅细小病毒、H5N1亚型禽流感病毒、鸭源新城疫病毒、传染性法氏囊病病毒作对照进行特异性检测;将强毒株核酸稀释成不同梯度,做灵敏度检测;同时将该方法与病毒分离和荧光定量RT-PCR方法做人工感染样品的平行检测。结果表明,该方法有很好的特异性,且灵敏度高,检测限可达到4 pg的DHV I核酸模板,与荧光定量PCR检测结果一致。PCR-DHPLC对DHV Ⅰ强毒株人工感染鸭组织脏器的检测结果与荧光定量PCR检测结果的阳性检出率均为100%,对脑、脾、肺病料的检出率显著(P≤0.01)高于病毒分离,PCR-DHPLC与荧光RT-PCR检测方法相比较,两种方法检测DHVⅠ的符合率为100%。研究表明该方法可用于诊断Ⅰ型鸭肝炎病毒,是一种有效的新方法。
Ⅰ型鸭肝炎病毒;RT-PCR;变性高效液相色谱
Ⅰ型鸭病毒性肝炎(Serotype I duck viral hepatitis,DVH I)是由Ⅰ型鸭病毒性肝炎病毒(Duck hepatitis virus serotypeⅠ,DVHⅠ)引起的雏鸭的一种急性高度致死性传染病[1],主要侵害3周龄以内的雏鸭,以肝炎为特征,病死率可达90%以上,是危害养鸭业最为严重的传染病之一。DHV有Ⅰ型、Ⅱ型和Ⅲ型,3个型有着明显的差异,无交叉免疫性[2]。DVHⅠ最先于1950年在美国发现[3],我国于1963年在上海首次报道了该病的临床病例,目前,在全国各养鸭地区均有不同程度的发生和流行[4]。针对该病,现已有多种检测DHVⅠ抗原的的方法,如病毒中和试验、免疫电镜[5]、Dot-ELISA[6]和RT-PCR[7-8]等,这些方法在DVHⅠ的诊断中各有优势,但还达不到高通量集成化诊断的要求[9-10]。因此,需要研究一种能够对鸭肝炎病毒进行高通量快速排查、准确鉴别的集成化诊断技术。变性高效液相色谱(denaturing high-performance liquid chromatography,DHPLC)是近年发展起来的一种简单、快速、非凝胶的核酸分析方法,它利用样品分子对固定相亲和力的差异,在用流动相洗脱时,不同大小或者不同序列的核苷酸片段分子在固定相上移动速率不同而达到分离的目的[11]。一般来说,产物分子相差1%的片段即能够被分开。例如,100 bp的产物能和101 bp的产物分开,而用常规8 g/L的琼脂糖凝胶电泳,其相差10 bp的片段大小也是无法被分离。因此,利用 DHPLC可以区分不同长度 DNA片段的特点,进行细微差异的DNA序列分析即可从毒株水平快速识别各亚型病原。根据各种亚型特有基因组序列,设计引物进行PCR扩增,然后利用DHPLC检测,一次可以同时分析数百个样本,达到快速检测Ⅰ型鸭肝炎的目的。目前国内外已见报道用于进行大肠埃希菌等食品微生物的检测鉴别[12-14]、致病微生物耐药菌株的鉴别筛选及遗传疾病的基因诊断[15-16]等。DHPLC技术根据核酸检测分析要求,可采用非变性、部分变性和完全变性几种不同的分析模式,基于核酸扩增片段差异的微生物鉴别检测技术采用非变性分析模式。本文采用核酸扩增与非变性DHPLC分析相结合的技术原理,首次建立了快速检测鸭病毒性肝炎的高通量检测分析方法。
1 材料与方法
1.1 材料
1.1.1试验材料 Ⅰ型DHV强毒株(含毒鸭胚尿囊液)为四川农业大学禽病研究中心惠赠;鸭瘟病毒(duck plague virus,DPV)、番鸭细小病毒(MPV)、鹅细小病毒(GPV)、传染性法氏囊病病毒由山东农业大学惠赠;禽流感病毒H5N1亚型核酸材料、鸭源新城疫病毒核酸材料由山东出入境检验检疫局食品农产品检测技术中心禽病实验室保存。1日龄樱桃谷鸭(经ELISA检测器血清中DVH I抗体阴性)购自山东省农业科学院家禽研究所。
1.1.2 主要试剂 M-MLV反转录酶、Razoal RNA提取试剂盒购自Promega公司;鸭病毒性肝炎荧光定量检测试剂盒为本室自行研发;PCR扩增用酶,采用TOYOBO公司KOD-PLUS DNA polymerase;三乙胺乙酸盐(TEAA,色谱纯)购自T ransgenomic公司;乙腈(色谱纯)购自 TEDIA 公司;引物由上海Invitrogen生物技术公司合成;胰化蛋白胨、酵母抽提物;琼脂糖、氨苄青霉素等均购自上海生工生物工程技术服务有限公司;硅胶膜型质粒DNA小量提取试剂盒、PCR产物回收试剂盒、Gold-View TM 染色剂均购自北京博瑞克基因技术有限公司。其他常规化学试剂购自北京化学试剂公司。
1.1.3 主要仪器设备及生物信息学分析软件 变性高效液相色谱仪器(T ransgenomic Wave 4500)为北京环球基因公司产品;AllegraTM21R高速冷冻离心机为BeckmanCoulter公司产品;Sigma1-15普通离心机为Sigma公司产品;Premer 5.0引物设计软件。
1.2 方法
1.2.1 引物设计 通过Internet登陆美国国立生物信息技术中心(NCBI),查询检索已公布的鸭肝炎病毒RNA聚合酶基因序列。利用Primer Premier5.0软件设计一对引物(表1)。

表1 设计的引物和预期目的片段大小Table 1 Primers and size of expected products
1.2.2 人工感染试验 健康的1日龄樱桃谷鸭30只,随机分成 A、B 2组。A组 20只,每只皮下注射1万个LD50的DHV Ⅰ型强毒株,采集发病死亡鸭的心 、肝、脾、肺 、脑,置-20 ℃保存;B 组 10 只,每只皮下注射无菌生理盐水作正常对照。
1.2.3 病毒株RNA的提取及逆转录 含毒尿囊液经10 000 r/min离心5min后取上清。人工感染病变肝组织0.3 g,按1∶5用生理盐水研磨,冻融3次,8 000 r/min离心 10 min,取上清。使用 Promega公司提供的Razoal一步法试剂盒提取 RNA保存备用,具体方法按RNA提取试剂盒说明书进行,用同样方法从正常鸭胚尿囊液和健康鸭的肝脏中提取核酸作为对照。逆转录反应采用Promega公司的M-MLV反转录酶对病毒RNA进行反转录。取5 μ L已制备的RNA,加入20 pmoL通用引物,70℃热吸附 5 min,继续加入5×Fisrt standing buffer 4 μ L,0.1 M DT T 2 μ L,2.5 mmol/L dNTPs 2 μ L,M-MLV 1 μ L,RNase out 1 μ L,DEPC 水4 μ L,37 ℃作用1 h,95 ℃5 min。
1.2.4 RT-PCR体系的建立 确定 RT-PCR的最佳反应模式,将反转录产物进行10倍连续稀释,分别对 PCR 反应的引物(0.05、0.1、0.2、0.4、0.8 μ mol/L),Mg2+(0.5、1.25、2、2.75、3.5 mmol/L),dNTP(0.02、0.05、0.12、0.25、0.5 mmol/L),TaqDNA 聚合酶(0.005、0.01、0.02、0.05 、0.1 U/μ L),退火温度(45、50 、55、59、62 ℃)、循环次数(20、25、30、35、40 循环)进行优化 ,建立针对该病毒的RT-PCR最佳反应体系。
1.2.5 DHPLC分析条件 色谱柱:PS-DVB﹠C18 DNASep色谱柱(4.6 mm×50 mm,粒度3 μ m);柱温:50 ℃;流动相:0.0 min,55%缓冲溶液A,45%缓冲溶液B;0.5 min,50.2%缓冲溶液A,49.8%缓冲溶液B;2.4min,44.2%缓冲溶液A,55.8%缓冲溶液B;4.3 min,40.9%缓冲溶液A,59.1%缓冲溶液B;6.1 min,38.8%缓冲溶液A,61.2%缓冲溶液B;8 min,37.3%缓冲溶液A,62.7%缓冲溶液 B;流速:0.9 mL/min;检测器:荧光检测器(光源:150 W Xenon灯;激发谱带宽:15 nm;发射谱带宽:15.3 nm;检测灵敏度:在波长350 nm积分2 s);上样量:PCR产物 5 μ L。在非变性分析模式下,采用双链 DNA多片段(double-stranded multiple fragment)分析模式,清洗模式采用Active,分析检测过程仪器梯度由Navigator software分析软件控制设定。
1.2.6 RT-PCR产物鉴定 依据1.2.4摸索的RT-PCR扩增条件,将反应体系增加到100 μ L以获得足够量的目的片段。扩增后的PCR产物依次用DNA纯化回收试剂盒纯化,纯化产物送与南京金思特公司测序。
1.2.7 PCR-DHPLC的特异性分析 对Ⅰ型鸭肝炎病毒及对照正常尿囊液进行同样步骤的RNA提取,与鸭瘟病毒(DPV)、番鸭细小病毒(MPV)、鹅细小病毒(GPV)、H5N1亚型禽流感病毒(AIV)、鸭源新城疫病毒(NDV)、传染性法氏囊病病毒(IBDV)、按照RT-PCR扩增条件和DHPLC分析条件一同进行特异性试验,同时以SPF尿囊液和健康鸭肝组织RNA为阴性对照。
1.2.8 多重PCR敏感性分析 DHVⅠ强毒株核酸经过核酸蛋白仪检测定量后,用双蒸水稀释成每10 μ L含 4×105、4×104、……,4×10-2pg核酸共计8个稀释度,各取10 μ L分别进行 PCR-DHPLC和荧光定量PCR检测。
1.2.9 PCR-DHPLC在检测DVH Ⅰ中的应用将采集的人工感染死亡鸭的心、肝、脾、肺、脑,分别用病毒分离法,荧光定量PCR法和PCR-DHPLC方法同步进行检测,并将结果进行比较。
2 结果
2.1 RT-PCR最佳反应条件的建立与产物的鉴定
经过比较筛选,DVH的RT-PCR最佳反应条件参数为 :引物各 0.2 μ mol/L;Mg2+为 2 mmol/L;TaqDNA聚合酶0.05 U/μ L;反应循环数为35;最佳退火温度为55℃,将已知鸭肝炎病毒RT-PCR产物测序结果通过DNASTAR软件与GenBank中相关毒株进行分析比较。同源性均高达98%以上。表明PCR扩增产物为预期目标产物。
2.2 PCR-DHPLC的特异性结果
RT-PCR扩增后,经DHPLC分析,出现特征吸收峰图,而正常鸭胚尿囊液、鸭瘟病毒(DPV)、番鸭细小病毒(MPV)、鹅细小病毒(GPV)、H5N1亚型禽流感病毒(AIV)、鸭源新城疫病毒(NDV)、传染性法氏囊病病毒(IBDV)在DHPLC分析图谱中未出现与上述一致的特征峰图。图1显示上述几种毒株的DHPLC分析图谱,图中还显示部分阴性毒株样品的检测图谱。
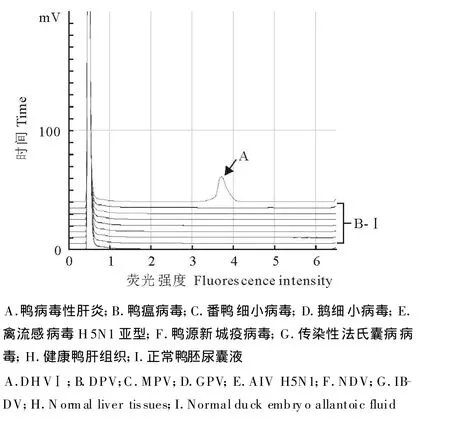
图1 DVHⅠ的PCR-DHPLC特异性检测图谱Fig.1 Specificity of PCR-DHP LC for detecting DHVⅠ
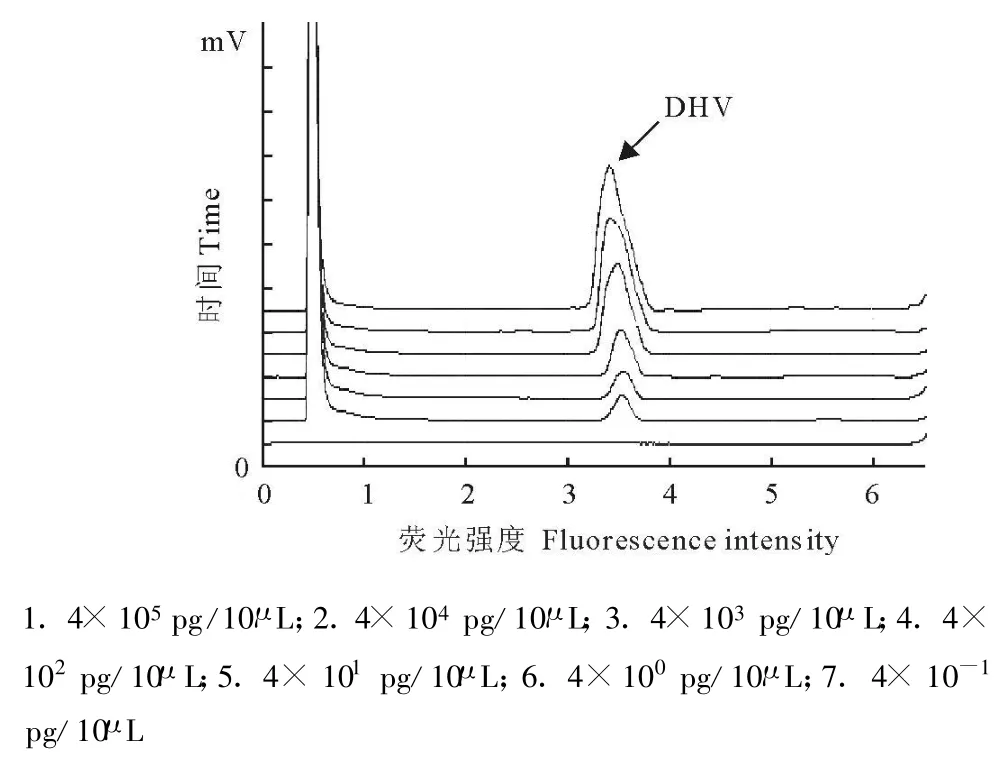
图2 PCR-DHPLC检测DHVⅠ的灵敏度图谱Fig.2 Sensitivity of PCR-DHPLC for detecting DHVⅠ
2.3 对人工感染样品的检测
用病原分离,荧光定量PCR及PCR-DHPLC方法分别检测人工感染DHVⅠ强毒的樱桃谷鸭,至10日龄时全部死亡,死亡雏鸭各脏器检测结果见表2。正常对照鸭各种检测结果均为阴性。采用PCRDHPLC和病原分离法同时检测517份采集的进口鸭棉拭子,检测结果均为阴性,两种方法对阴性的符合率为100%(517/517)。
2.4 PCR-DHPLC的敏感性结果
敏感性试验结果表明(图2),PCR-DHPLC方法最低能检测出4 pg的DHV I核酸模板。荧光定量PCR方法同步检测DHVⅠ核酸稀释模板,同样检测低限达到4 pg(图3)。
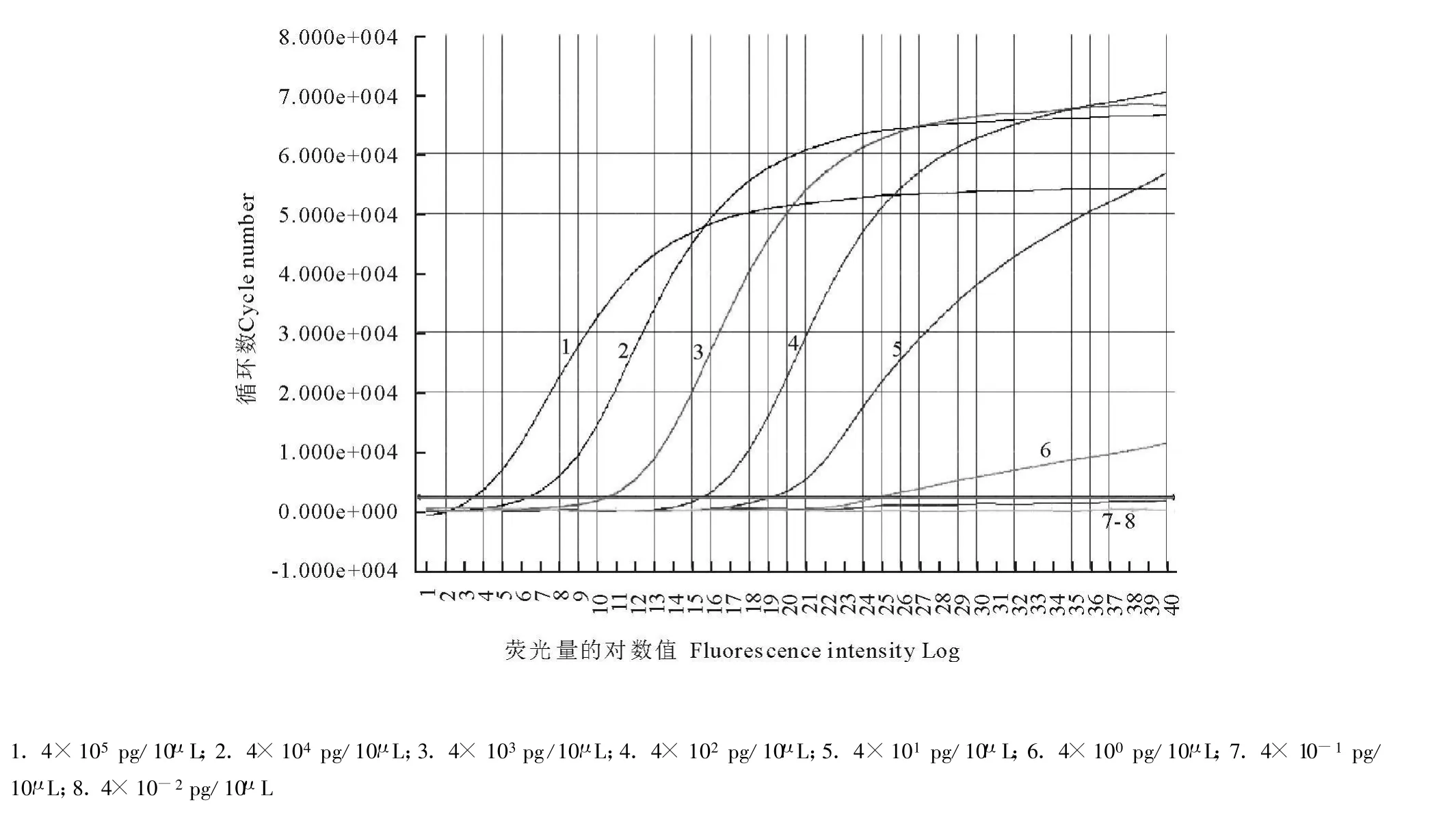
图3 荧光定量PCR检测DHVⅠ的灵敏度图谱Fig.3 Sensitivity of real-time PCR fo r detecting DHVⅠ
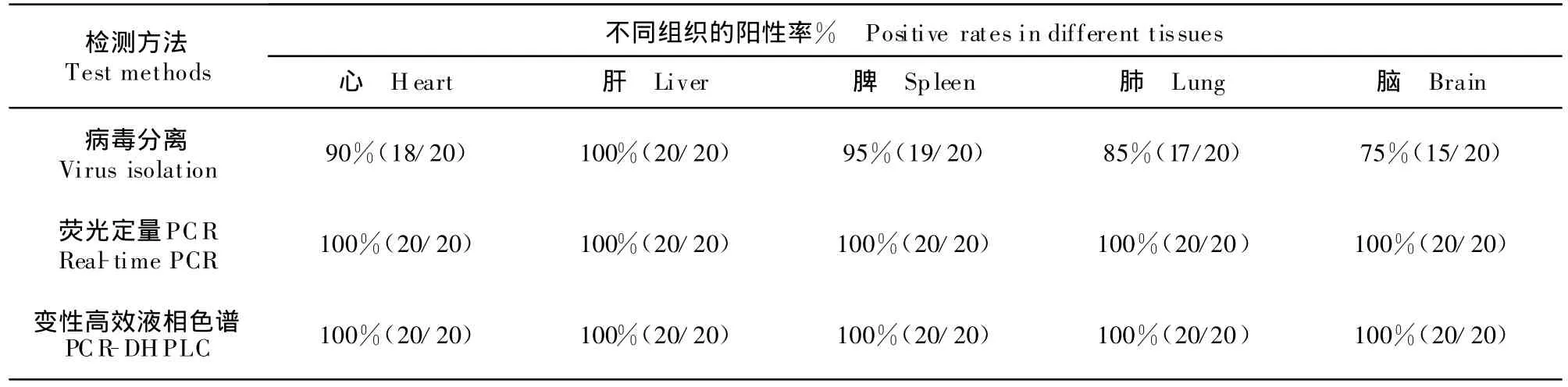
表2 病毒分离、荧光定量PCR和PCR-DHPLC对DHV I强毒人工感染死亡鸭不同组织的检测结果Table 2 Isolation,real-time PCR and PCR-DHPLC detection results of tissues from dead ducks ex perimentally infected with DHV I
3 讨论
DVHⅠ是危害养鸭业最为严重的传染病之一。由于DHVⅠ在自然条件下感染成年鸭后感染者可长期带毒和排毒而不出现临床症状,但进入环境中的DHVⅠ对4周龄内的雏鸭却有高致病性,从而导致该病毒在鸭群中广泛传播。因此建立检测快速、敏感、特异的诊断方法是有效预防和控制该病的关键措施之一。目前,对DVHⅠ的诊断主要依靠临床诊断和病毒的分离鉴定。虽然很多实验室都对DHVⅠ的检测建立了诊断方法,但仍存在不易标准化,敏感性较低[17]等现象。
本研究针对DVHⅠ设计了特异性引物,建立的PCR-DHPLC诊断方法可对鸭肝炎病毒进行快速诊断,扩增的基因片段在变性高效液相色谱中上样处理,可对病毒进行准确鉴别区分,极大的节约了时间和人力。同时,鉴于DVHⅠ可感染不同品种的鸭,亦可感染鹅[18],故本文结合DVHⅠ感染的生产实际,对鸭瘟病毒、番鸭细小病毒、鹅细小病毒、H5N1亚型禽流感病毒、鸭源新城疫病毒、传染性法氏囊病病毒进行了检测,结果表明,所建立的PCR-DHPLC具有很好的种特异性,此外,由于分离DVHⅠ时常用鸡胚接种,在临床检测时也多取病变肝脏,故本研究以正常鸡胚尿囊液和健康鸭肝脏作为对照,以取得临床检测的实际意义。
据报道,以倍比稀释的RNA模板进行扩增,刘艳萍等[19]建立的 RT-PCR方法最低检出量为55 pg,程安春等[8]建立的方法最低检出量为30 pg,而宋永峰等[20]建立的RT-PCR方法检测新型鸭病毒性肝炎病毒最低检出量可达21 pg。在本研究中,PCR产物经DHPLC上样处理后,最低检出量可达4 pg。比普通凝胶电泳检测高一个数量级,与荧光定量检测低限基本一致,可适应于出入境检验检疫的需要。
虽然在核酸检测方面,以荧光PCR方法最为敏感,但成本较高。采用DHPLC技术可一次自动分析数十甚至数百个样品,实现了对核酸分子的高通量自动化分析,其特征图谱可精确到几个碱基的差异,不仅避免了常规PCR电泳检测的繁琐和易造成污染等问题,准确性也显著提高,其试剂成本仅相当于常规PCR,在实际应用方面优势显著。将DHPLC技术与核酸扩增技术相结合建立新型核酸分析手段,在微生物的快速检测鉴别等方面也具有很大的开发应用潜力。例如Franciosa G等[21]曾报道了利用变性高效液相色谱鉴定肉毒杆菌神经毒素A、B、E和F型基因的研究,Hurtle W 等[12]利用DHPLC能够分析rRNA序列变化的特性,建立了鼠疫耶尔森氏菌(Yersinia pestis)和炭疽杆菌(Bacillus anthracis)的特异性吸收谱图,为微生物鉴定的高通量检测提供了新的方法。
本研究采用核酸扩增联合非变性DHPLC分析方法对Ⅰ型鸭肝炎病毒建立了PCR-DHPLC鉴别检测分析手段。发挥了变性高效液相色谱技术在鉴定重大禽类烈性病时快速、敏感的优势,避免了常规的病毒分离试验在亚型鉴定时无法检测滴度较低的毒株和出现非特异性交叉现象。在对采集的人工感染的阳性临床样品的检验中,该法和鸡胚病毒分离以及荧光定量PCR方法均表现出很高的符合率,说明建立的方法可以用于微量病毒检测。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[2]Woolcock P R.Duck hepatitis[M].Diseases of Poultry.2003.
[3]Levine P P F J.A hitherto-undescribed virus disease of ducks in No rth America[J].Cornell Vet,1950(40):71-86.
[4]黄显明,张小飞,魏建忠,等.Ⅰ型鸭病毒性肝炎研究进展[J].动物医学进展,2007,28(11):78-81.
[5]程安春,汪铭书,廖得惠,等.应用胶体金免疫电镜技术检测鸭肝炎病毒[J].中国兽医杂志,1994,20(6):3-4.
[6]马秀丽,宋敏训,李 峰,等.Dot-ELISA用于雏鸭病毒性肝炎的诊断[J].山东家禽,2004,3(9):6-8.
[7]Kim M C,Kwon Y K,Joh S J,et al.Development of one-step reverse transcriptase-polymerase chain reaction to detect duck hepatitis virus type 1[J].Avian Dis,2007,51(2):540-545.
[8]程安春,汪铭书,信洪一,等.Ⅰ型鸭病毒性肝炎病毒 RT-PCR检测方法的建立[J].中国兽医科学,2007,37(1):38-42.
[9]Choi Y K,Goyal S M,Kang S W,et al.Detection and subtyping of swine influenza H1N1,H1N2 and H3N2 viruses in clinical samples using two multiplex RT-PCR assay s[J].J Virol M eth,2002,102(1-2):53-9.
[10]Taubenberger J K,Layne S P.Diagnosis of influenza virus:coming to grips with the molecular era[J].Mol Diagn,2001,6(4):291-305.
[11]Colosimo A,Guida V,Flex E,et al.U se of DHPLC for rapid screening of recombinant clones[J].Biotechniques,2003,34(4):706-8.
[12]Hurtle W,Shoemaker D,Henchal E,et al.Denaturing HPLC for identifying bacteria[J].Biotechniques,2002,33(2):3868-3901.
[13]Jacinto R C,Gomes B P,Desai M,et al.Bacterial examination of endodontic infections by clonal analy sis in concert with denaturing high-performance liquid chromatography[J].Oral Microbiol Immunol,2007,22(6):403-410.
[14]徐君怡,曹际娟,郑秋月.变性高效液相色谱检测食品中致泻大肠杆菌[J].微生物学报,2008,48(11):1526-1531.
[15]Nam Y H,Lee S H,Ahn Y C,et al.[Detection of rifampin resistant mycobacterium tuberculosis complex using denatu-ring HPLC][J].Korean J Lab Med,2008,28(2):95-102.
[16]Saramaki O R,Waltering K K,Visakorpi T.Methods fo r identifying and studying genetic alterations in hormone-dependent cancers[J].Meth Mol Biol,2009,505:263-77.
[17]汪铭书,程安春,陈孝跃.鸭病毒性肝炎的研究——强毒在雏鸭体内的分布及排泄[J].中国兽医学报,1997,17(3):254-257.
[18]郭玉璞.我国鸭病毒性肝炎研究概况[J].中国兽医杂志,1997,23(6):46-48.
[19]刘艳萍,丁春宇,马学军,张大丙.用 RT-PCR检测鸭肝炎病毒[J].中国兽医杂志,2008,44(4):18-19.
[20]宋永峰,温纳相,宋延华,等.新型鸭病毒性肝炎病毒 RT-PCR检测方法的建立[J].中国家禽,2009,31(18):19-21.
[21]F ranciosa G,Pourshaban M,De Luca A,et al.Identification of type A,B,E,and F botulinum neurotoxin genes and of botulinum neurotoxigenic clostridia by denaturing high-performance liquid chromatog raphy[J].Appl Environ Microbiol,2004,70(7):4170-4176.
Establishment of the PCR-DHPLC Method for Identification of Duck Hepatitis Virus TypeⅠ
SUN Tao1,XIAO Xi-zhi1,XU Biao1,LIANG Cheng-zhu1,LING Zong-shuai3,ZHANG Tai-xiang2,YUE Zhi-qin1
(1.Shandong Entry-exit Inspection and Quarantine Bureau,Qingdao,Shandong,266002,China;2.Weif ang Entry-exit Inspection and Quarantine Bureau,Weif ang,Shandong,261041,China;3.J inan Entry-exit Inspection and Quarantine Bureau,Jinan,Shandong,250014,China)
A new molecular method for rapid detection of duck hepatitis virus typeⅠ(DHV Ⅰ)was established by using denaturing high performance liquid chromatography(DHPLC)combined with nucleic acid amplification in this study.According to the sequence of RNA polymerase gene of duck hepatitis virus typeⅠ(DHV Ⅰ),one pair of primers were designed by using Primer Premier 5.0.The PCR fragments were analysised by DHPLC compared to normal duck embryo allantoic fluid,duck plague virus(DPV),muscovy parvovirus(MPV),Avian influenza virus(AIV),Newcastle disease virus(NDV).They were tested to confirm the specificity of the PCR-DHPLC assay and no PCR products were amplified.The sensitivity of the assay DHVⅠwas as low as 4 pg.All results were 100 percent positive when the livers of dead ducks which were experimentally infected with DHVⅠvirulence were detected by the PCR-DHPLC and Real-time PCR.The positive rates by PCR-DHPLC were significantly higher(P≤0.01)than those by the virus isolation when samples were from spleen,lung and brain.T he samples from the ducks experimentally infected with DHVⅠwere tested by PCR-DHPLC and real-time PCR,showing 100%agreement for DHVⅠ.Results showed that the PCR-DHPLC is specific and sensitive,and can be used as a method to detect clinical samples.
Duck hepatitis virus typeⅠ;RT-PCR;denaturing high performance liquid chromatography
S858.32;Q789
A
1007-5038(2011)07-0013-06
2010-12-28
孙 涛(1981-),男,山东莱芜人,兽医师,硕士,主要从事动物传染病病原与生物制品学研究。
