猪巨细胞病毒PCR检测方法的建立及应用*
2011-05-31刘红亮徐志文王燕群魏浩澈郭万柱
刘红亮,朱 玲,徐志文,王燕群,魏浩澈,郭万柱,赵 玲
(四川农业大学动物生物技术中心 动物疫病与人类健康实验室,四川农业大学,四川雅安 625014)
猪巨细胞病毒PCR检测方法的建立及应用*
刘红亮,朱 玲*,徐志文,王燕群,魏浩澈,郭万柱,赵 玲
(四川农业大学动物生物技术中心 动物疫病与人类健康实验室,四川农业大学,四川雅安 625014)
参考GenBank中收录的猪巨细胞病毒(PCMV)DNA聚合酶基因序列设计合成了一对引物,扩增目的片段为236 bp。进行PCR检测方法的特异性、敏感性和重复性试验,建立了PCMV的PCR检测方法。结果表明,该方法对模板的最低检测量为1.1 pg,具有良好的特异性、敏感性和重复性。应用该法对猪同时感染PCMV和PRRSV相关性进行初步探究,36份PRRSV阳性病料中,PCMV检出率为63.89%。该法可用于PCMV的临床发病诊断和流行病学监测等。
猪巨细胞病毒;DNA聚合酶;PCR
猪巨细胞病毒(Porcine cytomegalovirus,PCMV),属β疱疹病毒亚科。1955年Done J T[1]在猪鼻甲骨黏膜黏液腺巨细胞中发现有大量嗜碱性核内包涵体,并首次从英格兰分离获得疱疹样病毒粒子。这是继伪狂犬病病毒之后发现的第2个猪疱疹病毒。因性质及其所致病变与人巨细胞病毒和豚鼠唾液腺病毒相似,而感染动物仅限于猪,故将该病毒称为猪巨细胞病毒[2]。该病毒在世界范围内广泛分布,据 Edington N[3]报道,早在 1986年,英国已有90%的猪群感染此病毒,其中大部分发生在管理良好、健康水平较高的农场。日本于1981年6月~11月,对45个都道府县的441例肉猪血清用间接荧光抗体法做了抗体调查,其中434例(98.4%)为阳性;1985年首次在日本分离到该病毒[4]。韩国[5]、北美和澳大利亚也有报道,其中美国发病率甚高,猪群的抗体阳性率为90%。
国内关于猪巨细胞病毒PCR检测的报道甚少,对猪巨细胞病毒病的调查报道亦少,近年来仅见广西有此病毒感染的初步调查[6]。本研究建立了猪巨细胞病毒的PCR检测方法,并用此法对四川省部分地区(遂宁、乐山、眉山、简阳、雅安和德阳)采集样品进行检测,对本病毒在这些地区的流行情况进行了初步的调查,为今后该病毒感染的诊断和防控提供依据。
1 材料与方法
1.1 材料
1.1.1 病毒与病料 PCV-2、PPV 、PRV 、PRRSV均由四川农业大学动物生物技术中心分离保存。方法建立所用PCMV阳性病料由实验室保存;36份检测样品为2009年1月~9月采集自四川部分地区规模化猪场,经PRRSV检测为阳性的病料(肺、淋巴结)。
1.1.2 主要试剂 克隆宿主菌E.coliDH5α由四川农业大学动物生物技术中心提供;DNA抽提试剂盒(小量)、胶回收试剂盒均购于博迈德公司;TaqDNA 聚合酶 、dNTP、10 ×Reaction buffer、MgCl2、pMD19-T载体均购于宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物设计 根据GenBank公布PCMV基因序列(登录号AF268040),利用Primer 5.0软件设计一对引物PCMV1/PCMV 2:上游引物PCMV 1:5′-CCTATGT TGGCACT GATACT TGAC-3′;下 游 引 物 PCMV2:5′-CCCTGAAAATCACCGTCTGAGAGA-3′,预扩增片段长236 bp。通过计算机网站(http://www.ncbi.nlm.nih.gov/BL-A ST/)分析,该对引物具有良好的特异性。引物由上海Invitrogen公司合成。
1.2.2 病料处理 取解冻的待检病料3 g,用灭菌的手术剪剪碎,加入适量的生理盐水或PBS溶液(pH7.2)混匀,用灭菌研磨器充分研磨,再用1.5 mL Eppedorf管分装,反复冻融2次~3次,置-70℃保存备用。
1.2.3 病毒DNA模板的制备 取病毒液和病料混悬液参照博迈德DNA小剂量抽提试剂盒说明书进行病毒DNA的提取。
1.2.4 PCR扩增及产物的鉴定 经反复筛选,最佳PCR 扩增体系为10×PCR buffer 2.5 μ L、dNTP(5 mmol/L)1 μ L 、上下游引物(20 μ mol/L)各0.5 μ L 、TaqDNA 聚合酶(5 U)0.5 μ L 、MgCl2(25 mmol/L)2.0 μ L 、模板 DNA 2 μ L,最后用无菌ddH2O补足至25 μ L(阴性对照不加模板,直接加无菌ddH2O补足至25 μ L)。最佳PCR反应条件为95℃预变性5 min;94℃30 s,55℃30 s,72℃30 min,共30个循环;最后72 ℃延伸10 min,产物4℃保存。PCR产物电泳后经DNA胶回收试剂盒回收目的片段,与pMD 19-T载体连接、转化 DH5α菌、扩大培养、提质粒,送上海Invitrogen公司测序,结果在NCBI上BLAST比对。
1.2.5 PCR特异性试验 按1.2.3所述方法提取PCV2、PPV 、PRV 、PRRSV 基因组做模板,按 1.2.4体系及方法进行扩增,以验证本方法的特异性。
1.2.6 敏感性试验 将提取的病毒核酸测定浓度后,用双蒸水做10倍系列稀释,取每个稀释度的病毒模板按1.2.4体系及方法进行PCR反应,以验证本方法的敏感性。
1.2.7 重复性试验 以建立的PCR方法,对同一模板重复检测3次,以验证本方法的重复性。
1.2.8 临床样品的检测 利用本方法对本实验室收集的四川不同地区,PRRSV检测为阳性的36份病料进行应用性检测。
2 结果
2.1 PCR扩增及鉴定
用引物PCMV1、PCMV2对模板进行PCR特异性扩增,在10 g/L的琼脂糖凝胶上进行电泳,扩增出的DNA约为236 bp(图1),阴性对照无条带,与预期结果一致。将与载体相连的阳性质粒送上海Invitrogen公司测序,进行BLAST比对,结果表明所得到的片段与GenBank收录的PCMV相应区域相似性达100%。
2.2 特异性试验
对PCMV模板进行PCR扩增后出现了约236 bp的目的条带,而 PCV-2、PPV 、PRV 、PRRSV及阴性对照全为阴性(图2)。

图1 PCM V PCR扩增结果 Fig.1 PCR Amplification of PCMV

图2 PCR特异性试验 Fig.2 Specificity test of PCR
2.3 PCR敏感性试验
将测定浓度后的病毒模板进行10倍倍比稀释,在相同的反应体系和反应条件下进行PCR检测,结果显示在稀释至10-5,仍有阳性条带可见,即在此PCR反应中,模板的最低检测量为1.1 pg(图3)。
2.4 重复性试验
对同一阳性模板进行3次重复检测,获得了一致的检测结果(图4)。
2.5 临床样品的检测
用此方法对36份采自四川不同地区PRRSV阳性的病料进行PCR检测,结果检出23份PCMV阳性,检出率达63.89%。

图3 PCR敏感性试验Fig.3 Sensitivity test of PCR
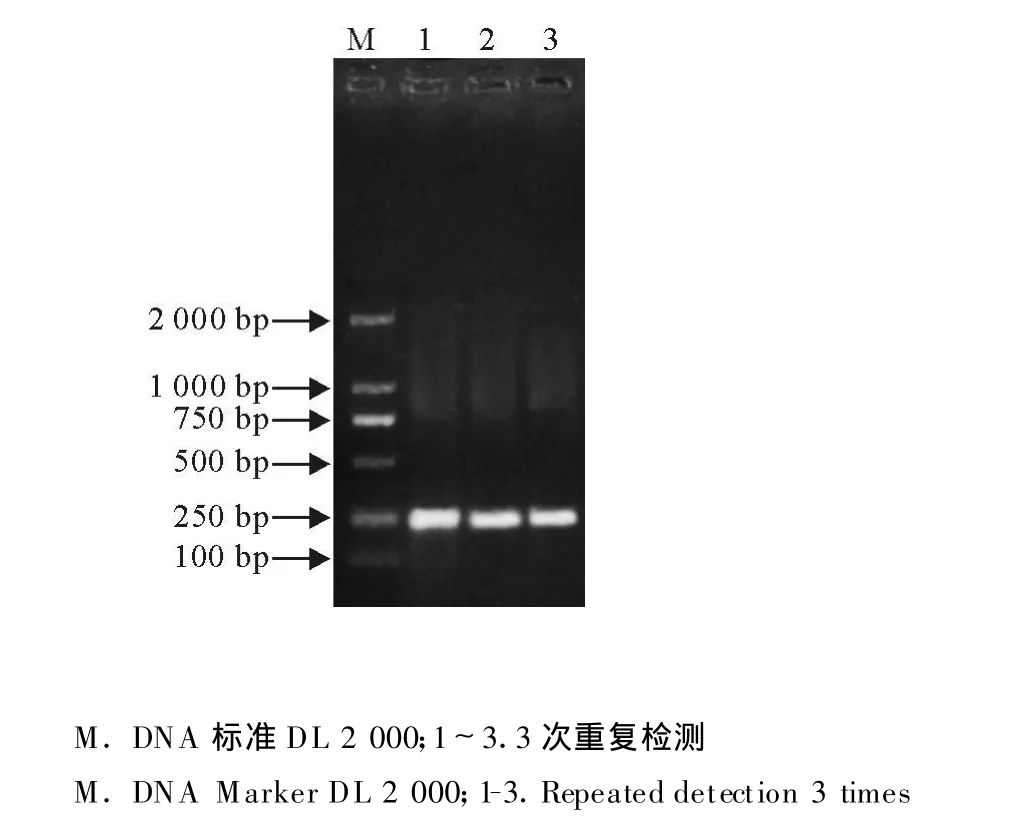
图4 PCR重复性试验Fig.4 Repeatability test of PCR
3 讨论
PCMV虽然在免疫功能正常的宿主中一般呈隐性感染,并不引起临床症状,但其感染率很高,当病毒被激活时,可能与一些疾病相关。近年来,国外关于PCMV的报道主要集中在其对异种移植的影响方面,有研究发现β疱疹病毒包括HHV-6、HHV-7及CMV能够在器官移植后引起器官移植受者产生机会感染,由此产生一系列症状和疾病,统称为CMV疾病(CMV disease)。同为疱疹病毒科的PCMV亦为异种移植中潜在的动物传染源。临床上广泛采用免疫抑制剂以克服器官移植引起的排斥反应,但免疫抑制剂的使用使机体免疫功能尤其是细胞免疫功能受损,从而引发各种术后感染。有人担心猪源病毒可能会随着移植器官传播[7-9]。虽然传播给人类并没有在体内证明,猪内源性逆转录病毒已被证明在体外能在人类细胞中进行复制[10-11],并且已有试验表明PCMV在体外能在人成纤维细胞中增殖[12]。鉴于PCMV在猪体内的高阳性率,对于人类,PCMV可能代表另一种潜在风险。
PCMV在体外增殖有一定难度,所以用病毒分离的方法检测较困难。此病的ELISA检测方法,在20世纪80年代已有报道[13-14],但是现有的 ELISA检测方法只能检测相关抗体,无法检测抗原。Hamel A L等[15]首次报道了应用PCR诊断本病,之后,Fryer J F L等[16]用定量竞争 PCR对不同的猪器官(包括用于异种移植供体)进行了病毒的检测。亦有对PCV、PRV和PCMV进行多重PCR检测的报道,并指出多重PCR检测的灵敏性较低,仅为单个PCR的十分之一[5]。上述方法应用于临床快速检测存在对设备要求较高,费用消耗较大,耗时较长等缺点。NCBI上已公布PCMV相关基因信息较少,主要为gB、MCP和DNA聚合酶基因。湖南农业大学[17]和广西大学[6]已有报道通过扩增部分gB基因建立PCR检测方法;目前GenBank上只公布有一个MCP基因,其保守性无法分析;而国内以DNA聚合酶为模板设计引物建立的检测方法仅见刘兴彩等[18]报道,通过MegAlign软件对已公布的PCMV DNA聚合酶进行序列分析,其相似性高达99%以上,说明此区适合用于检测。鉴于以上原因本研究选择DNA聚合酶保守区作为模板设计一对引物,通过计算机在线分析,该对引物具有良好的特异性。经试验证明该检测方法能有效用于临床诊断和流行病学调查,具有简单、快速、敏感等特点。
近年来猪高热病的盛行,引发了人们对高热病的新思考,感染高致病性PRRSV是高热病的主要发病原因。有人认为猪感染PRRSV与感染PCMV具有很大的相关性。在本研究中,用建立的PCMV PCR检测方法对实验室近期保存的PRRSV阳性病料进行了检测,分析PRRSV和PCMV同时感染的概率,以初步考证这一说法。结果表明,在PRRSV阳性病料中PCMV阳性率高达63.89%(23/36),分析原因可能是PRRSV侵害机体的免疫系统,动物机体感染PRRSV后,抵抗力降低,易并发和继发其他病原体感染。亦有研究者根据病毒能持续感染肺泡巨噬细胞这一事实,推测该病毒可能具有免疫抑制作用[10]。但由于样品数量的局限性,该病在全地区的具体流行、分布情况及其与PRRSV感染的关系尚需进一步做大量的研究工作才能够得出科学客观的结果。
[1]Done J T.An “inclusion body” rhinitis of pig s[J].Vet Rec,1955,67:525-527.
[2]Davison A,Eberle R,Ehlers B,et al.The order Herpesvirales[J].Arch Virol,2009,154(1):171-177.
[3]Edington N.Diseases of swine[M].Iowa State:Iowa State University Press,1986:330-336.
[4]川村齐.猪巨细胞病毒感染症[J].国外兽医学:畜禽传染病,1992,12(4):16-18.
[5]Lee C S,Moon H J,Park S J,et al.Multiplex PCR for the simultaneous detection of pseudorabies virus,porcine cy tomegalovirus and porcine circovirus in pigs[J].J Virol M eth,2007,139:39-43.
[6]朱 伟,陈 磊,付 薇,等.广西猪细胞巨化病毒感染的初步调查[J].上海畜牧兽医通讯,2008(6):66-67.
[7]Auchincloss H,Sachs D H.Xenogeneic transplantation[J].Annu Rev Immunol,1998,16:433-470.
[8]Fishman J A.Infection and xenotransplantation[J].Ann N Y A cad Sci,1998,862:52-66.
[9]吴玉清,于 琦.疱疹病毒6、7、8型感染的研究进展[J].中国输血杂志,2005,18(1):70-73.
[10]Issa N,Wilkinson R,Griesemer A,et al.Absence of replication of porcine endogenous retrovirus and porcine lymphotropic herpesvirus type 1 with prolonged pig cell microchimerism after pig-to-baboon xenotransplantation[J].J Viro,2008,82(24):12441-12448.
[11]Scobie L,Takeuchi Y.Porcine endogenous retrovirus and other viruses in xenotransplantation[J].Current Opinion in Organ Transplantation,2009,14(2):175-179.
[12]Whitteker J,Dudani A,Tackaberry E.Human fibroblasts are permissive fo r porcine cytomegalovirusin vitro[J].T ransplantation,2008,86(1):155-158.
[13]Assaf R,Bouillant A M,Franco E D.Enzyme linked immunosorbant assay(ELISA)for the detection of antibodies to porcine cy tomegalovirus[J].Can J Comp Med,1982,46:183-185.
[14]Tajima T,T Hironao,Kajikawa T,et al.Application of enzyme-linked immunosorbent assay for the seroepizootiological survey of antibodies against porcine cytomegalovirus[J].J Vet M ed Sci,1993,55:421-424.
[15]Hamel A L,Sachvie C.PCR assay fo r detecting porcine cytomegalovirus[J].J Clin Microbiol,1999,37(11):3767-3768.
[16]F ryer J F L,Paul D Griffiths,Jay A Fishman,et al.Quantitation of porcine cy tomegalovirus in pig tissues by PCR[J].J Clin Microbiol,2001,1155-1156.
[17]李 晶,余兴龙,李润成等.猪巨细胞病毒的PCR检测及其基因特征分析[J].湖南农业大学学报,2009,35(5):521-525.
[18]刘兴彩,尹燕博,张 毅,等.猪巨细胞病毒(Porcine Cytomegalovirus,PCM V)PCR诊断技术的建立[C].中国畜牧兽医学会家畜传染病学分会第七届全国会员代表大会暨第十三次学术研讨会论文集:下册,2009:31-33.
Development and Application of a PCR Assay for Detection of Porcine Cytomegalovirus
LIU Hong-liang,ZHU Ling,XU Zhi-wen,WANG Yan-qun,WEI Hao-che,GUO Wan-zhu,ZHAO Ling
(Animal Biotechnology Center,Laboratory of Animal Disease and Human Health,Sichuan Agricultural University,Ya'an,Sichuan,625014,China)
A pair of primers were designed according to the DNA polymerase(DPOL)genes of porcine cytomegalovirus(PCMV)to develop a PCR assay for detection of PCMV,the length of the product is 236 bp.The specificity,sensitivity and repeatability of the PCR assay were conducted,the results indicated that the necessary dose of templates of the assay is 1.1pg and this method is sensitive,specific and repeatable.The positive rate of the 36 clinical samples,which are PRRSV positive,detected according to the method,was 63.89%of PCMV.This method is available to detect PCMV in clinic and epidemiological monitoring.
Porcine cytomegalovirus;DNA polymerase;PCR
S852.659.1;Q789
A
1007-5038(2011)07-0005-04
2010-12-17
“长江学者和创新团队发展计划”创新团队项目(IRT0848);四川省教育厅重点实验室项目
刘红亮(1987-),男,四川安岳人,四川农业大学动物医学专业2008级2班本科学生。*通讯作者
book=8,ebook=17
