2007年-2010年江苏省高致病性PRRSV分离株遗传特征分析
2011-05-31杨建泉顾丙泉王明珍金文杰秦爱建
杨建泉,钱 琨,顾丙泉,王明珍,金文杰,秦爱建*
(1.禽类预防医学教育部重点实验室,江苏省动物预防医学重点实验室,江苏扬州 225009;2.江苏如东县畜牧兽医站,江苏南通 226400;3.江苏省南通市动植物进出境检疫局,江苏南通 226000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种以妊娠母猪严重繁殖障碍以及仔猪的呼吸道症状和高病死率为特征的传染病。其病原PRRSV属于套式病毒目(Nidovirales)、动脉炎病毒科(Arteriviridae)、动脉炎病毒属(Arterivirus)成员。PRRSV的基因组为单股、不分节段的正链RNA,大小约15kb,包含有相互重叠的9个开放阅读框(open reading frames,ORFs),分别为 ORF1a、ORF1b、ORF2-ORF7。其中 ORF1包括ORF1a和ORF1b,位于基因组的5′端,长约12kb,约占整个基因组的80%,编码病毒复制所必需的非结构蛋白(nonstructural proteins,Nsps)。ORF2-ORF7位于病毒基因组3′端,全长约3kb,占整个病毒基因组20%,是病毒基因组的结构基因,主要编码病毒的结构蛋白GP2a、GP2b、GP3、GP4、GP5以及非糖基化囊膜基质蛋白(M)和核衣壳蛋白(N)[1]。
PRRS于1987年在美国的北卡罗纳、衣阿华等州首先报道,不久即传遍到了中西部,并在全美迅速蔓延。随后加拿大、德国、荷兰等一些国家先后暴发了该病。自1991年,亚洲地区的日本、韩国、菲律宾、我国台湾等都相继报道了该病[1]。我国大陆于1996年首次报道并分离到病毒[2]。现在PRRS已经成为世界性疾病,遍及世界各主要养猪国家与地区,并己成为危害养猪业最严重的传染病之一。2006年以来,我国暴发了一种以高热、高发病率、高死亡率为特征的“猪高热综合征”。通过国内学者的大量研究,证实高致病性PRRSV变异株是“猪高热综合症”的主要病因。其病毒基因与典型PRRSV相比在多处发生了特异性的变异,因此高致病性PRRSV 有 时 也 称 之 为 非 典 型 性 PRRSV[3-7]。PRRSV遗传及抗原性差异很大且易发病毒间重组,导致病毒基因组极易发生变异,因此如何弄清当前PRRSV流行毒株,特别是病毒ORFs的分子流行病学及变异规律,对有效诊断,并研制有针对性的疫苗,从而提高当前PRRSV疫苗保护率有着至关重要的作用。
本研究以江苏地区发病猪场为研究对象,发病现场采集病料分离病毒并鉴定,对不同分离株的分子遗传特征进行比较、分析,研究其遗传变异规律。研究结果对选择具有地方代表性的疫苗毒株,采取有针对性的措施来防控和消灭类似疫病的再次暴发和流行有着重要意义。
1 材料与方法
1.1 材料
1.1.1 病料 病料来自规模猪场患病猪的新鲜淋巴结和肺脏组织以及2007年-2010年采集的江苏不同地区发病猪的肺、脾、肾、淋巴结等组织病料。样品采集地均暴发“猪高热综合征”,以患病猪体温升高,大批怀孕母猪流产,断奶仔猪死亡为主要特征,这些猪场均未免疫过PRRS疫苗。
1.1.2 细胞与病毒 Marc-145细胞由中国农科院上海兽医研究所袁世山研究员惠赠;阳性对照JXwm06病毒液由中国农业大学杨汉春教授惠赠。
1.1.3 主要试剂 高糖型DMEM为GIBCO公司产品;新生牛血清(NBS)为兰州民海生物公司产品;RNasin Inhibitor、dNTP 、1kb DNA Marker、Taq DNA聚合酶为Fermentas公司产品;反转录酶(MMLV)、T4DNA Ligase、pGEM T easy为Promega产品;AxyPrep Multisource Total RNA Miniprep Kit为美国AxyGEN公司产品;DNA Marker DL 2 000为TaKaRa公司产品;抗PRRSV N蛋白特异性单克隆抗体由中国农业大学杨汉春教授惠赠。
1.2 方法
1.2.1 引物设计 参考GenBank登陆的基因序列,在Nsp2基因缺失区的两端保守区设计了一对引物,经典毒株扩增片段为734bp,而高致病性PRRSV扩增片段为644bp,上游引物为Nsp2-F 5′-ATCCCAGCCGCTCTGGCCGAA-3′,下游引物为Nsp2-R 5′-GACAGGAGCTGCTTGATGACAC-3′;另外,参照PRRSV VR2332株和CH-1a株的全长基因组序列,将PRRSV的全长基因组分为13个相互重叠的基因片段,设计了13对引物(表1)用于病毒全基因组的扩增。
1.2.3 病毒Nsp2基因和全序列基因组PCR扩增按照AxyPrep Multisource Total RNA Miniprep Kit进行病毒RNA的提取,并用 M-MLV reverse transcriptase(Promega,USA)进行cDNA合成用于PCR扩增。
1.2.3.1 Nsp2基因扩增 取1μL cDNA为模板,依次加入10×buffer 5μL、Mg2+4μL、dNTP(10 mmol/L)2μL、用于检测PRRSV Nsp2基因片段的上下游引物 (25pmol/L)各1μL、Taq DNA 聚合酶(5U/μL)1μL,加超纯水至总体积为50μL。反应条件为:95℃5min;94℃1min,59℃1min,72℃1min,共30个循环;72℃延伸10min。取PCR产物用10g/L琼脂糖凝胶电泳回收纯化阳性条带连接到T载体,经验证后送上海Invitrogen公司测序。
1.2.3.2 PRRSV全长基因的扩增 PCR总体积采用50μL体系,依次加入以下试剂:10×PCR buffer 5μL、Mg2+4μL、dNTPs(10mmol/L)2 μL、P1(25pmol/μL)1μL、P2(25pmol/μL)1μL、Taq DNA polymerase(5U/μL)1μL、cDNA 1μL,最后补加灭菌超纯水至50μL,轻轻混匀后,按下列反应参数进行PCR扩增。反应条件为95℃5min;94℃1min,根据各对引物的Tm值设置的退火温度退火1min,72℃1.5min,共30个循环;72℃延伸10min。反应产物用10g/L琼脂糖凝胶电泳鉴定,回收纯化阳性条带连接到T载体,经验证后送上海Invitrogen公司测序。
1.2.4 病毒分离培养 无菌采集血液与组织病料。血液在4℃条件下,8 000r/min离心10min,收集上清接种细胞;采集的组织病料,加入3倍~5倍体积的DMEM培养基和青链霉素,用匀浆器研磨后,将组织匀浆冻融3次,然后于8 000r/min离心10 min,收集上清接种细胞。
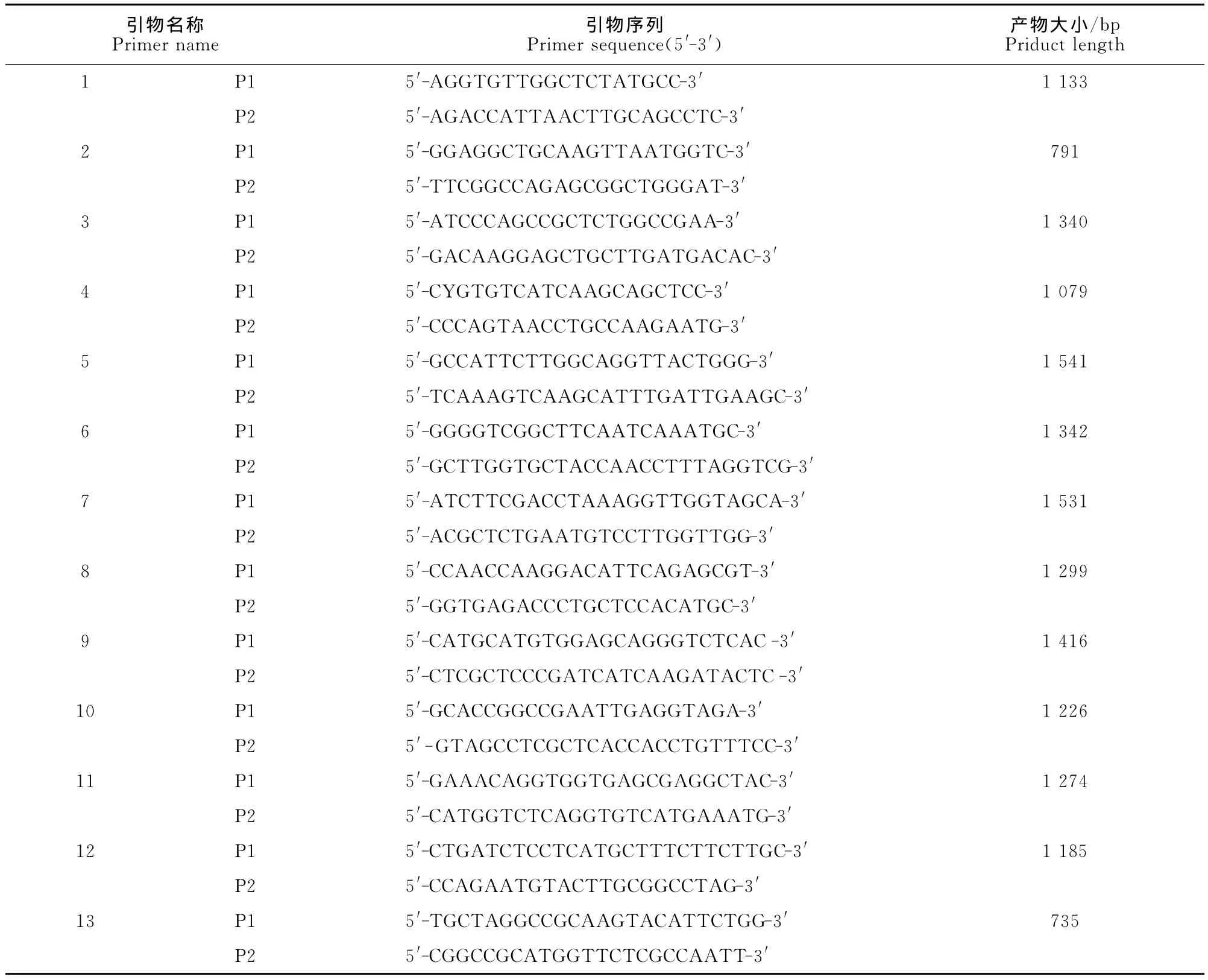
表1 Nsp2部分基因及RD2007株病毒全基因组扩增引物Table1 Primers used to amplify the whole genome of RD2007and partial Nsp2gene
Marc-145细胞长成单层后,弃上清,用超纯水配制的PBS洗涤细胞表面,弃PBS洗液,接种1mL待检样品,37℃吸附2h,弃去样品,添加含10 mL/L小牛血清的DMEM维持液,置于37℃、体积分数为5%的CO2培养箱中。连续培养6d~7d,每天观察细胞病变情况。
1.2.5 间接免疫荧光鉴定 接种待检病料的细胞孔待出现明显细胞病变时,弃去培养液,每孔加入200μL预冷的固定液(丙酮∶乙醇=3∶2)固定5 min。弃去固定液,用PBS洗涤、置超净台吹干,4℃过夜,加入适当稀释的抗PRRSV N蛋白单抗,200 μL/孔,37℃温育45min,PBS洗涤,加入200μL的1∶100稀释的FITC标记羊抗鼠IgG(SIGMA),37℃温育45min,用PBS洗涤3次,每次5min,荧光显微镜下观察并记录结果。
1.2.6 基因序列比对与分析 应用DNA Star和MEGA 4软件对测序序列连同已发表的PRRSV核苷酸序列进行遗传变异分析,确定PRRSV江苏分离株与已发表的PRRSV核苷酸和氨基酸序列的同源性,同时绘制系统进化树。
2 结果
2.1 江苏地区的PRRSV的PCR结果
利用材料方法中的Nsp2基因引物对临床送检病料进行RT-PCR扩增,Nsp2-F和 Nsp2-R引物能够从病料中特异性的扩增出644bp大小的条带,证实江苏地区近年来仍然有高致病性PRRSV存在(图1)。
2.2 临床PRRSV分离与鉴定
将处理后的病料接种于Marc-145细胞分离病毒,观察细胞病变并利用间接免疫荧光试验(IFA)和RT-PCR试验对分离病毒进行鉴定,结果证实从临床病料中分离得到了PRRSV,并命名为PRRSV RD2007株(图2)。
2.3 PRRSV RD2007株基因组全序列测定及序列分析
经PCR反应体系的优化获得全基因的13个片段(图3),克隆测序,将获得的序列信息拼接后,获得PRRSV RD2007株的全基因组序列。PRRSV RD2007株基因组全长15 319bp,包含9个开放阅读框,与美洲型分离株各个基因区段的长度相近,在Nsp2基因中有不连续的30个氨基酸的缺失。
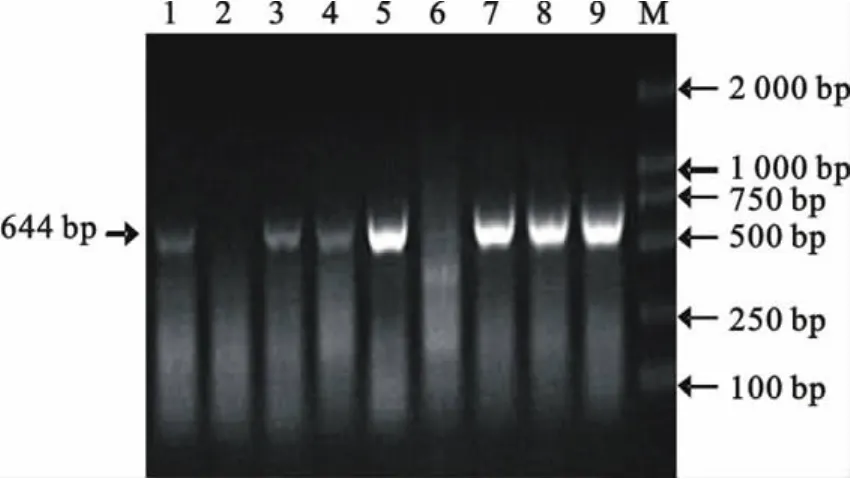
图1 部分临床样品的RT-PCR扩增结果Fig.1 RT-PCR results of partial clinical samples
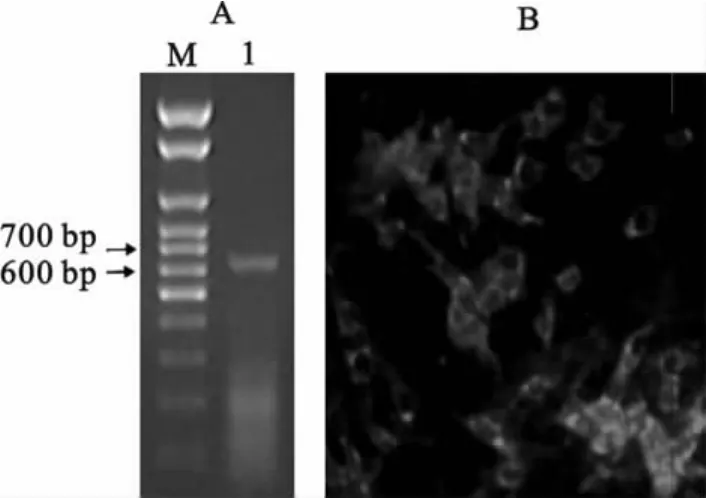
图2 RD2007株病毒分离鉴定结果Fig.2 Identification results of PRRSV RD2007strain
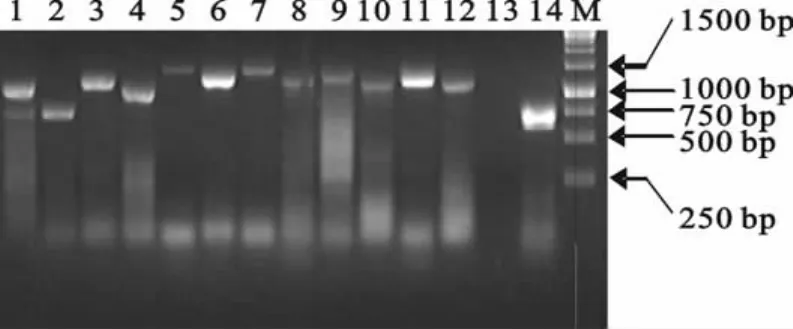
图3 PRRSV-RD-2007株各基因的分段扩增结果Fig.3 Divided fragments of RD2007 genome for amplification
应用DNA Star软件对不同PRRSV分离株的各个开放阅读框进行序列同源性的分析。结果显示,RD2007株与国内外各美洲型分离株的全基因序列核苷酸同源性在88.8%~99.3%之间,而与欧洲型代表毒株LV的全基因序列核苷酸同源性只有60.7%比较结果。各个基因片段同源性分析显示,PRRSV RD2007株的ORF1a同其他分离株相应片段差异明显,主要是因为Nsp2存在缺失引起的。与22个美洲型PRRSV代表毒株的ORF1a的核苷酸同源性在87.1%~99.1%。变异较大的蛋白还包括GP3和GP5,与22个美洲型PRRSV代表毒株的GP3和GP5的同源性分别在88.6%~100%和88.7%~99.5%之间。
将PRRSV RD2007株与其余34株PRRSV全长基因组序列进行多重序列比对,运用DNA Star绘制系统发育树。结果发现RD2007株与美洲型代表毒株VR-2332处于同一分支,与欧洲型代表毒株LV的遗传距离较远,属于美洲型毒株。同时与其他10株高致病性PRRSV(JXA1、HUN4、YN2008、Henan-1、HUB1、SY0608、LN、SHH、GDSD1、HEB1)的亲缘关系最近(图4)。
2.4 PRRSV RD2007株ORF5基因遗传变异分析
PRRSV RD2007株ORF5基因由603bp组成,编码201个氨基酸。氨基酸同源性序列比较分析表明,RD2007株与美洲型代表毒株VR-2332的氨基酸同源性是89.4%,与国内最早分离到的PRRSV CH1a株和BJ-4株的氨基酸同源性分别为90.5%和86%。与高致病性PRRSV代表毒株JXA1、WUH1和HUN4的同源性分别是99.0%、99.5%和99.5%。然而与欧洲型PRRSV代表毒株LV株的氨基酸同源性只有59.2%。氨基酸序列分子遗传比较分析,发现在GP5序列中存在两个高变区,分别位于N端信号肽和抗原表位处。同时分离株的ORF5基因还存在较高的氨基酸点突变,突变位置主要集中于3位~39位N端信号肽区域附近。其中,13位与151位氨基酸均为R,具有强毒株的特征;分离株的L39突变为I39,而位于中和表位之前一位非中和表位A29突变为V29。
图4 PRRSV分离株全长基因组序列的进化树分析Fig.4 Phylogenetic analysis based on full-length PRRSV RD2007sequence
3 讨论
RT-PCR检测结果显示临床病料中的病毒都为高致病性的PRRSV,包括分离株PRRSV RD2007株在内,第481位氨基酸和533位~561位氨基酸都存在不连续的30个氨基酸缺失,Nsp2基因的这一特征与已报道的2006年以来在我国流行的高致病性PRRSV缺失部位完全一致,从而再一次证实PRRSV为“猪高热综合征”的主要病原[8-11]。试验结果还表明高致病性PRRSV仍然在江苏部分地区存在,虽然大部分养殖场都已经进行了疫苗免疫,这可能与PRRSV各分离株之间存在着广泛的抗原多样性有关。
PRRSV各型不同毒株之间的变异率可以高达10%,而在PRRSV众多编码的蛋白中GP5是最容易发生变异的基因之一,GP5的变异主要集中在一级序列的变化,糖基化位点的缺失或修饰等方面[1]。本研究中江苏地区分离株PRRSV RD2007ORF5编码的氨基酸序列与其他23个国内外毒株的ORF5的氨基酸序列进行遗传变异比较分析发现,与美洲型代表毒株VR-2332的氨基酸同源性是89.4%,与国内最早分离到的PRRSV CH1a株和BJ-4株的氨基酸同源性分别为90.5%和86%。与高致病性PRRSV代表毒株JXA1、WUH1和HUN4的同源性分别是99.0%、99.5%和99.5%,然而与欧洲型PRRSV代表毒株LV株的氨基酸同源性只有59.2%,说明随着时间的推移,PRRSV RD2007株病毒发生了变异。根据ORF5氨基酸序列比对分析发现分离到的PRRSV全基因组中ORF5基因存在较高的氨基酸点突变,突变位置主要集中于3~39位N端信号肽区域附近,与以往的报道一致[1,12]。其中,13位与151位氨基酸均为R,具有强毒株的特征;分离株的L39突变为I39,而位于中和表位之前一位非中和表位A29突变为V29,该非中和表位能够延缓机体产生中和抗体,从而可能促进病毒逃避机体的体液免疫。造成这些突变的主要原因可能是在生存选择的压力下,病毒总是朝着有利于在宿主间传播和在宿主体内持续存在的方向变异。这些氨基酸的变异对GP5蛋白亲水性、疏水性和抗原性等特性有何影响,是否会导致病毒毒力的变化还有待进一步的研究与分析。通过对分离株RD2007的分子遗传变异分析表明,其全长基因组序列与美洲型代表毒株VR-2332的同源性为89.2%,与欧洲型代表毒株LV的同源性为60.7%,而与高致病性PRRSV的同源性在98.5%~99.3%。从全基因组进化树分析发现,美洲型毒株与欧洲型毒株分别处在两个不同的分支。RD2007株与美洲型代表毒株VR-2332处于同一分支,与欧洲型代表毒株LV的遗传距离较远,属于美洲型毒株。在美洲型PRRSV分支中,2006年以来分离鉴定的高致病性PRRSV又处于同一个分支,显示了较高的亲缘关系,据此推测此分离毒株与高致病性PRRSV代表株可能有着共同的起源。
本研究利用RT-PCR方法检测了2007年-2010年间江苏省PRRSV流行情况,并分离了PRRSV RD2007毒株,进行了全基因组分子遗传变异的分析,为PRRSV的快速诊断和鉴定流行PRRSV的基因型奠定了基础,同时为江苏省PRRSV疫苗毒的选择提供了依据。
[1]Zhou L,Chen S,Zhang J,et al.Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China[J].Virus Res,2009,145:97-105.
[2]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国畜禽传染病,1996,18(2):1-4.
[3]Tong G Z,Zhou Y J,Hao X F,et al.Highly pathogenic porcine reproductive and respiratory syndrome,China[J].Emerg Infect Dis,2007,13:1434-1436.
[4]高志强,郭鑫,杨汉春,等.猪繁殖与呼吸综合征病毒缺失变异株的基因组特征[J].畜牧兽医学报,2005,36(6):578-584.
[5]张建武,庄金山,袁世山.中国部分地区高致病性猪繁殖与呼吸综合征病毒的分子流行病学研究[J].中国农业科学,2008,41(6):1822-1831.
[6]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,6:e526.
[7]Li Y,Wang X,Bo K,et al.Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China[J].Vet J,2007,174:577-584.
[8]Li Y,Wang X,Jiang P,et al.Genetic analysis of two porcine reproductive and respiratory syndrome viruses with different virulence isolated in China[J].Arch Virol,2008,153:1877-1884.
[9]王兴龙,李玉峰,周业飞,等.我国华东地区猪繁殖与呼吸综合征病毒流行株NSP2基因的遗传变异分析[J].中国预防兽医学报,2011,33(4):319-322.
[10]范培虎,危艳武,郭龙军,等.2005年-2010年我国部分地区PRRSV流行毒株的遗传变异分析[J].动物医学进展,2011,32(3):1-7.
[11]孙跃辉,黄金海,郭立力,等.PRRSV天津分离株Nsp2基因的克隆和遗传进化分析[J].动物医学进展,2010,31(4):26-29.
[12]李 平,吴发兴,朱紫祥,等.我国部分省区HP-PRRSV分离株ORF5基因遗传变异分析[J].动物医学进展,2009,30(9):1-6.
